褪黑素对人肺腺癌A549细胞的影响及作用机制的研究*
2015-05-25潘海媛严星姜鹏
潘海媛,严星,姜鹏
(1.解放军第82医院呼吸科,江苏淮安223001;2.解放军第82医院骨科)
褪黑素对人肺腺癌A549细胞的影响及作用机制的研究*
潘海媛1,严星1,姜鹏2**
(1.解放军第82医院呼吸科,江苏淮安223001;2.解放军第82医院骨科)
目的探讨褪黑素(MLT)对体外培养的人肺腺癌A549细胞迁移和侵袭能力的影响及作用机制。方法体外培养人肺腺癌A549细胞,通过不同浓度的褪黑素(0、0.1、0.5、1.0mmol/L)干预24、48、72h,通过划痕实验测定细胞迁移能力变化,Transwell侵袭小室测定实验检测MLT对A549细胞侵袭能力的影响,RT-PCR法检测MLT对细胞中NF-κBp65 mRNA表达的影响。结果褪黑素能够抑制人肺腺癌A549细胞迁移和侵袭能力,同时细胞内NF-κBp65mRNA量明显减少。结论褪黑素能够呈剂量依赖性抑制人肺腺癌A549细胞的迁移及侵袭,抑制核因子κBp65基因的转录是可能作用路径之一。
褪黑素;肺腺癌;核因子κB;迁移;侵袭
肺癌是最常见的肿瘤之一,并且发病率呈上升趋势,这与全世界的工业化、空气污染、吸烟等有关,其治疗手段多样,包括手术、放疗、化疗及生物治疗,尤其是分子靶向治疗发展迅速,但总体治疗效果并不令人满意,5年存活率较低,肿瘤的早期转移可能是治疗效果不佳的重要原因。褪黑素是一种主要由松果体分泌的天然激素[1],最早的研究重点是其生物钟作用[2],近年来的研究表明,褪黑素可能通过诱导肿瘤细胞凋亡[3]、拮抗某些生长因子如血管生成、侵袭等促进因子、调节机体免疫力[4]、对其他治疗的协同作用[5]、调节心理状态[6]等发挥抗肿瘤作用。本研究主要探讨褪黑素对A549细胞迁移和侵袭能力的影响,并进一步验证可能的作用机制。
1 材料与方法
1.1 实验细胞和试剂人肺腺癌A549细胞由唐都医院胸外科实验室提供。主要试剂:胎牛血清(四季青公司),低糖DMEM培养液(Gibco公司),褪黑素(Sigma公司),人工基底膜材料(Matrigel)及Transwell小室(BD公司),Trizol试剂盒及RTPCR试剂盒(Takara公司)。主要仪器:电热恒温干燥箱(北京科伟永兴仪器公司),显微镜(徕卡公司),实时定量PCR仪(Bio-Rad公司),凝胶成像分析系统(Alpha公司)。
1.2 实验方法和步骤
1.2.1 细胞培养及分组复苏冻存的人肺腺癌A549细胞,加入含双抗(青霉素、链霉素各100 U/ ml)体积分数10%胎牛血清的低糖DMEM培养液,置于5%CO2恒温37℃、培养箱内培养,第2d换液,以后隔天更换培养液,待贴壁细胞约80%融合时,0.25%胰蛋白酶消化传代培养。根据我们前期的实验结果,1.0mmol/L的MLT 48h内对细胞的增殖无明显影响,实验按照MLT浓度分为4组(n=4),MLT终浓度分别为0mmol/L(对照组control)、0.1mmol/L、0.5mmol/L、1.0mmol/L。实验重复3次。
1.2.2 划痕实验检测MLT对细胞迁移能力的影响0.25%胰酶消化细胞,10%胎牛血清培养基终止消化并吹打成细胞悬液,按3×104/孔接种入24孔板内,每组设6孔,细胞培养箱内培养,当培养至细胞融合约60%时进行实验。吸出培养液,用200μl枪头小心在孔底划痕,用无血清培养液将洗涤2次,吸净,加入含1%胎牛血清的培养液。倒置显微镜下选择划痕较直且无细胞残留的部位板底划线标记并拍照记录,继续培养。24h后吸去培养液,换加含10%胎牛血清的培养液,并加入不同量MLT,使其终浓度分别为0mmol/L、0.1 mmol/ L、0.5 mmol/L、1.0 mmol/L,继续培养18h,取出24孔板,对照第1次照片,显微镜下寻找拍照部位,相同放大倍数再次拍照。按照细胞迁移距离= (24h前细胞间距-24h后细胞间距)/2计算细胞实际迁移距离。以对照组平均距离记为1,各实验组取相对数标准化计算。
1.2.3 Transwell侵袭小室测定实验检测MLT对细胞侵袭能力的影响实验前晚从20℃冰箱中取出人工基底膜材料,4℃过夜融化成液态,用4℃培养基10倍稀释。吸取50μl稀释后的基底膜材料滴入8μm Transwell小室中,放入细胞培养箱内孵育4h。4h后吸出小室内未凝固液体,将小室悬挂入24孔板内待用。胰酶消化细胞,不含血清的培养基终止消化并吹打成细胞悬液,计数调整细胞浓度至约2.5×105/ml,每小室内加入细胞悬液180μl,并加入MLT浓度为0 mmol/L、1mmol/L、5 mmol/L、10 mmol/L的不含血清培养基20μl,小室外加含10%FBS的培养基500μl,每浓度设6个小室。放入细胞培养箱内培养24h。24h后取出小室,棉签擦去基底膜上层细胞,PBS洗涤2次,4%多聚甲醛固定30min,苏木素染色,自来水冲洗。400倍显微镜随意选取16个视野计数,以对照组细胞平均数记为1,各实验组取相对数标准化计算。
1.2.4 RT-PCR法检测MLT对细胞中NF-κBp65mRNA表达的影响将肺腺癌A549细胞悬液按3×104/孔接种入24孔板中,每浓度设6孔,置入细胞培养箱内培养。24h后吸去培养液,换加含10%FBS的培养基,并加入含不同浓度MLT的培养基,使其终浓度分别为0mmol/L、0.1 mmol/ L、0.5 mmol/L、1.0 mmol/L,继续培养24h。用Trizol试剂盒提取总RNA。根据NF-κBp65基因序列设计引物序列,上游引物为5'-CCACTTACGGATTCTGGTGG-3',下游为5'-CTCAAACGCTGGTGTTAGGC-3',长度426bp;β-actin内参基因上游引物为5'-GGAGATTACTGCCCTGGCTCCTA-3',下游引物为5'-GACTCATCGTACTCCTGCTTGCTG-3',长度496bp(引物由上海生工合成)。PCR反应条件:94℃预变性5min,变性94℃30s,退火58℃30s,延伸72℃30s,重复30个循环;扩增β-actin基因:94℃预变性5min,变性94℃30s,退火58℃30s,延伸72℃30s,重复30个循环。PCR产物在1.5%琼脂糖凝胶电泳,电泳结束后凝胶成像分析系统分析,以对照组平均值记为1,各实验组取相对数标准化计算。
1.3 统计学分析采用SPSS 18.0软件进行统计学分析,所有数据用(¯x±s)表示,对主要数据进行正态性检验,多组间比较采用SNK-q检验,P<0.05认为差异有统计学意义。
2 结果
2.1 划痕实验结果按照公式算得细胞迁移距离,经标准化,0 mmol/L、0.1mmol/L、0.5 mmol/L、1.0 mmol/L各组迁移距离为1、0.790±0.148、0.582 ±0.119、0.327±0.062。经检验,各浓度加药干预组与对照组相比较有统计学意义(P<0.05),0.5 mmol/L组与0.1mmol/L组相比较无统计学意义(P>0.05),1mmol/L组与其他各组相比均有统计学意义(P<0.05)。结果提示褪黑素能抑制A549细胞的迁移能力,且作用呈一定剂量依赖性。
2.2Transwell侵袭小室测定实验结果各组小室基底膜下层细胞染色后显微镜下观察计数,各浓度分别为1、0.856±0.081、0.476±0.064、0.301± 0.069。经统计学检验,0.1 mmol/L组与对照组比较无统计学意义(P>0.05),0.5 mmol/L组、1.0 mmol/L组与对照组及比较有统计学意义(P<0. 05),组间比较显示1.0mmol/L与0.1mmol/L组比较有统计学意义(P<0.05),1.0mmol/L与0. 5mmol/L组比较无统计学意义(P>0.05)。结果提示,MLT能够抑制肺腺癌A549细胞的侵袭能力,并且表现出一定的剂量依赖性。
2.3 RT-PCR结果RT-PCR结果显示,随着MLT浓度的增高,细胞NF-κBp65 mRNA逐渐下降,经统计学检验,各组之间均有统计学意义。结果显示MLT呈剂量依赖性的抑制NF-κBp65基因的转录。见图1。
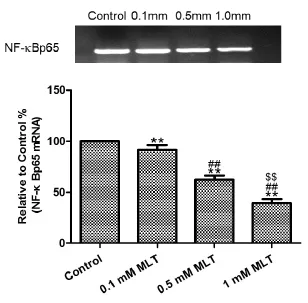
图1 MLT对A549细胞作用后NF-κBp65的Rt-PCR检测
3 讨论
姜鹏[7]等人实验证实了高浓度的MLT对肺腺癌A549细胞增殖有显著的抑制作用,实验结果显示0.1~1.0 mmol/L的MLT作用24h对A549细胞的增殖无明显影响,故本实验选择0.1~1.0mmol/L之间的浓度作为实验条件,以避免细胞增殖受明显抑制对实验结果产生影响。
通过严格的实验我们发现MLT能够抑制肿瘤的迁移和侵袭能力,并且呈一定的剂量依赖性,提示MLT可能有抑制肿瘤转移的作用,可用于肿瘤转移的预防。
NF-κB是一种细胞中普遍存在的核转录因子,非活化时以p50/p65异二聚体形式在胞浆中存在[8],并与特异性的调节蛋白IκB-α结合,在IκB激酶(IKK)作用下p50/p65异二聚体可与IκB-α分离,并转位进入细胞核与特定启动子结合,诱导靶基因mRNA的合成[9~11],参与炎症、细胞增殖及凋亡多种生理病理反应[12]。多项研究表明,多数肿瘤细胞内NF-κB呈非正常活化状态[13],参与肿瘤的浸润和转移等过程。有研究证实,NF-κB异常活化时通过调节内皮白细胞黏附分子、血管细胞粘附分子、金属蛋白酶等的表达[14,15],参与浸润及转移过程。p65亚基是NF-κB的主要活性亚基[16],活化后发生核移位与目的DNA结合后调节下游基因的表达[17]。通过检测发现MLT能够下调NF-κBp65mRNA量,这说明MLT对NF-κBp65基因的转录活性有明显的抑制作用。本实验结果提示MLT能通过抑制NF-κBp65基因的转录来抑制A549细胞的迁移和侵袭能力,但MLT如何抑制NF-κBp65基因的转录还有待进一步实验解释。
[1]Pandi-Perumal SR,Srinivasan V,Maestroni GJM,et al. Melatonin:nature's most versatile biological signal?[J]. FEBS J,2006,273(13):2813
[2]Hunt AE,Al-Ghoul WM,Gillette MU,et al.Activation of MT2 melatonin receptors in rat supra chiasmatic nucleus phase advances the circadian clock[J].Am J Physiol Cell Physiol,2001,280(1):C110
[3]Mediavilla MD,Cos S,Sanchez-Barcelo EJ.Melatonin increases p53 and p21WAF1 expression in MCF-7 human breast cancer cells in vitro[J].Life Sci,1999,65(4):415
[4]García-Navarro A,González-Puga C,Escames G,et al. Cellular mechanisms involved in the melatonin inhibition of HT-29 human colon cancer cell proliferation in culture[J].J Pineal Res,2007,43(2):195
[5]Rato AG,Pedrero JG,Martinez M,et al.Melatonin blocks the activation of estrogen receptor for DNA binding[J]. FASEB J,1999,13(8):857
[6]Giuseppina Messina,Paolo Lissoni,Paolo Marchiori,et al. Enhancement of the efficacy of cancer chemotherapy by the pineal hormone melatonin and its relation with the psychospiritual status of cancer patients[J].J Res Med Sci,2010,15(4):225
[7]姜鹏,杨侠,杨波,等.褪黑素对肺腺癌A549细胞增殖及核转录因子κBp65核移位的影响[J].现代生物医学进展,2012,12(13):2457
[8]Hayden MS,Ghosh S.Signaling to NF-κB[J].Genes Dev,2004,18(18):2195
[9]Devin A,Cook A,Lin Y,et al.The distinct roles of TRAF2 and RIP in IKK activation by TNF-R1:TRAF2 recruits IKK to TNF-R1 while RIP mediates IKK activation[J]. Immunity,2000,12(4):419
[10]Yang J,Lin Y,Guo Z,et al.The essential role of MEKK3 in TNF-induced NF-κB activation[J].Nat Immunol,2001,2(7):620
[11]Chen ZJ.Ubiquitin signalling in the NF-κB pathway[J]. Nat Cell Biol,2005,7(8):758
[12]Aggarwal BB.Nuclear factor-κB:the enemy within[J]. Cancer Cell,2004,6(3):203
[13]Sarkar FH,Li Y.NF-κB:a potential target for cancer chemoprevention and therapy[J].Front Biosci,2008,13: 2950
[14]Yang J,Mani SA,Donaher JL,et al.Twist,a master regulator of morphogenesis,plays an essential role in tumor metastasis[J].Cell,2004,117(7):927
[15]Huber MA,Beug H,Wirth T.Epithelial-mesenchymal transition:NF-κB takes center stage[J].Cell Cycle,2004,3(12):1477
[16]Li T,Hu J,He GH,et al.Up-regulation of NDRG2 through nuclear factor-kappa B is required for Leydig cell apoptosis in both human and murine infertile testes[J]. Biochim Biophysica Acta,2012,1822(2):301
[17]Donato AJ,Black AD,Jablonski KL,et al.Aging is associated with greater nuclear NF-Κb,reduced IκBα,and increased exression of proinflammatory cytokines in vascular endothelial cells of healthy humans[J].Aging Cell,2008,7(6):805
The Effect and Mechanism of Melatonin on Human Lung Adenocarcinoma A549 Cells
PAN Hai-yuan,YAN Xing,JIANG Peng
(Department of Respirations NO.82 Hospital of PLA,Huaian Jiangsu 223001,China)
ObjectiveTo investigate the effect and mechanism of melatonin(MLT)on the migration and invasion of cultured human lung adenocarcinoma A549 cell.MethodsHuman lung adenocarcinoma A549 cells were treated by different concentration of melatonin(0,0.1,0.1,1.0 mmol/L)for 24,48 or 72 h.The migration changes were tested by the scratch test.The effect of MLT on the invasive ability of A549 cells were measured by transwell invasion.RT-PCR was used to detect the effects of MLT on NF-κBp65 mRNA expression.ResultsMelatonin can inhibit the migration and invasion of human lung adenocarcinoma A549 cell accompanying with reducing the amount of NF-κBp65mRNA cells.ConclusionMelatonin can dose-dependently inhibit the migration and invasion of human lung adenocarcinoma A549 cell.Inhibition of NF-κBp65 mRNA gene transcription is one of the possible role of the path.
Melatonin;Lung adenocarcinoma;Nuclear factor κB;Migration;Invasion
R734.2
A
2095-4646(2015)01-0009-04
2014-10-15)
淮安市科技支撑项目(HAS2012020)
**通讯作者,E-mail:bigbird01@163.com
