细胞因子诱导杀伤细胞联合多西他赛、卡铂治疗晚期卵巢癌的疗效及安全性
2015-05-23高翔刘永军李晓丹于华
高翔,刘永军,李晓丹,于华
(邯郸市第一医院,河北邯郸056002)
晚期卵巢癌患者机体耐受性差,化疗往往损害机体免疫功能,降低患者的生活质量,缩短生存期。因此,化疗结束后如何提高机体的免疫功能显得尤为重要。目前,细胞因子诱导杀伤细胞(CIK)能够对多种肿瘤产生强大的抗肿瘤效应,对提高机体免疫力、抑制肿瘤细胞增殖有重要作用,被认为是新一代肿瘤过继免疫治疗的首选方案[1,2]。近年来,我们采用多西他赛、卡铂化疗结束后输注CIK治疗晚期卵巢癌取得良好疗效。现报告如下。
1 资料与方法
1.1 临床资料 选取我院2008年1月~2012年1月收治的晚期卵巢癌患者91例,均经组织病理学检查或腹水检测找到癌细胞证实为晚期卵巢上皮癌。患者均为初次治疗,治疗前心电图、血常规、肝肾功检测均无异常,无化疗禁忌证;体能状况评分0~2级,预计生存时间≥6个月。采用随机数字表法将患者分为两组。治疗组46例,年龄(62.3±2.6)岁,其中浆液性腺癌14例、黏液性腺癌19例、未分化癌13例,合并腹水31例;对照组45例,年龄(61.7±3.2)岁,其中浆液性腺癌20例、黏液性腺癌17例、未分化癌8例,合并腹水33例。两组临床资料比较差异无统计学意义。
1.2 方法
1.2.1 治疗方法 治疗组给予TC方案化疗联合CIK治疗,对照组给予TC方案化疗。TC方案:多西他赛75 mg/m2静滴,d1,卡铂300 mg/m2给予腹腔灌注,有腹水者灌注前将腹水抽取干净,无腹水者直接灌注。将卡铂溶入1 000 mL生理盐水中加温后,经导管注入腹腔,每隔30 min变换1次体位,使药物在腹腔内均匀分布。化疗期间定期查血常规及肝肾功能。两组均给予4~6个周期化疗。CIK培养及回输:化疗前取外周血50 mL,肝素钠抗凝,采用Ficoll密度梯度离心法获得单个核细胞,用 RPMI1640培养基调整细胞密度,加入IFN-γ,培养24 h后加入CD3单抗和IL-2,每2~3 d换液1次,培养6 d后获得CIK。取少量CIK用流式细胞仪进行免疫检测,当细胞数≥50%细胞≥30%,且CIK培养基中细菌、真菌及内毒素检测均为阴性时,将CIK用生理盐水洗涤3次,加入含1%人血白蛋白的生理盐水中于4~6个周期化疗结束后回输到患者体内,1次/d,连输5 d。
1.2.2 检测方法 治疗前2 d及治疗结束后2周用流式细胞仪检测两组NK细胞和T细胞亚群(
1.2.3 疗效判断标准 近期疗效:根据影像学检查结果按实体瘤疗效评价标准,完全缓解(CR):全部病灶消失,维持4周以上;部分缓解(PR):病灶缩小至少30%,维持4周以上;稳定(SD):介于PR和PD之间;进展(PD):病灶增加超过20%或出现新病灶。客观有效(RR)=CR+PR。参考Karnofsky(KPS)评分[3]变化评价患者的生存质量,以治疗后KPS增加≥10分为生存质量改善,变化<10分为生存质量稳定,减少≥10分为生存质量降低。生存期:从治疗开始至死亡或末次随诊时间。不良反应评价:按照WHO抗癌药物急性与亚急性不良反应的表现及分度标准,分为0~Ⅳ度。
1.2.4 统计学方法 采用SPSS13.0统计软件,计数资料采用率和构成比表示,差异比较采用χ2检验;计量资料以±s表示,采用配对t检验。应用 Kaplan-Meier法计算总生存率。P≤0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较 治疗结束2个月后评价,治疗组CR 22例,PR 18例,SD 4例,PD 2例,CR率为47.8%,RR率为87.0%;对照组CR 19例,PR 16例,SD 5例,PD 5例,CR率为 42.2%,RR率为77.8%,两组比较无统计学差异(P>0.05)。
2.2 两组免疫功能比较 治疗组治疗结束后T细胞亚群中的 CD+3、CD+4、CD+16CD+56、CD+4/CD+8均不同程度地升高,治疗前后比较有统计学差异(P均<0.05);对照组治疗前后无统计学差异(P均>0.05)。见表1。
表1 两组治疗前后免疫功能的变化(±s)
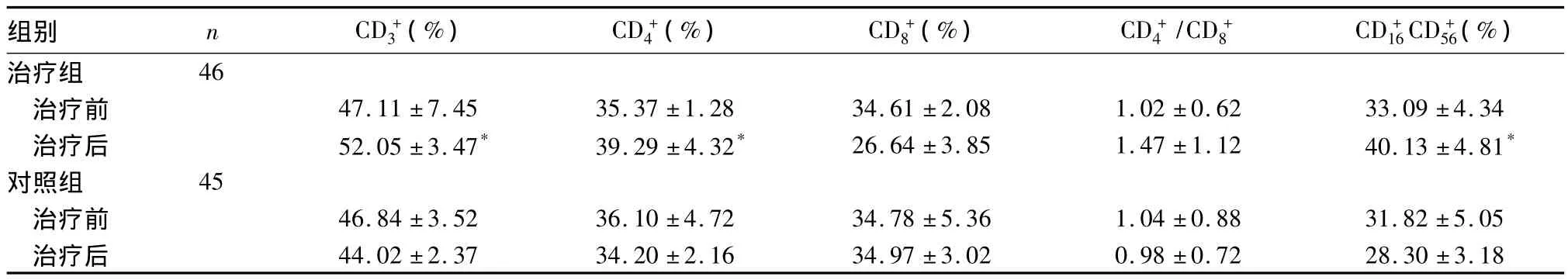
表1 两组治疗前后免疫功能的变化(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,*P<0.05。
组别 n CD+3(%) CD+4(%) CD+8(%) CD+4/CD+8 CD+16CD+56(%)46治疗前 47.11±7.45 35.37±1.28 34.61±2.08 1.02±0.62 33.09±4.34治疗后 52.05±3.47* 39.29±4.32* 26.64±3.85 1.47±1.12 40.13±4.81*对照组 45治疗前 46.84±3.52 36.10±4.72 34.78±5.36 1.04±0.88 31.82±5.05治疗后 44.02±2.37 34.20±2.16 34.97±3.02 0.98±0.72治疗组28.30±3.18
2.3 两组生存质量改善情况比较 治疗结束后1个月,治疗组生存质量改善35例,稳定9例,降低2例,改善率为76.1%;对照组改善20例,稳定17例,降低8例,改善率为44.4%。两组生存质量改善率比较有统计学差异(P<0.01)。
2.4 两组生存率比较 至2014年1月30日,治疗组失访3例,对照组失访4例,随访率为92.3%(84/91)。治疗组与对照组的1年生存率分别为81.4%(35/43)和61.0%(25/41),两组比较有统计学差异(P<0.05);2年生存率分别为62.8%(27/43)和41.5%(17/41),两组比较有统计学差异(P<0.05)。
2.5 两组不良反应比较 两组不良反应主要表现为骨髓抑制(白细胞下降、血小板下降和贫血),胃肠道反应(恶心、呕吐及腹痛),多为Ⅰ~Ⅱ级,经对症治疗后均好转,未出现治疗相关性死亡。治疗组白细胞下降发生率为80.4%(37/46),贫血发生率为69.6%(32/46),恶心、呕吐发生率为87.8%(40/46),腹痛发生率为54.3%(25/46);对照组白细胞下降发生率为 86.7%(39/45),贫血发生率为80.0%(36/45),恶心、呕吐发生率为91.1%(41/45),腹痛发生率为64.4%(29/45),两组比较均无统计学差异(P均>0.05)。
3 讨论
晚期卵巢癌的治疗主要为肿瘤细胞减灭术和以铂类药物为基础的化疗。20世纪90年代以来,紫杉醇联合卡铂成为晚期卵巢癌化疗的标准一线方案,但该方案的严重神经毒性限制了其应用。随着新药的研发,第二代紫杉烷类半合成抗肿瘤药物多西他赛逐步应用于临床[4]。李二虎[5]报道,多西他赛联合卡铂腹腔灌注治疗晚期卵巢癌的近期有效率为80.8%。逯华等[6]采用多西他赛联合卡铂治疗晚期复发性卵巢癌患者36例,有效率为80.55%。虽然一线化疗有效率可达80%左右,但仍有55% ~75%的患者在治疗后3年内复发,考虑其原因可能为化疗药物造成机体正常细胞的损伤,使患者的免疫系统功能受到抑制,从而潜伏的肿瘤细胞再次增殖所致[7]。因此如何在提高化疗效果的同时改善机体的免疫功能显得尤为重要。
恶性肿瘤患者通常存在免疫功能状态紊乱、低下,而免疫功能紊乱、低下往往预示患者预后不佳。机体的抗肿瘤免疫作用是依靠机体的免疫监视作用来完成的,其中细胞免疫起主要作用[8]。人体T细胞中CD+4、CD+8细胞是细胞免疫系统中两大基本组成部分,CD+4/CD+8正常值为1.5~2.0。肿瘤患者因机体免疫监视功能降低,常表现为CD+4细胞下降,CD+8细胞上升,CD+4/CD+8值减小,甚至倒置[9]。CD16和CD56是 NK 细胞的表面标志,其表达下降提示机体NK细胞作用受抑制,细胞免疫功能下降,不能发挥有效杀伤肿瘤细胞的作用。CIK细胞是将人体外周血单个核细胞在体外加用多种细胞因子共同培养增殖后获得的一群异质细胞,是目前自体免疫细胞治疗的主要类型之一[10]。
CIK具有T淋巴细胞强大的抗肿瘤活性和NK细胞非主要组织相容性复合体限制性杀瘤活性,体内外增殖能力强,杀瘤谱更广[11]。体内回输CIK可以在不损伤机体免疫系统结构和功能的前提下,直接杀伤肿瘤细胞,并可调节和增强机体的免疫功能。张辉等[12]研究发现,CIK能将卵巢癌耐药细胞的细胞周期阻滞于S或G2/M期,并诱导其凋亡,降低耐药基因的表达,提高耐药细胞的免疫原性,同时能分泌 IL-2、TNF-γ、INF-γ、粒细胞—巨噬细胞集落刺激因子等具有抗肿瘤活性的细胞因子,发挥抗肿瘤作用。夏俊贤等[13]研究发现,晚期卵巢癌患者输注CIK后,机体的免疫功能明显改善。本研究中治疗组应用CIK后机体的CD+4/CD+8及CD+16CD+56均显著升高,说明机体的免疫功能明显改善,与文献报道相符。但目前CIK在晚期卵巢癌患者的远期生存方面有何影响却鲜有报道。本研究对CIK治疗的晚期卵巢癌患者长达2年多的随访,发现CIK联合化疗相对于单纯化疗而言能显著提高晚期卵巢癌患者的1年和2年生存率。但CIK对其他肿瘤的效果如何,我们将继续进行研究。
[1]Au-Yeung G,Webb PM,Defazio A,et al.Impact of obesity on chemotherapy dosing for women with advanced stage serous ovarian cancer in the Australian Ovarian Cancer Study(AOCS)[J].Gynecol Oncol,2014,133(1):16-22.
[2]Shi SB,Tang XY,Tian J,et al.Efficacy of erlotinib plus dendritic cells and cytokine-induced killer cells in maintenance therapy of advanced non-small cell lung cancer[J].J Immunother,2014,37(4):250-255.
[3]谭诗生,李杭,罗健,等.欧洲癌症研究与治疗组织研制的生活质量核心调查问卷第3版中文版:生活质量调查问卷测评[J].中国临床康复,2006,10(4):23-27.
[4]Lindemann K,Christensen RD,Vergote I,et al.First-line treatment of advanced ovarian cancer with paclitaxel/carboplatin with or without epirubicin(TEC versus TC)--a gynecologic cancer intergroup study of the NSGO,EORTC GCG and NCIC CTG[J].Ann Oncol,2012,23(10):2613-2619.
[5]李二虎.多西他赛与卡铂不同给药途径对晚期卵巢癌疗效与不良反应[J].药物与临床,2013,22(2):99-100.
[6]逯华,陈日新.多西他赛联合卡铂治疗晚期复发性卵巢癌36例的疗效观察[J].广西医学,2008,30(7):1059-1060.
[7]Dogan NU,Schneider A,Chiantera V,et al.Tertiary cytoreduction in the setting of recurrent ovarian cancer(Review)[J].Oncol Lett,2013,6(3):642-647.
[8]吕俊杰.CIK治疗恶性肿瘤的基础与临床研究[J].实用肿瘤学杂志,2012,26(4):373-376.
[9]Chen J,Huang X,Huang G,et al.Preconditioning chemotherapy with Cisplatin enhances the antitumor activity of cytokine-induced killer cells in a murine melanoma model[J].Cancer Biother Radiopharm,2012,27(3):210-220.
[10]Lin G,Wang J,Lao X,et al.Interleukin-6 inhibits regulatory T cells and improves the proliferation and cytotoxic activity of cytokine-induced killer cells[J].J Immunother,2012,35(4):337-343.
[11]Yang Y,Yang B,Cai LL,et al.Clinical study of autologous cytokine induced killer cells combined with chemotherapy for elderly patients with acute myeloid leukemia[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2014,22(1):58-63.
[12]张辉,赵群,左连富,等.细胞因子诱导的杀伤细胞对卵巢癌耐药细胞SKOV3/CDDP的作用机制[J].细胞与分子免疫学杂志,2007,23(12):1167-1171.
[13]夏俊贤,朱美琴,陈敬华,等.晚期卵巢癌CIK治疗后外周血T淋巴细胞亚群和NK细胞的变化及其临床意义[J].广东医学,2013,34(9):1383-1385.
