亚铁离子对甲磺酸高速镀锡溶液电化学行为及其镀层的影响
2015-05-22王志登王洺浩王熙禹黎德育李宁
王志登,王洺浩,王熙禹,黎德育,李宁*
(哈尔滨工业大学化工学院,黑龙江 哈尔滨 150001)
近年来,镀锡板产业在国内发展势头迅猛。据不完全统计,我国镀锡板年产量超过700 万t,是世界镀锡板生产大国。当前国内镀锡生产线新旧交替,弗洛斯坦工艺为主的酚磺酸(PSA)体系占总产量的45%左右,卤素和氟硼酸体系也有应用,但数量较少。自梅山钢厂2009 年引入甲磺酸(MSA)高速镀锡体系以来,绿色环保型的MSA 体系发展迅猛,近几年新投入的生产线几乎都采用该体系。MSA 镀液可以在低锡离子浓度条件下,允许大电流和宽温度区间工作,极大提高了生产效率,降低了生产成本,单条生产线年产能在40 万t 以上,是PSA体系的2 倍。
简单盐电镀中,Sn2+交换电流密度大( j0= 8 × 10-2A/cm2),沉积过电位小(2 ~ 3 mV)[1],该电化学特性决定酸性镀锡需要加入添加剂来抑制锡支晶的生成[2-3]。文献报道了聚乙二醇[4]、Triton X-100[5]等非离子表面活性剂[6]可作为阴极抑制剂;对苯二酚、羟基酚磺酸类、α-萘酚磺酸[7]等作为抗氧剂,可防止Sn2+氧化水解等。此外,MSA体系中几种添加剂的协同作用也有报道[5,8]。虽然MSA 酸锡体系的研究取得较大成果,但在高速镀锡产线的应用时间较短,一些工程实际问题亟待解决,如添加剂、助熔剂的选择,高速电镀产线与MSA 体系的进一步优化,镀液中杂质的影响机理及对策等。镀锡基板一般是厚度为0.12 ~ 0.25 mm 的一次或二次冷轧钢板,经碱洗和酸洗工艺进入电解槽,因带钢高速走动,表面会带出一定量铁离子进入镀液;另一方面,钢板表面的氧化物被甲磺酸溶解,进一步提高了镀液中Fe2+的含量。本文就Fe2+这一镀液中必然产生的杂质,研究其对甲磺酸高速镀锡溶液电化学行为及镀层质量的影响。该工作有利于提高研究人员对MSA 酸锡体系的认识,对实际生产有重要意义。
1 实验
镀液组成为:15 g/L Sn2+[以Sn(CH3SO3)2形式加入],50 mL/L MSA(质量分数70%,购于BASF),添加剂1.0 g/L EPE-4600(商品名Pluronic 9400)、0.5 g/L 对苯二酚以及10 mL/L H2SO4(质量分数98%)。采用三电极系统研究镀液的电化学性能:工作电极为美国PINE 公司生产的CPR 旋转圆盘电极(RDE),铂盘电极面积为0.163 9 cm2,每次测试前都先后用3.75 μm 和1.87 μm 的氧化铝抛光至晶面光亮,再用去离子水超声清洗2 min;参比电极为Hg·Hg2SO4|饱和K2SO4溶液(SMSE),文中电位均相对于SMSE;对电极为1 cm2的铂片。速率控制器为Princeton 公司生产的Model 636 RRDE,电化学工作站为辰华CHI760D。
赫尔槽试验用直流电源为金顺怡STP10A/12V.S,4 mm 厚纯锡板为阳极,0.18 mm 厚低碳钢板为阴极;槽容积为267 mL,温度为26 °C,电流为2 A,静置电镀3 min。采用SK2700 电子显微镜观察赫尔槽试片表面形貌。
采用Oxford CMI900 金属镀层厚度检测仪测定镀层厚度,日本电子公司JSM-6500 扫描电子显微镜(SEM)观察镀层微观形貌,能谱仪(EDS)元素分析加速电压为10 kV。镀层元素分析采用日本精工XRF SEA-1000A,测试面积为20 μm × 20 μm。
2 结果与讨论
2.1 Fe2+在甲磺酸及甲磺酸镀锡液中的电化学行为
图1a 是Fe2+在甲磺酸中的循环伏安(CV)曲线,在0 V 左右有一对Fe2+和Fe3+单电子氧化还原峰,峰电位差约为130 mV。加入添加剂EPE-4600 后,铁离子的氧化与还原峰电流降低,说明镀锡添加剂EPE-4600 抑制了铁离子的氧化还原反应。电位负扫至-0.75 V 时,析氢电流出现差异,说明添加剂EPE-4600 与铁离子共存时,对氢的析出仍有一定抑制作用。此外,在整个电化学反应窗口(-1.2 ~ 1.0 V)中,未有Fe2+↔ Fe0的反应特征峰,初步认为电极表面未有铁的沉积。
依据Fe2+(10 g/L)在甲磺酸溶液中不同扫速(v)时的CV 曲线,得知氧化峰电流与v0.5和v-0.5都呈线性关系,拟合jp与v0.5的数据如图1b 所示,得线性方程拟合系数等于0.995 03。根据Randles-Sevcik 方程[9]:jp= 2.69 × 105z1.5D0.5v0.5C (其中jp为峰电流密度,z 为得失电子数,D 为扩散系数,v 为扫速,C 为Sn2+浓度),计算得到该浓度下Fe2+的扩散系数为6.9 × 10-6cm2/s,与文献[10]报道的Sn2+在甲磺酸中的扩散系数(6.5 × 10-6cm2/s)相近。计算了Fe2+质量浓度在0 ~ 20 g/L 时,镀液中Sn2+的扩散系数为3.80 ~ 5.35 cm2/s,数值无规律。基于实验误差,认为该质量浓度范围内,Fe2+对Sn2+扩散系数无明显影响。此外,镀液中Fe2+的质量浓度大于20 g/L 时,峰电流密度jp与v0.5无线性关系,说明高浓度的Fe2+对Sn2+放电步骤的影响较大。
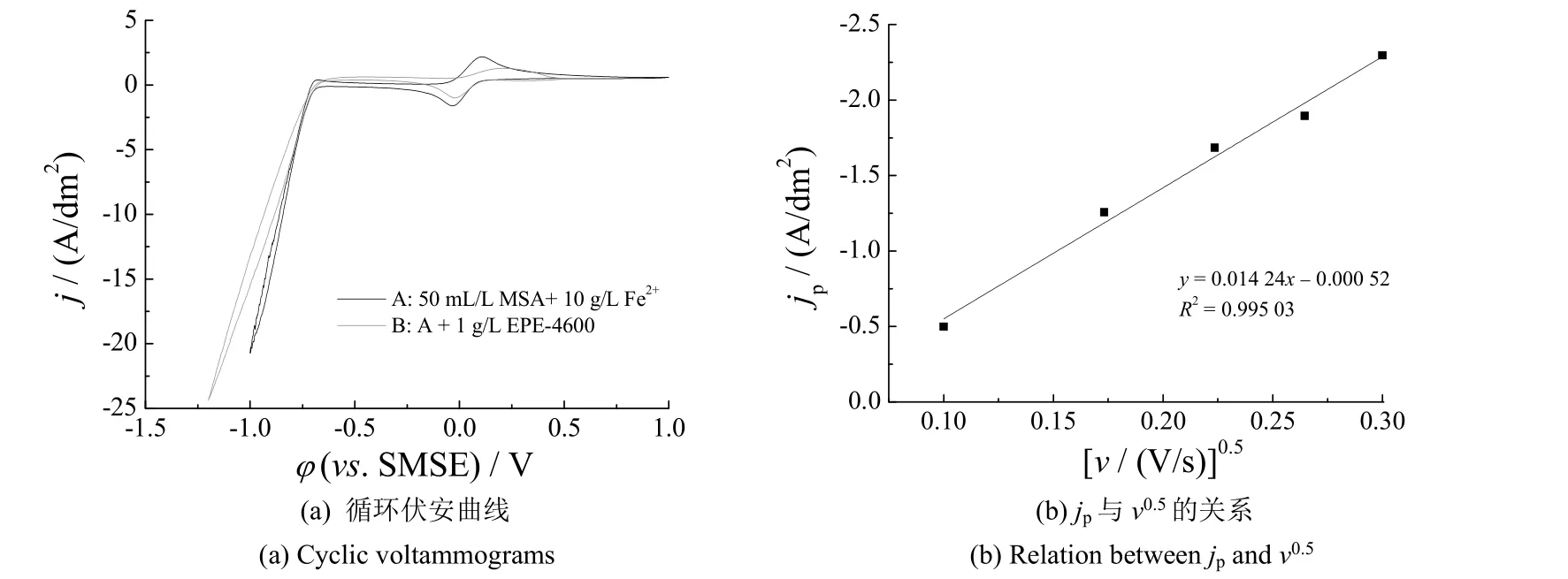
图1 Fe2+(10 g/L)在有无EPE-4600 的50 mL/L 甲磺酸中的循环伏安特性(扫速50 mV/s)Figure 1 Cyclic voltammogram of Fe2+ (10 g/L) in 50 mL/L MSA electrolyte with and without EPE-4600 (scan rate 50 mV/s)
图2 研究了Fe2+在甲磺酸镀液中的循环伏安特性。由图2 可知,甲磺酸镀液的阴极过程中出现2 个还原峰(即窄峰Peak 1 和宽峰Peak 2)和一个氧化峰Peak 3。分析镀液物种组分,Peak 1 和Peak 2 是Sn2+放电反应,Peak 3是沉积锡层的溶解峰,该峰面积大小与阴极电流效率相关。Fe2+引入镀液后,峰特征无明显变化,说明Fe2+的掺入对Sn2+放电影响较小;析氢电流增加说明Fe2+对H+放电有促进作用。当Fe2+为5 ~ 15 g/L 时,0 ~ -2.1 V 电位窗口中未出现Fe2+的氧化还原峰,但Fe2+降低了Peak 2 的峰电流。此外,Fe2+引入后,阳极溶出峰Peak 3 的面积缩小了约15%,说明Fe2+的存在降低了Sn2+的沉积效率,可能涉及的副反应有H+和Fe2+的还原。
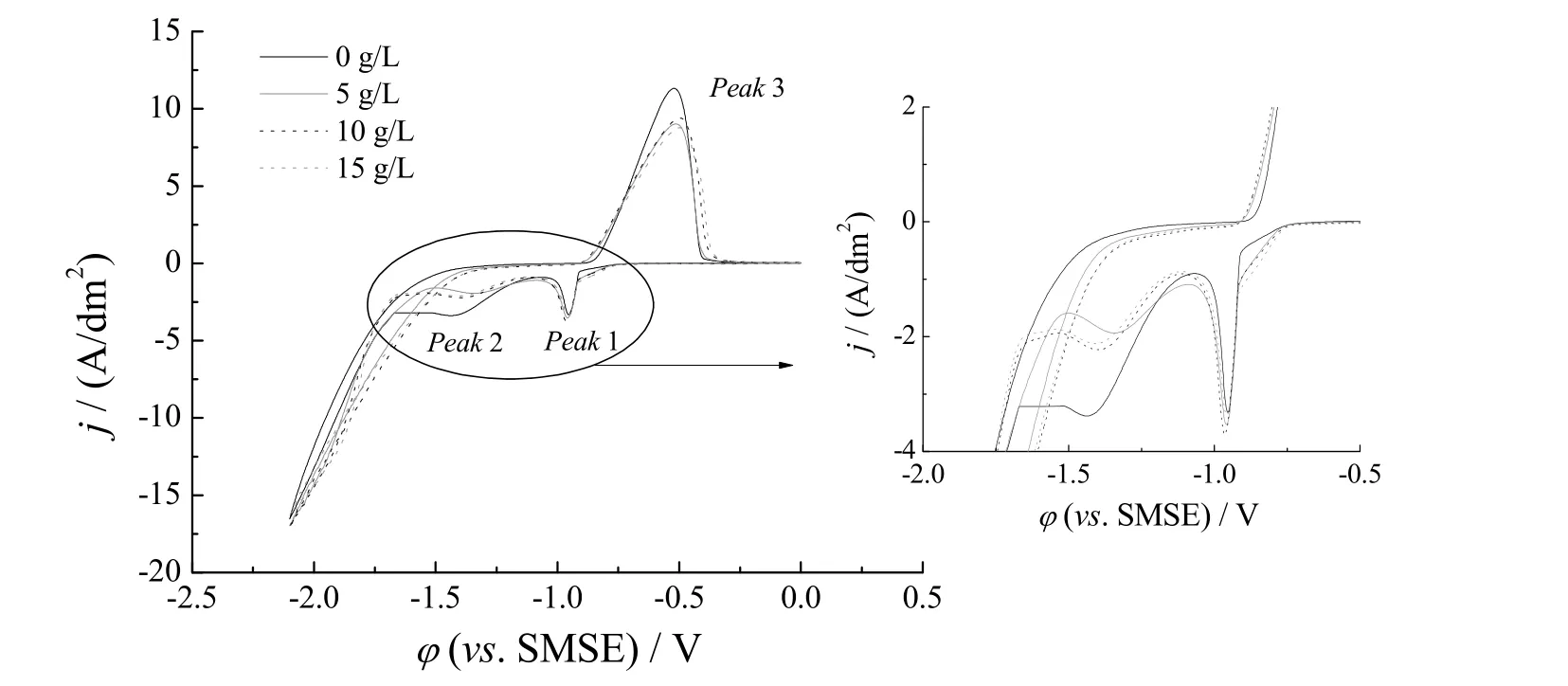
图2 Fe2+对甲磺酸镀锡液循环伏安性能的影响(扫速50 mV/s)Figure 2 Effect of Fe2+ on cyclic voltammetric performance of MSA tinning bath (scan rate 50 mV/s)
为了进一步明确Fe2+对镀液阴极过程的影响,首先研究了甲磺酸镀液中Peak 2 所代表的电极反应。在铂盘电极上,-1.0 V 电沉积锡50 s 制得锡盘电极(见图3),然后选择开路电位-0.86 V 作为起始扫描电位进行循环伏安扫描,结果如图4 所示。第一个循环发现还原峰只有一个即Peak c,电位的进一步负扫,出现析氢反应,电位回扫后出现锡的溶出峰,电位扫描至-0.12 V 时的电流可视为非法拉第电流,铂盘电极表面沉积的锡完全剥离,锡盘电极转为铂盘电极;第二个循环曲线的阴极部分出现了Peak a 和Peak b,其峰特征与图2 中Peak 1 和Peak 2一致,两个循环的锡溶出峰差异也证实Peak b 是Sn2+的电还原反应。据此认为镀液在铂电极上的两个还原峰,是Sn2+分别在Pt 和Sn 基底上的沉积还原峰。结合图2 和图4,认为Fe2+的掺入对Sn2+的阴极过程无明显影响,但Fe2+的存在促进了镀液的析氢。
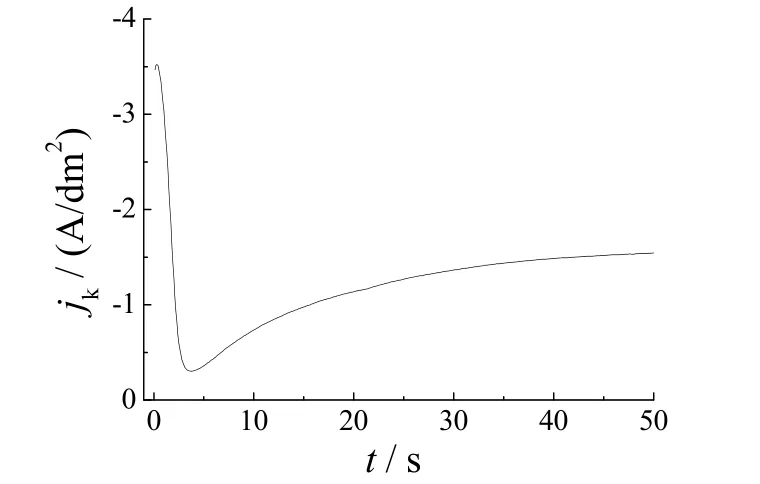
图3 铂盘电极上锡沉积的jk-t 曲线(-1.0 V,相对于SMSE)Figure 3 jk vs.t curve for electrodeposition of tin at Pt disk electrode (-1.0 V, vs.SMSE)
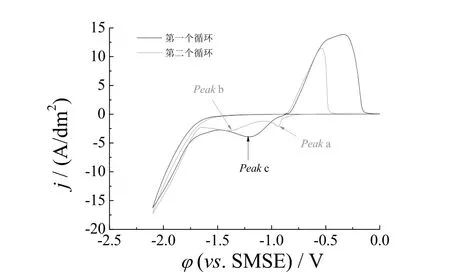
图4 镀锡铂盘电极在甲磺酸镀锡液中的循环伏安曲线(扫速50 mV/s)Figure 4 Cyclic voltammograms for tin-coated Pt disk electrode in MSA tinning bath (scan rate 50 mV/s)
Fe2+相对于Sn2+,需要较大的沉积过电位方能形成Fe 或者Sn-Fe 镀层。根据镀液循环伏安曲线判断,在Sn的沉积电位区间未发现明显的Fe2+还原电流。为进一步验证Fe2+是否会在H+和Sn2+放电过程中参与放电,形成共沉积镀层,从而影响电极界面阴极过程,选用黄铜基底分别在含15 g/L Fe2++ 0 g/L Sn2+和15 g/L Fe2++ 15 g/L Sn2+的镀液中,以1 A/dm2电镀10 min。电沉积过程中,试片表面有氢气产生。在添加剂等其他反应条件一致的情况下,对分别制得的2 个样品进行元素分析,结果均未检测出Fe 元素(见表1),说明基板表面未有Fe 或Sn-Fe合金电沉积层生成,排除了界面生成Fe 或Sn-Fe 层对阴极析氢促进反应的影响。
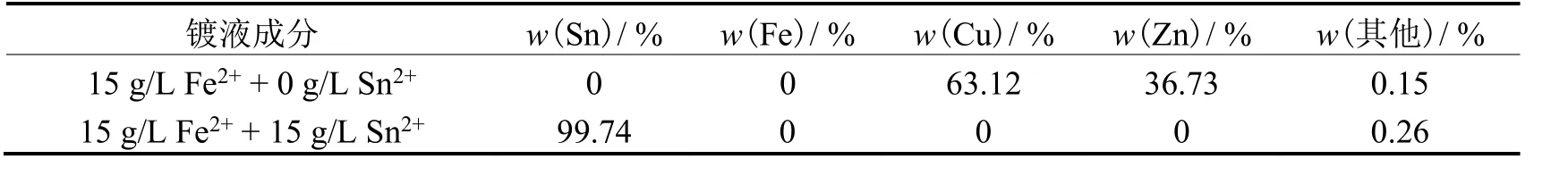
表1 在有无Sn2+(15 g/L)的15 g/L Fe2+溶液中所得镀层的XRF 元素分析结果Table 1 Results of elemental analysis on coatings obtained from 15 g/L Fe2+ solution with and without Sn2+ (15 g/L) by XRF
2.2 调制动力学条件下Fe2+对MSA 镀锡液电化学行为的影响
采用调制动力学方法进一步研究溶液传动情况下Fe2+对镀液阴极放电过程的影响。图5 是含不同浓度Fe2+的锡镀液在不同转速条件下的阴极极化曲线,结果发现:Fe2+为0 g/L 时,随着电极转速的提高,镀液析氢转折电位逐渐负移,Sn2+的还原电流逐渐增加,Sn2+的完全扩散控制区随转速增加而增大。Fe2+>10 g/L 时,Sn2+在RDE 上的极限电流值不符合Levich 方程(其中jd为极限电流密度,n 为得失电子数,F 为法拉第常数,D0为扩散系数,ω 为电极转速,υ 为动力学黏度,C 为Sn2+浓度),曲线没有极限电流平台特征,峰电流后电流随电位负扫呈线性增加,说明该Fe2+浓度条件下,H+放电反应提前,Sn2+传质扩散控制区消失。此外,Sn2+还原电流受Fe2+影响较小,但与转速直接相关:当转速为0 ~ 1 000 r/min 时,Sn2+还原电流迅速增加;转速在1 000 ~ 2 500 r/min 内时,曲线逐渐重合,表明电极表面的扩散层厚度快速减薄并达到稳定。

图5 不同调制动力学下Fe2+对MSA 镀锡液阴极极化曲线的影响(扫速50 mV/s)Figure 5 Effect of Fe2+ on cathodic polarization curve for MSA tinning bath under different hydrodynamic modulation conditions(scan rate 50 mV/s)
分析了同一传质环境中Fe2+浓度对镀液阴极放电过程的影响,分析了300、1 000 和1 500 r/min 转速条件下镀液的阴极极化曲线,见图6。在转速为300 r/min 的条件下,Fe2+为5 ~ 15 g/L 时的析氢电流整体较15 ~ 30 g/L时的析氢电流要大,对析氢反应促进作用较强,而整个Fe2+浓度范围内,Sn2+的还原峰以及Sn2+扩散控制区间无明显变化。当转速大于1 000 r/min,Fe2+质量浓度大于5 g/L 时,Sn2+电化学反应扩散控制拐点消失,H+和Sn2+的混合反应控制区变宽,低浓度Fe2+促进析氢作用明显。

图6 300、1 000 及1 500 r/min 转速下不同Fe2+浓度的锡镀液的阴极极化曲线(扫速50 mV/s)Figure 6 Cathodic polarization curves for MSA tinning bath containing different Fe2+ concentrations at a rotation rate of 300, 1 000, and 1 500 r/min, respectively (scan rate 50 mV/s)
2.3 Fe2+对MSA 镀锡液性能的影响
上述研究认为镀液中Fe2+降低了镀液阴极极化能力,提高了镀液析氢活性,实验通过赫尔槽试片研究Fe2+是否会影响到镀液的分散能力和电流效率。采用2 A 电流静态电镀3 min 制得赫尔槽试片。从试片外观(见图7)来看,Fe2+对镀液的工作电流区间无明显影响,高区电流密度大,镀层烧焦、发黑。
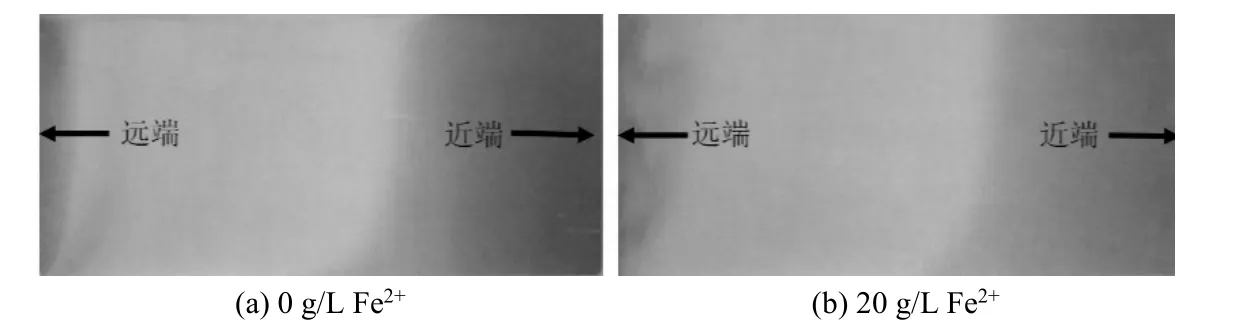
图7 含与不含Fe2+(20 g/L)的镀锡液中所得赫尔槽试片的外观(2 A, 3 min)Figure 7 Appearance of Hull cell test coupons obtained from tinning bath with and without 20 g/L Fe2+ at 2 A current for 3 min
图8 是赫尔槽试片镀层厚度的测定结果,发现不同浓度Fe2+条件下,试片远端到中端的镀层厚度逐渐增加,规律一致,说明Fe2+不影响镀液的分散能力,但随着Fe2+浓度提高,不同试片上相同位置的锡层厚度下降,进一步证实Fe2+的存在整体降低了镀液电流效率,然而不同Fe2+浓度对不同电流密度的电流效率影响又不尽相同。有文献报道[11],阴极电流效率的下降还与氧的还原有关。
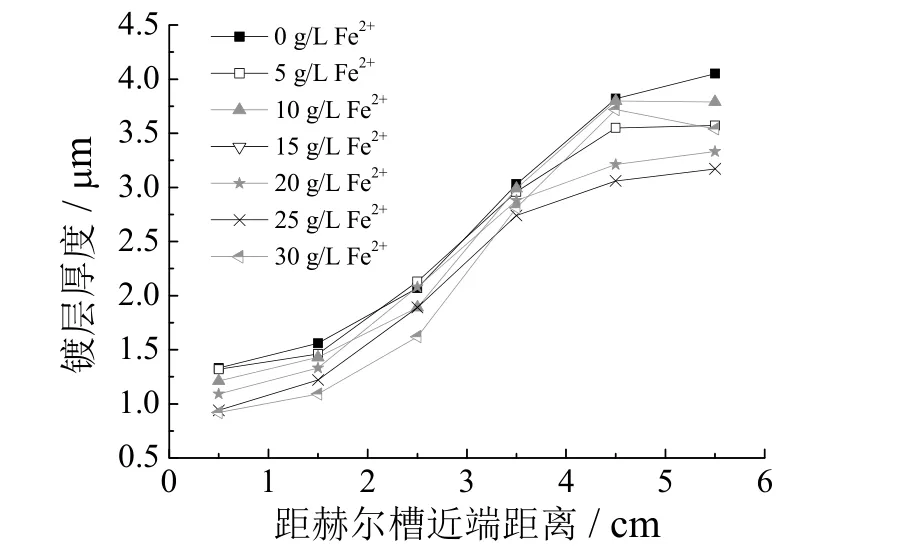
图8 Fe2+质量浓度对赫尔槽试片上镀层厚度的影响(2 A, 3 min)Figure 8 Effect of Fe2+ concentration on thickness of tin coating on Hull cell test coupon obtained at 2 A current for 3 min
2.4 Fe2+对锡镀层质量的影响
镀锡板产品镀锡量一般为1.1 ~ 5.6 g/m2,镀层厚度低于0.5 μm。然而上述研究表明,Fe2+会降低镀液电流效率,提高镀液析氢活性,这显然对锡镀层质量不利。
图9 是4 种Fe2+质量浓度下得到的1.1 g/m2的镀锡板高倍数码照片。当Fe2+质量浓度大于20 g/L 时,锡镀层色泽不再均匀细致,变得粗糙,同时伴有针孔。可见,随着Fe2+质量浓度的增加,镀层外观质量变差。

图9 Fe2+对镀锡量为1.1 g/m2 的镀锡板外观的影响Figure 9 Effect of Fe2+ on appearance of tinplate with 1.1 g/m2 tin
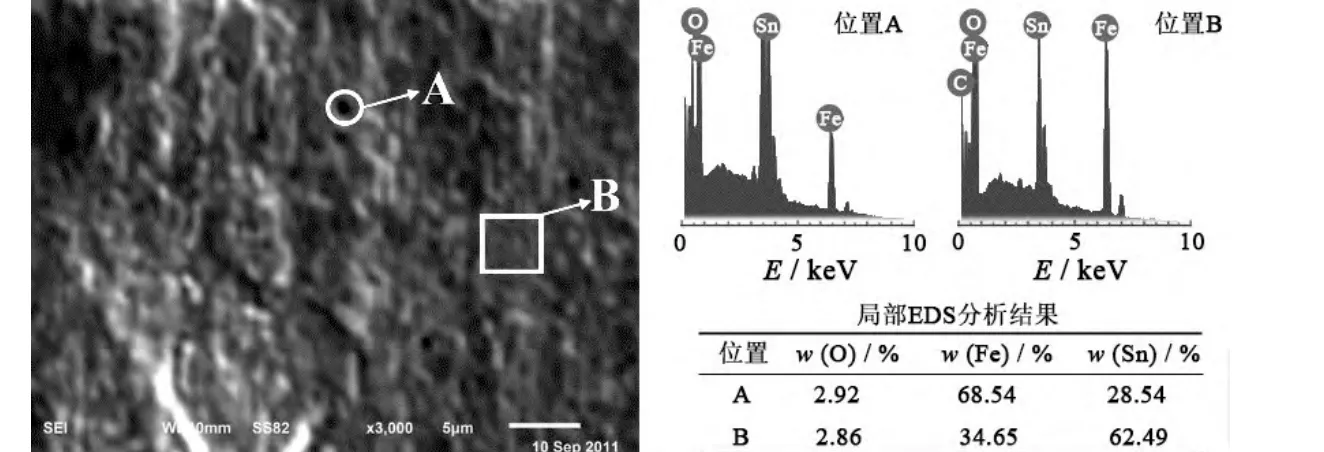
图10 镀锡量为1.1 g/m2 的镀锡板的扫描电镜照片及局部能谱分析Figure 10 SEM image of tinplate with 1.1 g/m2 tin and EDS analysis of local areas on it
针对图9c 的镀层,采用扫描电镜观察其微观形貌并分析了局部元素含量,见图10。SEM 观察发现图9c 镀层不均匀细致,同时表面含有针孔。通过能谱元素分析发现,孔洞区域Fe 质量分数为68.54%,而Sn 为28.54%;非孔区域,Fe、Sn 分别为34.65%和62.49%。由此认为孔处漏镀可能性较大。孔洞的形成机制可能为:Fe2+在析氢活性位点处吸附,阴极微区pH 上升,镀液中Fe2+形成胶团进一步粘附在活性位点上,阻止了Sn2+放电沉积,而随着初始锡层的覆盖,孔洞填覆的难度进一步增加。孔洞的形成降低了镀锡板性能,容易形成点蚀,同时因镀层较薄,软熔工艺中锡的合金化过程也很难填平孔洞,导致镀锡板耐蚀性下降。非孔处检出的铁可解释为能谱采用加速电压10 kV,其穿透厚度远大于150 nm 厚的1.1 g/m2锡镀层,采集到了基板铁的元素信息。
3 结论
(1) Fe2+主要对MSA 镀液阴极放电过程有影响,提高了镀液析氢活性,降低了镀液电流效率;此外,Fe2+在H+和Sn2+放电过程中不参与放电。
(2) 转速 >1 000 r/min 条件下,Fe2+质量浓度 >5 g/L 时,Sn2+电化学反应扩散控制拐点消失,H+和Sn2+的混合反应控制区变宽,析氢电位随转速提高而正移;Sn2+放电电流受Fe2+的影响较小,与镀液强制对流直接相关。
(3) Fe2+质量浓度 >15 g/L 时,1.1 g/m2锡量镀锡板,镀层表面粗糙,结晶不细致,Fe2+的存在使镀层孔洞明显增加,镀锡板性能下降。
[1] 方景礼.电镀配合物──理论与应用[M].北京: 化学工业出版, 2007: 515-518.
[2] WALSH F C, PONCE DE LEÓN C.Versatile electrochemical coatings and surface layers from aqueous methanesulfonic acid [J].Surface and Coatings Technology, 2014, 259 (Part C): 676-697.
[3] LOW C T J, WALSH F C.Normal and anomalous electrodeposition of tin-copper alloys from methanesulphonic acid bath containing perfluorinated cationic surfactant [J].Transactions of the Institute of Metal Finishing, 2008, 86 (6): 315-325.
[4] FUKUDA M, IMAYOSHI K, MATSUMOTO Y.Effect of adsorption of polyoxyethylene laurylether on electrodeposition of Pb-free Sn alloys [J].Surface and Coatings Technology, 2003, 169/170: 128-131.
[5] BARRY F J, CUNNANE V J.Synergistic effects of organic additives on the discharge, nucleation and growth mechanisms of tin at polycrystalline copper electrodes [J].Journal of Electroanalytical Chemistry, 2002, 537 (1): 151-163.
[6] LOW C T J, WALSH F C.Electrodeposition of tin, copper and tin-copper alloys from a methanesulfonic acid electrolyte containing a perfluorinated cationic surfactant [J].Surface and Coatings Technology, 2008, 202 (8): 1339-1349.
[7] LEE J Y, KIM J W, CHANG B Y, et al.Effects of ethoxylated α-naphtholsulfonic acid on tin electroplating at iron electrodes [J].Journal of the Electrochemical Society, 2004, 151 (5): C333-C341.
[8] NAKAMURA Y, KANEKO N, NAKAMURA M, et al.Synergistic effects of benzalacetone and benzophenone on the electrocrystallization of tin from acid stannous sulphate solutions [J].Journal of Applied Electrochemistry, 1994, 24 (5): 404-410.
[9] BARD A J, FAULKNER L R.Electrochemical Methods: Fundamentals and Applications [M].2nd ed.New York: John Wiley & Sons, 2005: 228-235.
[10] LOW C T J, WALSH F C.The stability of an acidic tin methanesulfonate electrolyte in the presence of a hydroquinone antioxidant [J].Electrochimica Acta,2008, 53 (16): 5280-5286.
[11] YAU Y H.The effect of process variables on electrotinning in a methanesulfonic acid bath [J].Journal of the Electrochemical Society, 2000, 147 (3): 1071-1076.
