117株结核分枝杆菌临床分离株对注射用抗结核药物耐药水平的研究
2015-05-20宋艳华马丽萍陆宇付育红高孟秋
宋艳华 马丽萍 陆宇 付育红 高孟秋
·论著·
117株结核分枝杆菌临床分离株对注射用抗结核药物耐药水平的研究
宋艳华 马丽萍 陆宇 付育红 高孟秋
目的 对临床Mtb菌株进行链霉素(Sm)、卡那霉素(Km)、阿米卡星(Am)、卷曲霉素(Cm)的药物敏感性试验(简称“药敏试验”),了解其耐药程度和交叉耐药水平。方法 采用微孔板Alamar blue试验(microplate Alamar Blue assay,MABA),检测117株Mtb临床分离菌株的Sm、Km、Am和Cm的体外最低抑菌浓度(MIC)值。Sm、Km、Am、Cm的临界浓度分别为2、4、1、2.5 μg/ml。将Sm、Km、Am 的MIC值大于临界浓度≤16 μg/ml、32~64 μg/ml、>64 μg/ml分别为低度耐药、中度耐药、高度耐药;Cm的MIC值大于临界浓度≤20 μg/ml、40~80 μg/ml、>80 μg/ml分别为低度耐药、中度耐药、高度耐药。结果 117株临床分离株中,83株耐Sm,其中63株(75.9%)为高度耐药,18株(21.7%)为低度耐药,2株(2.4%)中度耐药;23株耐Km和19株耐Am的耐药株中分别有78.3%(18/23)和94.7%(18/19)高度耐药,其余分别为两药的低度耐药菌株,未发现中度耐Km或Am的菌株;14株Cm耐药株的MIC值都在5~20 μg/ml,未发现高度耐药株。83株Sm耐药的菌株中有27.7%(23/83)和22.9%(19/83)分别对Km和Am耐药,71.1%(59/83)对Am和Km均敏感。Km耐药株和Am耐药株中分别有78.3%(18/23)和94.7%(18/19)同时耐Km和Am(χ2=1.157,P>0.05),且对Km和Am均高度耐药;5株对Km低度耐药,但对Am敏感。Am耐药株和Cm耐药株中,分别有68.4%(13/19)和92.9%(13/14)同时耐Am和Cm。结论 耐Sm或Km或Am的Mtb临床分离株绝大多数为高度耐药,耐Cm的Mtb临床分离株以低度耐药为主;绝大多数的Sm高度耐药株仍对Am、Km敏感;高度耐Am或Km的菌株互为为完全交叉耐药,Km低度耐药的菌株对Am敏感;Am高度耐药株多数对Cm为低度耐药,绝大多数Cm耐药株对Am高度耐药。
结核分枝杆菌; 抗结核药; 抗药性, 细菌
结核病是由Mtb感染引起的一种严重危害人类健康的慢性传染性疾病,是伴随人类历史最长的疾病之一。注射用抗结核药物Sm、Km、Am、Cm是一类重要的抗结核注射剂,作用机制相似,这组药物之间存在交叉耐药性[1-3]。了解目前流行临床菌株对这类药物的耐药和交叉耐药情况,对于选择合理的抗结核药物组成化疗方案至关重要。微孔板Alamar blue试验(microplate Alamar Blue assay,MABA)是一种颜色指示剂法,是近些年应用与检测药物最低抑菌浓度(MIC)值的一种重要方法,本实验通过用MABA 法测定结核分枝杆菌对Sm、Km、Am、Cm的药物敏感性,并分析Sm、Km、Am、Cm的交叉耐药水平,以期望为临床抗结核药物的选择提供科学的依据。
材料和方法
一、试验菌株
117株临床Mtb菌株来自北京胸科医院参比室菌株库2008年11月至2010年11月肺结核患者的菌株,菌株均经罗氏培养阳性且硝基苯甲酸(PNB)、噻吩-2-羧酸肼(TCH)菌种鉴定为Mtb;其中至少耐1种抗结核注射剂者89株,对上述4种药物(Sm、Km、Am、Cm)均敏感者28株。来源患者中初治患者67例,复治50例;女34例,男83例,年龄(45.64±16.71) 岁。117例患者中35例曾经用过注射剂,其中初治1例,复治34例;应用Sm 6例,Sm+Km 1例,Sm+Am+Cm 6例,Km 1例,Am 10例,Am+CPm 6例,Cm 5例,注射剂的用药时间在10 d 至24个月。H37Rv 标准株(ATCC27294)由北京市结核病胸部肿瘤研究所药物研究室提供。
二、试验药物
Sm(美国Sigma公司,批号:638K0813),Km(Sigma公司,批号:109K0147),Am(Sigma公司,批号:048K1289),Cm(Sigma公司,批号:018K10680)。
三、主要仪器及设备
恒温培养箱(BINDER BD720,美国);生物安全柜(ESCO LA2-6A1,新加坡);压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂,HHS型);电子天平(北京塞多利斯仪器系统有限公司,京利00000249);超低温冰箱(SANYO MDF-U4186F,日本);低温冰箱(青岛海尔股份有限公司 BCD-2007ADZ);涡旋震荡器(Scientific industries G560E Vortex-2,美国)。
四、试验方法
1.Mtb的培养及菌悬液的制备:将Mtb菌株从-80 ℃的冰箱中取出,融化后放置于7H11培养基上在37 ℃培养箱中培养,取3~4周处于对数生长期的亚培养物进行实验,将菌落刮取并研磨均匀,配置成麦氏浓度为1的菌悬液[1×107菌落形成单位(CFU)/ml]。
2.MIC值的测定:将96孔微孔板除四周边和第2列微孔外,其余各孔均加入100 μl 7H9液体培养基(不含吐温),向第2列微孔加入193.6 μl (Cm 孔为192.0 μl)7H9液体培养基,药物的储存液解冻后向第2列各孔加入6.4 μl浓度为2 mg/ml 的Sm、Km、Am,或8 μl浓度为2 mg/ml Cm,用移液器混合均匀并吸取100 μl加入第3列,依次稀释到第10列,弃去自第10孔吸出的100 μl,分别得到Sm、Km、Am终浓度为:32、16、8、4、2、1、0.5、0.25、0.125、0 μg/ml;Cm 为: 40、 20、10、 5、 2.5、 1.25、0.625、0.3125、0.156、0 μg/ml的药物浓度。第11列为空白对照。200 μl灭菌水加入96孔板的四周边的各孔中。对于罗氏培养基比例法(L-J法)显示耐药的菌株或者L-J法敏感但MABA法检测Sm、Km、Am的MIC>32 μg/ml(或Cm的MIC>40 μg/ml)的菌株,设定Sm、Km、Am的终浓度为 128、64、32、16、8、4、2、1、0.5、0 μg/ml;Cm 的终浓度为 160、80、40、20、10、 5、 2.5、 1.25、0.625、0 μg/ml。每批试验以Mtb参考株(H37Rv敏感株)作为实验的质量控制。将Mtb菌悬液(1×107CFU/ml)用7H9培养基(不含吐温)进行20倍稀释,取100 μl/孔接种于含100 μl抗菌药的96孔微孔培养板中(菌液的终浓度约为2.5×105CFU/ml),方法参照文献[4-5]。置于37 ℃培养箱中培养。7 d 后生长对照孔和含药孔加入20 μl Alamar blue和20% 吐温-80 12.5 μl的混合液,37 ℃孵育24 h,记录各孔的颜色,蓝色孔为无生长,粉红色孔为有生长,紫红色孔再继续37 ℃培养24 h,不变为粉红色,其相连的蓝色孔仍为蓝色,则记录为有生长。MIC定义为阻止颜色变化(从蓝色变为粉红色)的最低药物浓度。每批试验以H37Rv敏感株作为实验的质量控制。
[6-7]设定Sm、Km、Am、Cm的临界浓度分别为2、4、1、2.5 μg/ml。将Sm、Km、Am 的MIC值大于临界浓度≤16 μg/ml、32~64 μg/ml、>64 μg/ml分别为低度耐药、中度耐药、高度耐药;Cm的MIC值大于临界浓度≤20 μg/ml、40~80 μg/ml、>80 μg/ml分别为低度耐药、中度耐药、高度耐药。
五、统计学分析
对所记录的研究菌株的MIC值进行统计分析,本研究采用SPSS 17.0 软件进行数据分析,使用χ2检验分析耐药构成比,P<0.05认为差异有统计学意义。
结 果
一、Mtb临床分离株对Sm、Km、Am、Cm的MIC值分布
117株临床株中,Sm、Km、Am、Cm的MIC值分布见表1。耐Sm、Km、Am、Cm的菌株分别为83株(70.9%)、23株(19.7%)、19株(16.2%)、14株(12.0%)。
83株对Sm耐药的菌株中,63株(75.9%)为高度耐药,18株(21.7%)为低度耐药,2株(2.4%)为中度耐药;63株对Sm 高度耐药的菌株中,44株(69.8%)对其他3种药物均敏感,19株(30.2%)合并耐其他3种药物中的至少1种药物,两者相比差异有统计学意义(χ2=19.841,P<0.001)。
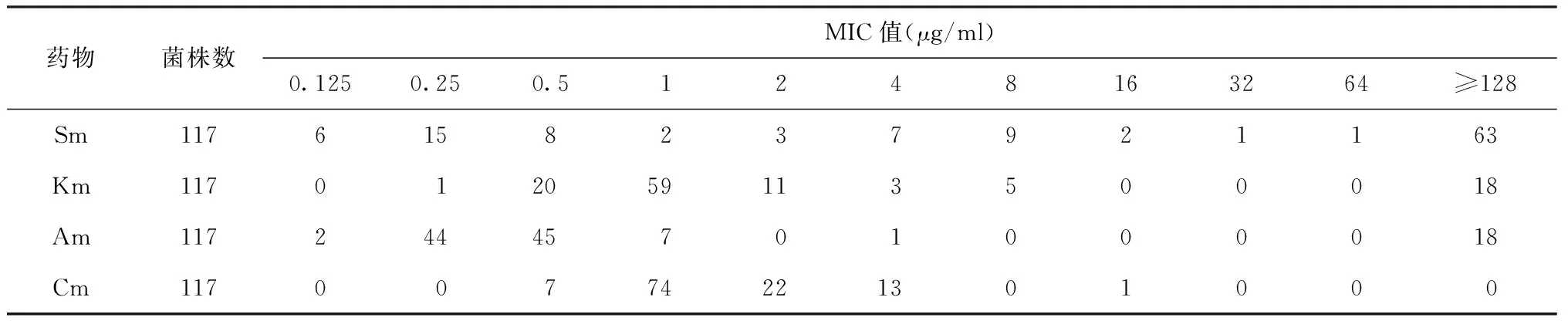
表1 117株临床分离株对Sm、Km、Am、Cm 的MIC值分布(株)
注 MIC 值0.5、1.0、2、4、16 μg/ml对应Cm的MIC值是0.625、1.25、2.5、5、20 μg/ml
二、Mtb临床分离株对Sm与Am、Km、Cm交叉耐药结果
83株耐Sm的菌株中,23株(27.7%)耐Km,19株(22.9%)耐Am,18株(21.7%)同时耐Km和Am(见表2),三者比较差异无统计学意义(χ2=0.922,P>0.05);Sm耐药株中,59株(71.1%)对Am和Km均敏感。
63株Sm的MIC>64 μg/ml的高度耐药株中,20.6%(13/63)合并Am和Km高度耐药(MIC>128 μg/ml);69.8%(44/63)对Km和Am均敏感(两药的MIC均≤1 μg/ml),同时耐Km和Am的菌株(13株)所占比率低于对Km、Am均敏感的菌株(44株)所占的比率(χ2=30.787,P<0.001)。2株 Sm的MIC值在32~64 μg/m的菌株,均对Km、Am高度耐药(MIC>128 μg/ml)。18株Sm的MIC在4~16 μg/ml的菌株中,3株(16.7%)对Km、Am均高度耐药(MIC>128 μg/ml),15株(83.3%)对Km、Am敏感(1株对Km、Am的MIC值分别为4 μg/ml和0.5 μg/ml;其余14株Km 的MIC值均≤2 μg/ml,Am的 MIC值均≤0.5 μg/ml)。
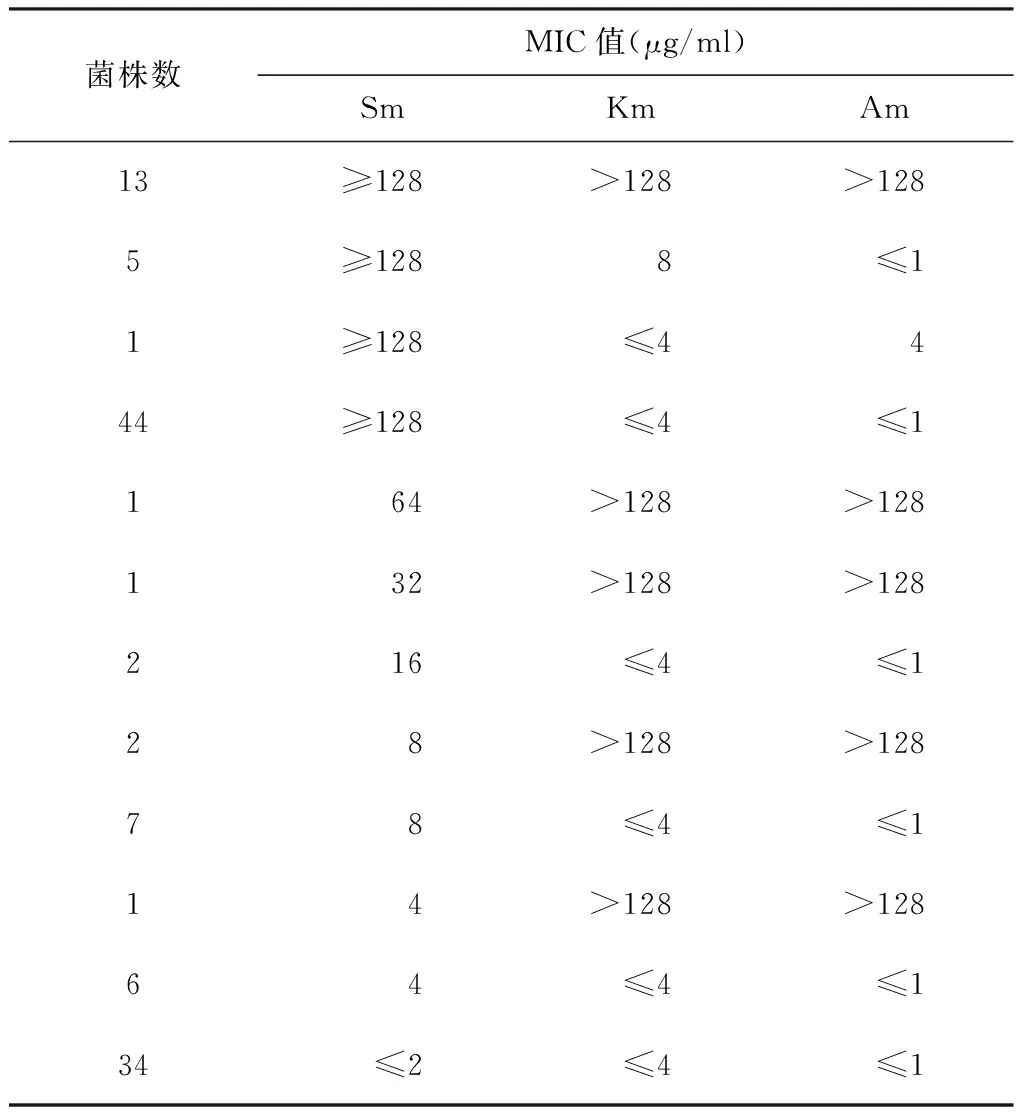
表2 117株临床分离株对Sm与Am、Km交叉耐药的检测结果
18株Km和Am 的MIC均>128 μg/ml耐药的菌株中,15株(83.3%)Sm的 MIC值≥32 μg/ml,2株(11.1%) Sm的 MIC是8 μg/ml,1株(5.6%)MIC是4 μg/ml (表2);Sm高中度耐药株所占比率高于其低度耐药株(χ2=16.000,P<0.001),没有发现对Km和Am均高度耐药但对Sm敏感(MIC≤2 μg/ml)的菌株。
23株Km耐药株和19株Am耐药株中,18株对Km和Am均耐药,且都是高度耐药(MIC>128 μg/ml),分别占Km耐药株和Am耐药株的78.3%(18/23)和94.7%(18/19),两者比较差异无统计学意义(χ2=1.157,P>0.05)。而Km低度耐药株共5株,这5株均对Am敏感(MIC≤1 μg/ml),Am低度耐药株1株(MIC为4 μg/ml),其Km的MIC是4 μg/ml。94株Km敏感的菌株中,有93株对Am敏感,这些菌株中Km的MIC均值[(1.0672±0.60919)μg/ml]高于Am的MIC均值[(0.4005±0.19114)μg/ml]。
19株Am耐药株和14株Cm耐药株中,有13株菌同时对Am和Cm耐药(表3),分别占 68.4%(13/19)和92.9%(13/14)(P>0.05,Fisher确切概率);并且这13株菌株均对Am高度耐药,占Am高度耐药株的72.2%(13/18),98株Am敏感株中只有1株耐Cm。

表3 117株临床菌株对Am与Cm的交叉耐药表
讨 论
一、MABA 法测定Mtb的Sm、Km、Am、Cm临界浓度的界定
基于Alamar blue测定Mtb对药物敏感性的MABA法是种较为经济、快速、准确的颜色指示剂药敏法。这种方法与传统比例法及其他液体培养基药敏法有很好的一致性[4,6,8-9]。使用96孔板相对于试管可以减少加入药品及菌液的用量,而且时间较短,仅用8 d就能得出结果,比传统方法缩短近3周时间。这种方法更能直接、快速地检测菌株对药物的应答情况,有助于指导临床早期选择合理的药物制定合适的化疗方案。药物敏感性判定的关键在于耐药的临界浓度,本研究根据WHO推荐的液体培养法Bactec 460和MGIT 960法抗Mtb注射剂的临界浓度[6-7],Sm、Km、Am、Cm临界浓度参考值分别为2.0、4.0、1.0、2.5 μg/ml。
二、Mtb临床分离株对4种抗结核注射剂的MIC值分布
本研究中,Sm的MIC值分布显示对Sm耐药株中75.9%(63/83)菌株为高度耐药株(MIC≥128 μg/ml),这一比例明显高于对Sm的中低度耐药株(MIC=4~64 μg/ml)所占比例之和,而且发现Sm的MIC值以中度耐药(MIC=32~64 μg/ml)的菌株最少,本研究只发现2例。Sugawara等[10]测定74株来自中国的耐Sm的Mtb菌株,显示45株(61%)是MIC>100 μg/ml的高度耐药,与本研究结果接近。但是巴塞罗纳地区一项研究的菌株则以中低度耐药为主[11]。Km和Am耐药菌株的MIC值分布显示,78.3%和94.7%为高度耐药,Cm的耐药株MIC值都在5~20 μg/ml,没有高度耐药菌株,耐药株对Cm的MIC值略低于美国和非洲的报道[1,12],这可能与菌株来源不同及不同的药敏试验方法的差异相关。但总的来说临床分离株耐Cm的比例较低,且是以低度耐药为主。
三、Mtb临床分离株对4种抗结核注射剂的交叉耐药分析
Sm和Am、Km分子结构和抗菌机制相似,均作用于细菌的核糖体,阻碍蛋白的合成,这类药物之间存在交叉耐药性。我国Mtb对氨基苷类药物耐药及交叉耐药情况缺乏大规模的调查,最新全国结核病耐药性基线调查报告显示[13],我国的涂阳肺结核患者对抗结核药物的总耐药率为39.12%,其中一线抗结核药物耐药率最高的是Sm (28.93%,初治27.69% 复治37.20%),而对Km的耐药率为2.34%。结合近些年其他小范围的注射剂耐药率的调查,显示Sm的耐药率明显高于其他3种药物[2,14-15],对Sm耐药的菌株仍可有70%以上对其他3种药物敏感,但是耐Km(Am)或Cm的菌株90%左右对Sm耐药[2, 15], Km与Am的耐药率相近。Am(Km)与Cm的耐药率不同报道间有差异,上海报道Am与Cm的耐药率相近,分别为22.1%和19.5%[2];而江苏报道为8.2%和3.3%[16],但是较为一致的是对Cm耐药的菌株绝大多数也对Am耐药。
本研究中采用的菌株多数为罗氏药敏试验结果为至少耐4种抗结核注射剂中的一种药的菌株,Sm、Km、Am、Cm的耐药率分别为70.9%、19.7%、16.2%、12.0%。Sm耐药率明显高于其他3种药物,而Am、Km、Cm的耐药率比较差异没有统计学意义。即使对Sm高度耐药的菌株中也有69.8%对Km、Am、Cm均敏感,所以多数对Sm高度耐药的菌株仍然可以选用其他3种药物治疗。本研究中对Km、Am、Cm同时耐药的菌株均耐Sm,且绝大多数是高度耐Sm,但小部分菌株对Sm的MIC在4~16 μg/ml,应用Sm可能有效。有报道少数对Km、Am高度耐药菌株对Sm敏感[17-18],但是本研究中没有发现这种菌株。注射剂的现状考虑与抗结核用药历史有关,早期Sm应用后选择出对Sm耐药菌株的基础上,随着Km、Am的应用进一步选择出了联合耐药突变株。目前,尚未发现关于Sm耐药株中产生耐Am或Km突变株频率是否增加的研究报道。所以,一般情况下考虑对Km、Am、Cm耐药的患者不再考虑采用Sm治疗,但是在有可靠的药敏试验结果、而且需要注射剂组成方案时也不能完全放弃Sm。
Km、Am和Cm是目前MDR-TB治疗中的核心抗结核药物,这3种药物的交叉耐药情况是我们关注的重点。本研究显示,对Am或Km耐药的菌株中绝大多数是对两药同时高度耐药的菌株,即Am和Km高比例交叉耐药;而且对于高度耐药的菌株,两药是完全交叉耐药,但仍有一小部分对Km低度耐药的菌株对Am敏感,这与Maus等[1]和Engström等[19]的体外试验结果及临床株药敏试验结果相一致。另外,体外试验可以筛选出对Km高度耐药、对Cm低度耐药的Mtb突变株[19];本研究在临床株中也发现了类似的交叉耐药表型,即多数对Am高度耐药菌株对Cm呈现中低度耐药,但是也发现部分对Am高度耐药菌株(27.8%)对Cm仍然敏感。体外研究显示,Cm从敏感株中筛选出的耐药株对Km呈现低度耐药,对Am敏感[1,19]。所以,目前专家建议Km、Am和Cm三药的选用顺序是Cm→Km→Am,这样前药耐药出现后后药仍可能有效。但是从本研究及其他研究的结果来看[1,19-20],Mtb临床分离株中,对Km和Am的耐药率相当,几乎完全交叉耐药;所以,在没有药敏试验条件下如果对Km和Am中的一种药物治疗无效,则不主张应用另一种药物。另外,本研究表明对Km和(或)Am高度耐药菌株绝大多数对Cm呈现低度耐药或者敏感;国内其他研究也显示对Km和(或)Am的耐药率高于Cm,对于Km和(或)Am耐药的菌株却部分对Cm敏感[20]。所以,笔者考虑对Km和Am耐药的菌株仍有部分可以选用Cm进行抗结核治疗,这尤其在XDR-TB治疗中有重要意义。
本研究数据显示,临床分离株中耐Sm和(或)Km和(或)Am的Mtb菌株均以高度耐药为主,耐Cm的临床分离株以低度耐药为主,对Sm高度耐药的绝大多数菌株仍可以选用 Am、Km、Cm治疗;对Km和(或)Am的高度耐药菌株呈现完全交叉耐药,对Km低度耐药的菌株对Am敏感。Cm仍是目前对Km和(或)Am耐药菌株可以选用的抗结核药物。
参 考 文 献
[1] Maus CE,Plikaytis BB, Shinnick TM. Molecular analysis of cross-resistance to capreomycin, kanamycin, amikacin, and viomycin inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2005, 49(8): 3192-3197.
[2] 曹广云,肖和平,闫丽萍,等.三种注射用抗结核药物对结核分枝杆菌的耐药情况分析. 中国防痨杂志, 2010, 32(4): 227-230.
[3] Alangaden GJ, Kreiswirth BN, Aouad A, et al. Mechanism of resistance to amikacin and kanamycin inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 1998, 42(5): 1295-1297.
[4] 陆宇,王彬,郑梅琴,等. 应用Alamar Blue和MTT测定抗结核药物最低抑菌浓度的研究. 中国防痨杂志, 2007, 29(6): 499-501.
[5] Palomino JC, Martin A, Camacho M, et al. Resazurin microtiter assay plate: simple and inexpensive method for detection of drug resistance inMycobacteriumtuberculosis. Antimicrob Agents Chemother, 2002, 46(8): 2720-2722.
[6] Collins L, Franzblau SG. Microplate alamar blue assay versus BACTEC 460 system for high-throughput screening of compounds againstMycobacteriumtuberculosisandMycobacteriumavium. Antimicrob Agents Chemother, 1997, 41(5): 1004-1009.
[7] World Health Organization. Policy guidance on drug-susceptibility testing (DST) of second-line antituberculosis drugs. Geneva: World Health Organization, 2008.
[8] 张宗德,邢爱英,刘忠泉,等. 噻唑蓝和刃天青法在一线抗结核药物药敏试验中的应用. 中华检验医学杂志, 2008, 31(9): 989-992.
[9] Franzblau SG, Witzig RS, McLaughlin JC, et al. Rapid, low-technology MIC determination with clinicalMycobacteriumtuberculosisisolates by using the microplate Alamar Blue assay. J Clin Microbiol, 1998, 36(2):362-366.
[10] Sugawara I, Zhang J, Li C. Cross-resistance ofMycobacteriumtuberculosisisolates among streptomycin, kanamycin and amikacin. Indian J Exp Biol, 2009, 47(6): 520-522.
[11] Tudó G,Rey E, Borrell S, et al. Characterization of mutations in streptomycin-resistantMycobacteriumtuberculosisclinical isolates in the area of Barcelona. J Antimicrob Chemother, 2010, 65(11): 2341-2346.
[12] Sirgel FA, Tait M, Warren RM, et al. Mutations in the rrs A1401G gene and phenotypic resistance to amikacin and capreomycin inMycobacteriumtuberculosis. Microb Drug Resist, 2011,18(2):193-197.
[13] 中华人民共和国卫生部. 全国结核病耐药性基线调查报告(2007—2008年). 北京:人民卫生出版社,2010:5-61.
[14] 郭颖,许钦龙. 110株结核分枝杆菌二线药敏结果分析. 临床肺科杂志, 2011,16(8): 1279-1280.
[15] 施旭东,王雷. 卷曲霉素对结核分枝杆菌体外抑菌作用的研究. 江苏大学学报(医学版), 2004, 14(2): 100-102.
[16] 王雷,施旭东. 4种氨基甙类抗生素对结核分枝杆菌(MTB)的体外抑菌作用的研究. 实验与检验医学, 2009, 27(4): 367-368.
[17] Via LE, Cho SN, Hwang S, et al. Polymorphisms associated with resistance and cross-resistance to aminoglycosides and capreomycin inMycobacteriumtuberculosisisolates from South Korean Patients with drug-resistant tuberculosis. J Clin Microbiol, 2010, 48(2): 402-411.
[18] Juréen P, Angeby K, Sturegård E, et al. Wild-type MIC distributions for aminoglycoside and cyclic polypeptide antibiotics used for treatment ofMycobacteriumtuberculosisinfections. J Clin Microbiol, 2010, 48(5): 1853-1858.
[19] Engström A, Perskvist N, Werngren J, et al. Comparison of clinical isolates and in vitro selected mutants reveals thattlyAis not a sensitive genetic marker for capreomycin resistance inMycobacteriumtuberculosis. J Antimicrob Chemother, 2011, 66(6): 1247-1254.
[20] 常珊,付育红,李琦,等.结核分枝杆菌临床分离株对四种注射用抗结核药物耐药及交叉耐药分析.中国防痨杂志,2013,35(1):37-40.
(本文编辑:薛爱华)
Study on the levels of injectable antituberculosis drug resistance in 117Mycobacteriumtuberculosisclinical strains
SONGYan-hua,MALi-ping,LUYu,FUYu-hong,GAOMeng-qiu.
DepartmentofTuberculosis,BeijingChestHospital,CapitalMedicalUniversity,BeijingTuberculosisandThoracicTumourResearchInstitute,Beijing101149,China
GAOMeng-qiu,Email:gaomqwdm@aliyun.com
Objective To observe the levels of the resistance and cross-resistance to streptomycin (Sm), kanamycin (Km), amikacin (Am), capreomycin (Cm) inMycobacteriumtuberculosis(Mtb) clinical strains by drug susceptibility test (DST). Methods The MICs of Sm, Km, Am, and Cm in 117 Mtb clinical strains were detected by microplate Alamar blue assay (MABA). The critical concentration of Sm, Km, Am, and Cm on Mtb were 2, 4, 1 and 2.5 μg/ml, respectively. When the MICs of Sm/Km/Am on Mtb were greater than critical concentration and ≤16 μg/ml, or 32-64 μg/ml, or >64 μg/ml, the drug resistances were defined as low level, moderate level, and high level, respectively. But that for Cm on Mtb was greater than critical concentration and ≤20 μg/ml, or 40-80 μg/ml, or >80 μg/ml. Results Of 117 Mtb clinical isolates, 83 were Sm-resistant, in which 63 isolates(75.9%)were high resitance, 18 isolates (21.7%) were low resistance, 2 isolates (2.4%) were moderate resis-tance. 78.3% of 23 Km-resistant strains and 94.7% of 19 Am-resistant strains were high-level resistance (MIC≥128 μg/ml), other isolates were low-level resistant to Am/Km, no moderate-level resistant isolates were observed. The MICs of 14 Cm-resistant isolates were 5-20 μg/ml, and there were not high level of Cm-resistant isolates. Of 83 Sm-resistant isolates, 27.7% (23/83) and 22.9% (19/83) were resistant to Km and Am respectively, 71.1% (59/83) were sensitive to both Km and Am. 78.3% (18/23) of Km-resistant isolates and 94.7% (18/19) of Am-resistant isolates were highly resistant to both Km and Am, which had no significant difference (χ2=1.157,P>0.05). Five strains were low resistance to Km, but sensitive to Am. 68.4%(13/19) of Am-resistant isolates and 92.9% (13/14) of Cm-resistant isolates were resistant to both Am and Cm. Conclusion The majority of the Sm/Km/Am-resistant clinical isolates were high resistance, and the majority of the Cm-resistant clinical isolates were low resistance. Most of highly Sm-resistant isolates were susceptible to Km/Am. The highly Am/Km-resis-tant isolates showed cross resistance each other. A small proportion of lowly Km-resistant isolates were sensitive to Am. Most of highly Am-resistant isolates were low resistance to Cm. Almost all of Cm-resistant isolates were high resistant to Am.
Mycobacteriumtuberculosis; Antitubercular agents; Drug resistance, bacterial
10.3969/j.issn.1000-6621.2015.04.009
北京市医院管理局临床医学发展专项(ZYLX201304)
101149 首都医科大学附属北京胸科医院 北京市结核病胸部肿瘤研究所结核科(宋艳华、马丽萍、高孟秋),药物研究室(陆宇),国家结核病临床实验室(付育红)
高孟秋,Email:gaomqwdm@aliyun.com
2014-07-14)
