替普瑞酮对急性胰腺炎大鼠肠黏膜屏障保护作用的实验研究*
2015-05-15郭晓榕湛先保
郭晓榕 刘 晓 李 洁 吴 敏 湛先保
第二军医大学长海医院消化内科(200433)
肠黏膜屏障功能损害是急性胰腺炎(acute pancreatitis,AP)发生、发展的关键环节,与疾病预后密切相关[1-2]。正常情况下,肠黏膜与黏膜下层之间有一道具有高度选择性的机械屏障,上皮细胞间连接复合体和主要紧密连接结构由多种蛋白组成,其中 occludin和 ZO-1(zonula occludens-1)蛋白对维持正常屏障结构和功能具有重要意义[3]。替普瑞酮(teprenone)为临床常用胃黏膜保护剂,其在治疗胃炎、胃溃疡、防治乙醇、非甾体消炎药(NSAIDs)等因素相关性胃黏膜损伤中的作用已得到广泛认可[4-5],对于各种原因引起的肠黏膜损伤,替普瑞酮同样发挥重要保护作用[5-8]。本实验以腹部皮下注射雨蛙素(cerulein)建立水肿型AP大鼠模型,并予替普瑞酮灌胃干预,通过观察血清促炎细胞因子白细胞介素-1(IL-1)、IL-6、肿瘤坏死因子-α(TNF-α)水平、肠黏膜形态学以及上皮细胞间紧密连接蛋白occludin、ZO-1表达的变化,探讨替普瑞酮对AP肠黏膜屏障的保护作用及其可能机制,为替普瑞酮应用于AP临床治疗提供理论依据。
材料与方法
一、实验动物和主要试剂
健康成年雄性Sprague-Dawley大鼠45只,体质量180~220 g(第二军医大学动物实验中心)。替普瑞酮[卫材(中国)药业有限公司]于使用前配制成新鲜混悬液;雨蛙素(Sigma-Aldrich Co.);IL-1、IL-6、TNF-α ELISA 试剂盒(Takara Bio Company);淀粉酶ELISA试剂盒(QIAGEN);羊抗鼠occludin、ZO-1 单克隆抗体(Santa Cruz Biotechnology,Inc.);荧光标记兔抗羊二抗(Cell Signaling Technology,Inc.,工作浓度 1∶100)。
二、方法
1.水肿型AP大鼠模型建立和分组:采用随机数字表法将大鼠分为3组:正常对照组(n=5)、AP模型组(n=20)和替普瑞酮治疗组(n=20)。实验前12 h禁食,不限饮水,造模大鼠腹部皮下注射雨蛙素20μg/(kg·h),共4次;正常对照组大鼠腹部皮下注射等体积0.9%NaCl溶液。替普瑞酮治疗组于造模前2 h和造模后2 h予替普瑞酮1000 mg/kg灌胃。术后12 h麻醉、处死大鼠,心脏穿刺取血,离心取上清液,-20℃保存待测。打开腹腔分离小肠,取距回盲部5 cm处回肠组织,0.9%NaCl溶液漂洗,用于后续检查。
2.血清促炎细胞因子和淀粉酶检测:采用双抗体夹心ELISA法检测血清IL-1、IL-6、TNF-α和淀粉酶水平,按试剂盒说明书进行操作。
3.组织病理学检查:回肠组织标本4%甲醛溶液固定,石蜡包埋,4~5μm厚连续切片,常规HE染色,光学显微镜下每张切片随机选取20个高倍视野进行观察。
4.超微结构观察:回肠组织标本2.5%戊二醛溶液4℃前固定2 h以上,PBS漂洗3次,1%锇酸后固定约1 h,1%乙酸铀块染2 h,梯度丙酮脱水,逐步浸透包埋,修块后半薄切片光学显微镜下定位,每张切片随机选取50个高倍视野,日立H-7500型透射电子显微镜下观察。
5.蛋白质印迹法检测 occludin、ZO-1蛋白表达:回肠组织剪碎后加入 RIPA 300μL、PMSF 5μL研磨匀浆1 min,转移至EP管,冰上放置30 min,期间振荡3次,离心取上清液,BCA法测定蛋白浓度。蛋白上样,SDS-PAGE电泳,半干转印于硝酸纤维素膜,分别加入一抗和二抗孵育,LI-COR Odyssey双色红外激光成像系统观察、拍照。
三、统计学分析
结 果
一、血清促炎细胞因子和淀粉酶水平
与正常对照组相比,AP模型组血清IL-1、IL-6、TNF-α和淀粉酶水平显著升高,提示炎症反应增强,而替普瑞酮治疗组各项指标均较AP模型组显著降低,提示替普瑞酮干预对AP时的全身性炎性反应和胰腺组织破坏有一定抑制作用(表1)。
二、小肠黏膜组织病理学变化
正常对照组小肠黏膜绒毛完整,黏膜下层次结构清楚;AP模型组小肠黏膜水肿变性,绒毛坏死脱落,局部上皮细胞与固有层分离;替普瑞酮治疗组仅出现黏膜下层炎性细胞浸润,小肠绒毛仍较完整,未见坏死脱落,提示替普瑞酮干预对AP时的小肠黏膜完整性有一定保护作用(图1)。
三、小肠黏膜超微结构变化
正常对照组小肠黏膜上皮细胞微绒毛结构完整,细胞间紧密连接致密;AP模型组微绒毛脱落、断裂,紧密连接明显增宽,与组织病理学变化相一致;替普瑞酮治疗组微绒毛和紧密连接破坏较AP模型组明显改善,形态接近正常对照组,提示替普瑞酮干预对AP时的小肠黏膜超微结构有一定保护作用(图2)。
四、小肠黏膜occludin、ZO-1蛋白表达
与正常对照组相比,AP模型组小肠黏膜组织occludin、ZO-1蛋白表达明显下调,而替普瑞酮治疗组两种蛋白表达均较AP模型组增强,提示替普瑞酮干预可增强AP时的小肠黏膜上皮细胞间紧密连接蛋白表达(图3)。
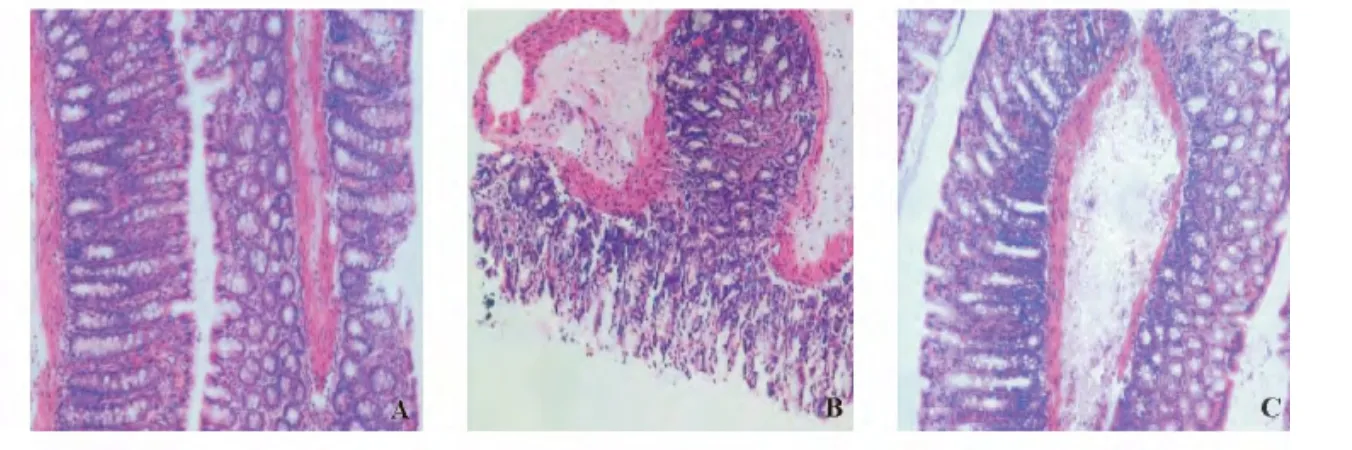
图1 各组大鼠小肠黏膜组织病理学变化(HE染色,×200)
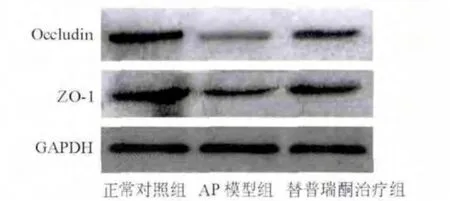
图3 各组大鼠小肠黏膜occludin、ZO-1蛋白表达(蛋白质印迹法)
讨 论
肠黏膜屏障由机械屏障、化学屏障、生物屏障、免疫屏障等组成,不同屏障的结构、分子调控机制和生物学功能各不相同,协同防御外来物质的侵袭[9-10]。肠黏膜上皮细胞间的紧密连接结构包绕在上皮细胞靠近肠腔的一侧,受细胞因子调节,影响整个肠黏膜屏障的通透性。该结构可有效阻止肠腔内细菌、毒素、炎性介质等的旁细胞转运,维持肠黏膜上皮屏障功能的完整性[11-12]。重症急性胰腺炎(SAP)时,肠道不仅是脓毒症的靶器官,更是全身性炎症反应综合征(SIRS)以及局部和全身感染的启动部位,肠黏膜屏障功能受损致黏膜通透性增高,细菌和内毒素易位,导致内皮细胞活化,释放炎性介质和细胞因子,启动SIRS并引起多器官功能障碍综合征(MODS);同时,细菌和毒素进入循环后引起胰腺及其周围组织继发感染,是SAP患者死亡的主要原因[13-14]。因此,研究肠黏膜屏障的损伤机制,并采取相应防治措施,对于改善AP患者的预后具有重要意义。

表1 各组大鼠血清IL-1、IL-6、TNF-α和淀粉酶水平比较
替普瑞酮作为一种抗溃疡药,已被证实在胃黏膜细胞保护中起重要作用。2005年Ohkawara等[7]发现替普瑞酮对葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎具有保护效应,表明替普瑞酮在肠道细胞保护中亦发挥重要作用。Iwai等[8]评估了替普瑞酮对小肠黏膜的保护效应,发现其可增加大鼠小肠黏膜黏蛋白,尤其是唾液黏蛋白的分泌,减轻洛索洛芬钠诱导的小肠黏膜损伤,并发现该保护机制可能与抑制肠道细菌过度生长有关,提示了替普瑞酮治疗肠道黏膜损伤、保护肠黏膜屏障功能的潜力。Niwa等[5]开展的前瞻性随机双盲安慰剂对照交叉试验证实替普瑞酮对NSAIDs相关性胃肠黏膜损伤具有保护作用,以胶囊内镜对胃肠黏膜损伤进行评估,发现替普瑞酮加雷贝拉唑与安慰剂加雷贝拉唑相比,能明显减轻双氯芬酸钠引起的胃和小肠黏膜损伤。基于上述研究结论,推测替普瑞酮对AP时的肠黏膜屏障损伤亦可能具有潜在保护作用。本研究结果显示,造模前后给予替普瑞酮灌胃干预的AP模型大鼠,血清促炎细胞因子 IL-1、IL-6、TNF-α 水平显著降低,提示替普瑞酮干预对AP时的全身性炎症反应有一定抑制作用,同时该组小肠黏膜组织病理学和超微结构病变明显减轻,血清淀粉酶水平显著下降,提示替普瑞酮能保护AP时的小肠黏膜完整性和超微结构,改善胰腺组织破坏和小肠黏膜损伤。蛋白质印迹法检测显示,替普瑞酮干预可增强AP大鼠模型小肠黏膜上皮细胞间紧密连接结构主要功能蛋白occludin、ZO-1表达,提示替普瑞酮可能通过上调紧密连接蛋白表达参与了AP时肠黏膜屏障的保护。该作用是否能进一步减轻胰腺组织学损伤,提高AP模型大鼠的生存率,尚有待进一步研究。
1 Bakoyiannis A,Delis S,Dervenis C.Pathophysiology of acute and infected pancreatitis[J].Infect Disord Drug Targets,2010,10(1):2-4.
2 Pandol SJ,Saluja AK,Imrie CW,et al.Acute pancreatitis:bench to the bedside[J].Gastroenterology,2007,132(3):1127-1151.
3 Park HY,Kunitake Y,Hirasaki N,et al.Theaflavins enhance intestinalbarrierofCaco-2 Cellmonolayers through the expression of AMP-activated protein kinasemediated Occludin,Claudin-1,and ZO-1[J].Biosci Biotechnol Biochem,2015,79(1):130-137.
4 Kai S,Ohta M,Tominaga M,et al.Reduction of ethanolinduced injury in portal hypertensive gastric mucosa of rats by induction of heat shock protein 72 by geranylgeranylacetone[J].Wound Repair Regen,2007,15(6):875-880.
5 Niwa Y,Nakamura M,Miyahara R,et al.Geranylgeranylacetone protects against diclofenac-induced gastric and small intestinal mucosal injuries in healthy subjects:a prospective randomized placebo-controlled double-blind cross-over study[J].Digestion,2009,80(4):260-266.
6 Inoue T,Yorifuji N,Iguchi M,et al.Geranylgeranylacetone suppresses colitis-related mouse colon carcinogenesis[J].Oncol Rep,2015,33(4):1769-1774.
7 Ohkawara T,Nishihira J,Takeda H,et al.Geranylgeranylacetone protects mice from dextran sulfate sodiuminduced colitis[J].Scand J Gastroenterol,2005,40(9):1049-1057.
8 Iwai T,Ichikawa T,Kida M,et al.Protective effect of geranylgeranylacetone against loxoprofen sodium-induced small intestinal lesions in rats[J].Eur J Pharmacol,2011,652(1-3):121-125.
9 Walker A.Intestinal colonization and programming of the intestinal immune response[J].J Clin Gastroenterol,2014,48(Suppl 1):S8-S11.
10 KernbauerE, CadwellK. Autophagy, viruses, and intestinal immunity[J].Curr Opin Gastroenterol,2014,30(6):539-546.
11 Keszthelyi D,Troost FJ,Jonkers DM,et al.Serotonergic reinforcement of intestinal barrier function is impaired in irritable bowel syndrome[J].Aliment Pharmacol Ther,2014,40(4):392-402.
12 Naik P,Fofaria N,Prasad S,et al.Oxidative and proinflammatory impact of regular and denicotinized cigarettes on blood brain barrier endothelial cells:is smoking reduced or nicotine-free products really safe?[J].BMC Neurosci,2014,15:51.
13 Yasuda T,Takeyama Y,Ueda T,et a1.Breakdown of intestinalmucosa via accelerated apoptosis increases intestinalpermeability in experimental severe acute pancreatitis[J].J Surg Res,2006,135(1):18-26.
14 Aydin S,Isik AT,Unal B,et al.Effects of infliximab on bacterial translocation in experimental acute necrotizing pancreatitis[J].Indian J Med Res,2012,135(5):656-661.
