酪氨酸-DNA磷酸二酯酶抑制剂的研究进展
2015-05-15黄亚辉董国强张万年盛春泉第二军医大学药学院上海200433
黄亚辉,董国强,张万年,盛春泉(第二军医大学药学院,上海 200433)
・综述・
酪氨酸-DNA磷酸二酯酶抑制剂的研究进展
黄亚辉,董国强,张万年,盛春泉(第二军医大学药学院,上海 200433)
酪氨酸-DNA磷酸二酯酶Ⅰ(tyrosyl-DNA-phosphodiesteraseⅠ,TdpⅠ)是一个具有催化3′磷酸酪氨酸键水解活性的蛋白质,该键在拓扑异构酶Ⅰ(topoisomeraseⅠ,TopⅠ)与DNA相互作用时就会形成。由于TdpⅠ具有修复TopⅠ-DNA复合物、抵消TopⅠ抑制剂作用的功能,因而与TopⅠ共同被认作是潜在治疗靶标。TdpⅠ抑制剂不仅与TopⅠ抑制剂(喜树碱类)起到协同作用,还能增强博来霉素、TopⅡ抑制剂(依托泊苷、多柔比星)以及DNA烷化剂作用。综述目前报道的TdpⅠ抑制剂研究进展,重点介绍其作用机制、生物活性及构效关系。
酪氨酸-DNA磷酸二酯酶Ⅰ(TdpⅠ);拓扑异构酶Ⅰ(TopⅠ);抗肿瘤药物;构效关系
作为一个生命体众多重要细胞过程中的关键酶,真核生物的拓扑异构酶Ⅰ(TopⅠ)通过解开DNA双螺旋结构,将存储的基因信息经由复制、转录和修复过程得以释放并发挥作用[1,2]。机制研究发现,TopⅠ上酪氨酸723的羟基作为亲核基团进攻DNA磷酸二酯键,将5′末端替代为3′末端,形成所谓的“断键复合物”(TopⅠcomplex cleavage,TopⅠcc)[3,4]。通常情况下,断裂的DNA会被迅速缝合,TopⅠ-DNA断键复合物也只会短暂存在。然而,一旦该复合物被内源性物质(包括胸腺嘧啶二聚体、碱基配对错误、碱基缺失等)或者外源性物质(包括喜树碱、依托泊苷等)的DNA损伤“抓住”,便将长时间存在于细胞中,进而在复制叉与转录复合物相撞后,造成细胞DNA破坏[4,5]。因此,为保证细胞的生存,就必须修复这些损伤。
TopⅠcc的修复机制复杂,涉及若干条通路。其中一条涉及到酪氨酸-DNA磷酸二酯酶Ⅰ(TdpⅠ),它催化TopⅠ上酪氨酸基团与DNA的3′磷酸之间共价键的水解[6,7]。此外,最近有研究表明TdpⅠ也是碱基修复通路(base excision repair,BER)的一员[8,9]。多核苷酸激酶磷酸酶(PNKP)和XRCC1蛋白质,加上其他BER蛋白质,比如DNA聚合酶β、DNA连接酶Ⅲ和PARP-1,形成一个多蛋白DNA修复复合物[10]。TdpⅠ与XRCC1复合物一起修复TopⅠcc。3′磷酸末端随后被PNKP切除,产生3′羟基,接着由DNA多聚酶β代替缺失的DNA片段,最后由DNA连接酶Ⅲ重新缝合DNA(图1)[11]。更有研究表明,人类TdpⅠ活性位点上纯合子H493R突变会导致罕见的常染色体神经退行性疾病——伴轴突性神经病小脑萎缩(SCAN1)[12],这也进一步突出TdpⅠ在中央神经系统中的重要性。尽管SCAN1患者并没有表现出明显的细胞功能障碍,但是TdpⅠ敲除小鼠及SCAN1突变细胞都表现出对喜树碱(CPT)的高度敏感[13-16]。而当细胞中TdpⅠ过度表达则会导致CPT或者依托泊苷介导的DNA损伤减少,甚至出现耐药性[17,18]。
除了TdpⅠ之外,其他通路同样可以修复CPT诱导的DNA损伤,比如DNA修复(XPF、ERCC1、M re11、CtIP),同源结合(BRCA1、BRCA2、CtIP、M re11、Rad52)和细胞周期检查点信号传导(Rad9、BRCA1、BRCA2、p53)[19]。当这些通路失活,细胞很可能更多地依赖TdpⅠ修复CPT介导的DNA损伤。由于很多肿瘤细胞在一条或者多条DNA损伤修复通路上存在缺陷,因此,抑制TdpⅠ依赖通路,便可选择性地使得肿瘤细胞比正常细胞对TopⅠ抑制剂的敏感度高[2,20]。
在此,针对目前已记录的TdpⅠ抑制剂,我们作一简要总结,并说明该领域需要进一步研究的问题。
1 氨基糖苷类抗生素和核糖体抑制剂
出于TdpⅠ属于磷酸酶D超家族一员的缘故,首先进行TdpⅠ抑制活性测试的便是该家族其他成员的抑制剂(图1),比如新霉素(neomycin)[21]。测试重组TdpⅠ酶体外生化活性结果显示,新霉素能抑制TdpⅠ,但是要求高浓度。其抑制活性比钒酸盐(公认的磷酸酶常规抑制剂)还要弱一些。此外,还测试了新霉素的2个衍生物——巴龙霉素(paromomycin)和利维霉素(lividomycin)的活性[21],结果表明它们只有轻微的TdpⅠ抑制活性。考虑到这些氨基糖苷类化合物都是抑制细菌核糖体,因此对其他的核糖体抑制剂以同样方法进行筛选。所有经测试的氨基糖苷类和非氨基糖苷类抗生素在毫摩尔级均显示出弱的抑制活性。尽管活性并不理想,机制也不清楚,但是这为其他TdpⅠ抑制剂的鉴定建立了一个可靠的体外分析系统。
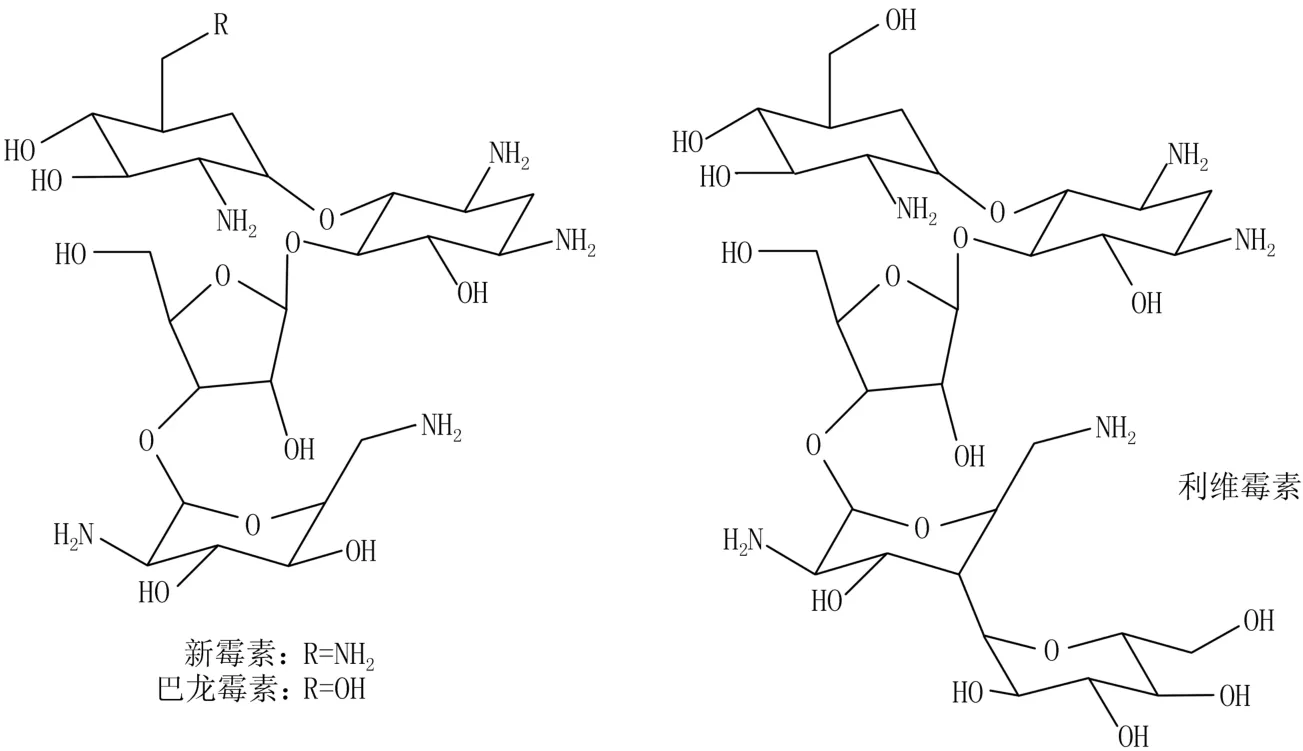
图1 新霉素、巴龙霉素和利维霉素的结构图
2 四环素类
通过两独立高通量筛选鉴定出包括罗利环素(rolitetracycline)[21]在内的大量四环素化合物,均可作为TdpⅠ抑制剂的潜在化合物(图2)。早期研究结果显示,四环素类的抑制作用为微摩尔级,但是缺少明显的构效关系。这类化合物的潜力需要进一步研究。
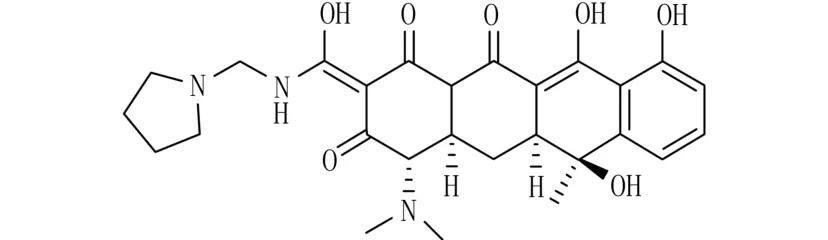
图2 罗利环素的结构图
3 furamidine(NSC 305831)
采用高通量电化学发光分析方法,对美国国立癌症研究所(NCI)发展治疗项目中1 981个化合物进行筛选,发现了furam idine(NSC 305831)在微摩尔浓度下具有TdpⅠ抑制活性(图3)[22]。目前该药作为抗非洲锥虫病正在进行Ⅲ期临床试验。其对单链和双链底物均有效,不过对双链DNA的活性更强一些。表面等离子共振研究表明,furamidine能够连接DNA单链和双链,尽管单链连接更弱。因此,对TdpⅠ的抑制活性部分可能是由于furamidine连接到DNA所致。但是,furam idine对TdpⅠ的抑制作用依赖底物DNA序列。其动力学与药物连接到酶的反应速度和持续时间有关。
另外2个联脒化合物——贝尼尔(berenil)和戊烷脒(pentamidine)则活性更弱(图3)。两者与furamidine享有相似的整体弯曲结构,只是中间的连接基团不一样,furam idine所含的是呋喃环,这暗示呋喃基团对TdpⅠ抑制活性很重要。
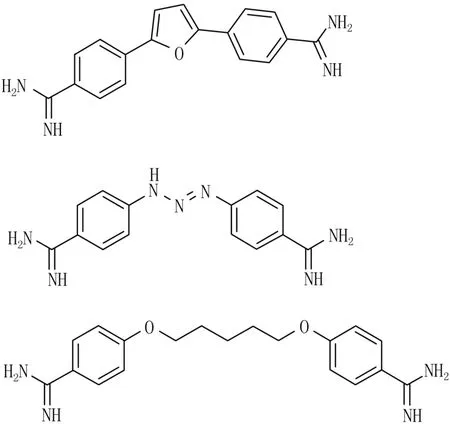
图3 furam idine、贝尼尔和戊烷脒的结构图
4 磷酸酪氨酸类似物
经高通量筛选得到2个有潜在抑制活性的化合物——甲基-3,4-dephostatin[23]和甾体化合物NSC88915[24],作为磷酸酪氨酸底物,两者具有相似的结构特征(图4)。前者是芳香胺类衍生物,带有羟基取代的苯环,与TdpⅠ底物中连接到酪氨酸基团的磷酸非常相似。后者及其衍生物包含一个连接至甾体的芳磺酰酯基团,该基团模拟磷酸基,一边连接到酪氨酸基团,另一边连接DNA寡核苷酸。
构效关系研究表明,dephostatin与甲基-3,4-dephostatin的区别只是芳香环上一个羟基的位置不同,尽管甲基-3,4-dephostatin在亚微摩尔浓度下具有TdpⅠ抑制活性,但是dephostatin则表现出在相同浓度下几乎没有活性。同样,NSC88915及其5个衍生物在结构上只是芳香环对位取代基不同。这6个化合物之间的活性差异在10倍以内,但是其他不含芳香环的相关衍生物却完全没有活性。
随后便有研究者运用包括NSC88915及其衍生物在内的14个人类TdpⅠ抑制剂中的药效团特征作为筛选条件,对化学导航艾瑞图书馆(Chem Navigatori Research Library)中2 700万个可购买样品进行筛选。一共有46个化合物符合药效团特征的三维排列,图5列出了其中8个[25]。通过高通量筛选分析,鉴定出一个吲哚-3-乙酸衍生物作为潜在的TdpⅠ抑制剂,其IC50值为7.94μmol/L。
总之,这些结构及其衍生物表现出新的化学结构类型,并为研发更高活性的TdpⅠ抑制剂提供了骨架。
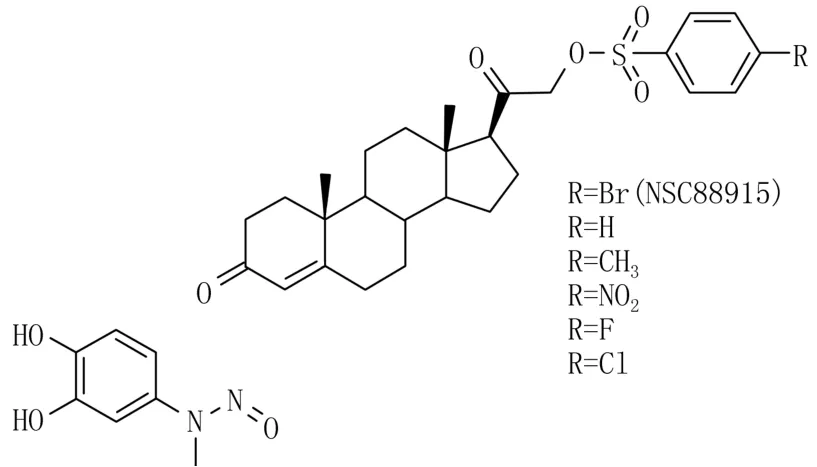
图4 甲基-3,4-dephostatin、NSC88915及其衍生物的结构图
5 JBIR-21
在一种变形的真菌(RF-I3305)培养中,发现了一个新化合物——JBIR-21(图6)[26]。该化合物不仅对TdpⅠ有抑制作用(IC50=18μmol/L),还对癌细胞株具有毒性作用(IC50=3.5~13μmol/L)。此外,JBIR-21在小鼠移植瘤模型中还显示出抗肿瘤活性,而且没有发现副作用。
6 首个TdpⅠ-TopⅠ双重抑制剂
上述介绍的抑制剂均是单靶标抑制剂,鉴于TopⅠ抑制剂的使用容易产生耐药性,设计合成出一个同时对TopⅠ和TdpⅠ具有双重抑制作用的化合物的设想,在一个多氨基双吲哚异喹啉分子(IC50=1.52±0.05μmol/L)上得以实现(图7)[27]。这也是目前已知的第一个具有TdpⅠ和TopⅠ双重抑制的分子,其中化合物145是目前已知活性最高的TdpⅠ抑制剂。但是,构效关系研究发现,对NSC88915活性至关重要的磺酰酯基团在该类分子上不起作用。对先导化合物的优化可以推导出以下结论:①质子化的氨基和TdpⅠ活性位点之间的电荷互补可能对高效能有用;②连接氨基和杂环之间的多亚甲基的疏水性对活性也有贡献。
这激动人心的结果具有以下重大意义:①吲哚异喹啉类分子证明了将TopⅠ和TdpⅠ抑制作用融合到一个小分子是可能的,并且是第一个证据;②这类化合物的独特结构特征赋予其巨大的操作空间,使得药动学的可调节性大于其他类TdpⅠ抑制剂;③为新的双重TopⅠ-TdpⅠ抑制剂提供了先导化合物;④促进了基于结构的药物设计方法。

图5 虚拟筛选得到的部分化合物结构图

图6 JBIR-21的结构图
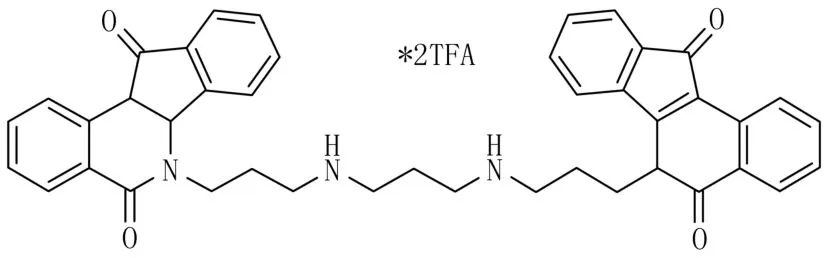
图7 多氨基双吲哚异喹啉的结构图
7 5-亚芳基硫代噻唑烷二酮类
Wang等[28]通过筛选一个自身的酪氨酸磷酸化抑制剂化合物库,找到化合物8(图8),并在此基础上发现了5-亚芳基硫代噻唑烷二酮类作为TdpⅠ抑制剂的全新骨架。经过构效关系(SAR)研究,发现其中化合物50(图8)对TdpⅠ的抑制活性达到亚微摩尔级(IC50=0.87μmol/L)。一些衍生物对全细胞提取物中的TdpⅠ存在抑制活性。这为TdpⅠ抑制提供了进一步的解释。

图8 化合物8和50的结构图
8 总结与展望
从TdpⅠ抑制剂的发展来看,其设计与合成经历了从盲目到合理,从单靶点到多靶点的过程。抑制活性逐步提高,有效浓度从当初的毫摩尔级提升到微摩尔级。毫无疑问,目前活性最高的属5-亚芳基硫代噻唑烷二酮类(IC50=0.87μmol/L)。
但是,这其中还存在很多不足,比如活性分子整体数量较少,且大部分化合物的活性不尽如人意。其发现存在很大的偶然性,没有形成较为系统的构效关系。当然这与TdpⅠ自身的底物不明确和作用机制尚了解不全存在密切关系。
[1] Wang JC.DNA topoisomerases[J].Annu Rev Biochem,1996,65:635-692.
[2] Pomm ier Y.Topoisomerase I inhibitors:camp tothecins and beyond[J].Nat Rev Cancer,2006,6(10):789-802.
[3] Cham poux JJ.DNA topoisomerases:structure,function,and mechanism[J].Annu Rev Biochem,2001,70:369-413.
[4] Pourquier P,Pomm ier Y.Topoisomerase I-mediated DNA damage[J].Adv Cancer Res,2001,80:189-216.
[5] Pourquier P,Pilon AA,Kohlhagen G,et al.Trapping of mammalian topoisomerase I and recombinations induced by damaged DNA containing nicks or gaps.Importance of DNA end phosphorylation and camptothecin effects[J].J Biol Chem,1997,272(42):26441-26447.
[6] Yang SW,Burgin AB,,Huizenga BN Jr,etal.A eukaryotic enzyme that can disjoin dead-end covalent complexes betw een DNA and type I topoisomerases[J].Proc Natl Acad Sci U S A,1996,93(21):11534-11539.
[7] Pouliot JJ,Yao KC,Robertson CA,et al.Yeast gene for a Ty r-DNA phosphodiesterase that repairs topoisomerase I complexes[J].Science,1999,286(5439):552-555.
[8] El-Kham isy SF,Saifi GM,Weinfeld M,et al.Defective DNA single-strand break repair in spinocerebellar ataxia w ith axonal neuropathy-1[J].Nature,2005,434(7029):108-113.
[9] Plo I,Liao ZY,Barcelo JM,et al.Association of XRCC1 and tyrosyl DNA phosphodiesterase(Tdp1)for the repair of topoisomerase I-mediated DNA lesions[J].DNA Repair(Am st),2003,2(10):1087-1100.
[10] W hitehouse CJ,Taylor RM,Thistlethw aite A,et al.XRCC1 stimulates human polynucleotide kinase activity at damaged DNA termini and accelerates DNA single-strand break repair[J].Cell,2001,104(1):107-117.
[11] Pomm ier Y,Redon C,Rao VA,et al.Repair of and checkpoint response to topoisomerase I-mediated DNA damage[J].Mutat Res,2003,532(1-2):173-203.
[12] Takashima H,Boerkoel CF,John J,et al.M utation of TDP1,encoding a topoisomerase I-dependent DNA damage repair enzyme,in spinocerebellar ataxia with axonal neuropathy[J].Nat Genet,2002,32(2):267-272.
[13] El-Khamisy SF,Katyal S,Patel P,et al.Synergistic decrease of DNA single-strand break repair rates in mouse neural cells lacking both Tdp1 and aprataxin[J].DNA Repair(Am st),2009,8(6):760-766.
[14] Das BB,Antony S,Gup ta S,et al.Optimal function of the DNA repair enzyme TDP1 requires its phosphorylation by ATM and/or DNA-PK[J].EMBO J,2009,28(23):3667-3680.
[15] Katyal S,el-Kham isy SF,Russell HR,et al.TDP1 facilitates chromosomal single-strand break repair in neurons and is neurop rotective in vivo[J].EMBO J,2007,26(22):4720-4731.
[16] Hirano R,Interthal H,Huang C,et al.Spinocerebellar ataxia w ith axonal neuropathy:consequence of a Tdp1 recessive neomorphic mutation?[J].EMBO J,2007,26(22):4732-4743.
[17] Barthelmes HU,Habermeyer M,Christensen MO,et al.TDP1 overexp ression in human cells counteracts DNA damagemediated by topoisomerases I and II[J].J Biol Chem,2004,279(53):55618-55625.
[18] Nivens MC,Felder T,Galloway AH,et al.Engineered resistance to camp tothecin and antifolates by retroviral coexpression of tyrosyl DNA phosphodiesterase-Iand thym idy late synthase[J].Cancer Chemother Pharmacol,2004,53(2):107-115.
[19] Pomm ier Y,Barcelo JM,Rao VA,et al.Repair of topoisomerase I-mediated DNA damage[J].Prog Nucleic Acid Res Mol Biol,2006,81:179-229.
[20] Dexheimer TS,Antony S,Marchand C,etal.Tyrosyl-DNA phosphodiesterase as a target for anticancer therapy[J].Anticancer Agents Med Chem,2008,8(4):381-389.
[21] Liao Z,Thibaut L,Jobson A,etal.Inhibition of human tyrosyl-DNA phosphodiesterase by aminoglycoside antibiotics and ribosome inhibitors[J].M ol Pharmacol,2006,70(1):366-372.
[22] Antony S,M archand C,Stephen AG,et al.Novel highthroughput electrochem ilum inescent assay for identification of human ty rosy l-DNA phosphodiesterase(Tdp1)inhibitors and characterization of furam idine(NSC 305831)as an inhibitor of Tdp1[J].Nucleic Acids Res,2007,35(13):4474-4484.
[23] Marchand C,Lea WA,Jadhav A,et al.Identification of phosphoty rosine m imetic inhibitors of human ty rosy l-DNA phosphodiesterase I by a novel A lphaScreen high-throughput assay[J].Mol Cancer Ther,2009,8(1):240-248.
[24] Dexheimer TS,Gediya LK,Stephen AG,et al.4-Pregnen-21-ol-3,20-dione-21-(4-bromobenzenesulfonate)(NSC 88915)and related novel steroid derivatives as tyrosyl-DNA phosphodiesterase(Tdp1)inhibitors[J].JM ed Chem,2009,52(22):7122-7131.
[25] Weidlich IE,Dexheimer T,M archand C,et al.Inhibitors of human tyrosyl-DNA phospodiesterase(hTdp1)developed by virtual screening using ligand-based pharmacophores[J].Bioorg Med Chem,2010,18(1):182-189.
[26] Takagi M,Ueda JY,Hwang JH,et al.Ty rosyl-DNA phosphodiesterase 1 inhibitor from an anamorphic fungus[J].J Nat Prod,2012,75(4):764-767.
[27] Nguyen TX,M orrell A,Conda-Sheridan M,et al.Synthesis and biological evaluation of the first dual tyrosyl-DNA phosphodiesterase I(Tdp1)-topoisomerase I(Top1)inhibitors[J].JMed Chem,2012,55(9):4457-4478.
[28] Sirivolu VR,Vernekar SK,Marchand C,etal.5-A rylidenethioxothiazolidinones as inhibitors of tyrosyl-DNA phosphodiesterase I[J].JM ed Chem,2012,55(20):8671-8684.
Recent advances of tyrosyl-DNA phosdiesteraseⅠ(TdpⅠ)inhibitors
HUANG Yahui,DONG Guoqiang,ZHANGWannian,SHENG Chunquan(School of Pharmacy,Second M ilitary Medical University,Shanghai200433,China)
Tyrosyl-DNA phosphodiesteraseⅠ(TdpⅠ)is a recently discovered proteinthat catalyzes the hydrolysis of 3′-phosphotyrosyl bonds.Such linkages form in vivo during the interaction of DNA and topoisomeraseⅠ(TopⅠ).TdpⅠhas been regarded as a potential therapeutic co-targetof TopⅠbecause ithas the functions of repairing TopⅠcompound and counteracting the effects of TopⅠinhibitors.TdpⅠinhibitors can not only synergizing w ith TopⅠ-targeting drugs(camptothecins),but also strength the function of bleomycin,topoisomeraseⅡ(TopⅡ)inhibitors(etoposide,doxorubicin)and DNA alkylating agents.We summarized the researching advance of TdpⅠinhibitors and focused on the introduction of themechanism,bioactivity and structure-activity relationship.
tyrosyl-DNA phosphodiesteraseⅠ(TdpⅠ);topoisomeraseⅠ(TopⅠ);anti-tumor inhibitors;structure and activity relationship
R979.1
A
1006-0111(2015)04-0298-05
10.3969/j.issn.1006-0111.2015.04.003
2014-07-14
2014-10-27[本文编辑]李睿旻
国家优秀青年科学基金(No.81222044)
黄亚辉,硕士研究生.Tel:18521509547;E-mail:xiaohnhyh@163.com
盛春泉,教授,博士生导师.研究方向:抗感染和抗肿瘤药物化学研究.Tel:(021)81871239;E-mail:shengcq@hotmail.com
