群体药动学应用于个体化给药的研究进展
2015-05-15同济大学附属杨浦医院药剂科上海200433
林 艳(同济大学附属杨浦医院药剂科,上海 200433)
・综述・
群体药动学应用于个体化给药的研究进展
林 艳(同济大学附属杨浦医院药剂科,上海 200433)
群体药动学运用经典的药动学原理结合统计学方法,以稀疏数据预测患者血药浓度,可达到监测药物体内过程和指导临床个性化给药的目的。查阅近年来的相关文献,结合实例综述群体药动学应用于治疗窗窄的药物、个体差异大的药物、联合用药、特殊人群用药等方面的最新进展,为其深入研究和指导临床用药提供参考。
群体药动学;个体化给药;非线性混合效应模型;Bayesian反馈法
群体药动学(population pharmacokinetics,PPK)以群体为单位进行药动学分析,注重于定量考察影响患者群体中药物浓度或药效的因素[1],结合不同的计算方法较准确地估算出个体参数,优化给药方案,使临床给药方案更方便、合理、有效,从而提高疗效,减少不良反应[2],在临床个体化给药中具有广泛应用。本文简要介绍群体药动学模型的建立、验证及对个体参数的预测,并结合实例总结其在个体化给药方面的最新应用。
1 群体药动学用于个体化给药的基本流程
与普通药动学原理相似,群体药动学也是通过建立动力学模型,以非线性拟合的方法寻找出一组参数,以使模型求出的拟合值与实际得到的观测值之间的偏差最小[3]。因此,群体药动学在个体化给药中的基本流程分为三步:模型的建立和优化,模型的验证,以及对个体参数的预测。
1.1 模型的建立和优化 群体药动学研究中的数据信息庞大,对这些数据的准确把握和处理对模型的建立和优化至关重要。
群体药动学的研究方法可分为参数法和非参数法(nonparametric approaching,NP)[4],参数法求解药动学参数时要求未知参数的概率符合正态分布或对数正态分布,而NP则没有这些限制。但NP的算法复杂,用于实践仍有问题,只有较少的研究应用[5,6]。
参数法包括单纯聚集法(naive pool data,NPD)、二步法(two stagemethod,TS)和非线性混合效应模型(nonlinear m ixed effectmodel,NLME或NONMEM)。其中,前两者属于传统的药动学研究方法,存在诸多缺点而较少应用[7]。NONMEM是一种基于群体的数据分析方法,可以一步完成二步法的工作。它能区分考察因素引起的变异和操作方法引起的变异,可以在样本数据较少或缺失的情况下进行分析,还能同时处理不同群体、不同个体、不同时间采集的数据[8]。该方法考虑了误差的多种来源,定量考察患者生理、病理等因素对药动学参数的影响,为实施个体化给药提供了重要参考。
当然,NONMEM也有不足之处。与传统药动学研究方法相比,它对计算的要求较高[8]。同时,作为一种参数法,它要求对模型参数的分布提出假设,如果假设错误,那么建立的模型也将是错误的[9]。因此,在建立并优化了群体药动学模型后,还要对该模型进行验证。
1.2 模型的验证 根据验证数据来源的不同,可将模型的验证分为内部验证和外部验证[10]。内部验证的数据来自构建模型的数据,而外部验证的数据则来自未使用在模型构建中的数据。一般而言,模型要先具有内部有效性后才能外推。
模型验证方法的选择因研究目的而异,目前并没有公认通用的模型验证方法[3]。所谓的“最佳模型”或“最终模型”并非是绝对的,而是取决于研究目的[11]。但经验证后得到的最终模型应当稳定,模型参数不依赖于对象群体的构成,由不同群体得出的参数差异较小,无显著性差异。
1.3 个体参数的预测 通过群体药动学建立的模型来预测个体的药动学参数,是群体药动学在个体化给药中应用的主要方式,最常用的参数处理方法是Bayesian反馈法。这种方法的关键是将未知的参数定义为随机变量,而不是像一般方法那样定义为未知的固定值,同时使有关参数的先验理论在后验分布中不断更新[12]。它结合群体参数和患者个体特征,以患者的少量药动学数据作为反馈,求出个体的药动学参数及模型[7]。最后根据求得的药动学参数不断调整、优化患者的给药方案,使患者的血药浓度保持在良好水平,从而实现个体化给药。
2 群体药动学指导的个体化给药最新应用
群体药动学使得根据不同患者的药动学参数调整个体化给药方案成为可能[9]。使用群体药动学的研究方法,患者取样点少,可定量考察生理、病理等因素对药动学参数的影响,同时可获得群体中具有显著意义的个体间变异和残差变异,从而便于获得患者的药动学参数,故在个体化给药中应用广泛。
2.1 治疗窗窄的药物的个体化给药 有些药物毒性较大、治疗窗较窄,如免疫抑制剂、抗肿瘤药物等,当药物剂量过低时不能达到治疗效果,而剂量过高又会引起严重的毒副作用。因此,应用这些药物时需采用临床治疗药物监测(therapeutic drug monitoring,TDM)来测定血药浓度,而采用群体药动学的方法来估算药动学参数以调整给药方案则颇为有效(图1)。该模型的预测准确性较高,可估算个体的给药剂量,为个体化给药提供参考。

图1 条件权重残差(CWRES)与平均群体预测浓度(A)、观测浓度(B)的关系
他克莫司是一种强效的神经钙蛋白抑制剂,广泛应用于防止同种异体器官移植患者的排异反应。由于他克莫司的治疗窗窄且在药动学和药效学上存在明显的个体差异,在治疗过程中难以达到理想的有效血药浓度[13]。为了研究影响他克莫司药动学特性的因素,Golubovic等[14]收集了105名处于三联免疫抑制疗法的肾移植患者不同时期的血液样品,测定血药浓度,采用NONMEM法分析数据。研究发现,他克莫司药动学特性符合一室模型,一级吸收和消除,患者的体重、血细胞比容、天冬氨酸氨基转移酶、移植后的时间、血浆总蛋白含量均能影响他克莫司的清除率。他克莫司的清除率在移植后的15 d、1个月和6个月时分别下降了4.4%、6.3%和10.92%,这可能是由术后血细胞比容增加引起的。同时,该研究首次定量研究了血浆总蛋白含量对他克莫司清除率的影响。最终模型表示为:

CL/F:他克莫司清除率;PDAY:移植后时间;WT:体重;TP:血浆总蛋白;AST:天冬氨酸氨基转移酶;HCT:血细胞比容。
2.2 个体差异大的药物的个体化给药 患病人群的基因多态性和病原微生物的不同敏感性增加了一些药物运用的复杂性,如一些抗生素、麻醉药等,临床上一般都是凭经验用药。这样的给药方案不一定适合每例患者,个体生理、病理情况的差异使药物的蓄积程度不同,从而导致临床药效的差异。因此,利用群体药动学的方法考察影响该类药物动力学的因素具有重要意义。
咪达唑仑是一种较常见的镇静剂,进入体内后主要被肝药酶CYP3A代谢。由于患者的基因多态性,咪达唑仑的清除率有很大的个体差异。因此,Seng等[15]测定了24例癌症患者的咪达唑仑药动学数据,并运用NONMEM法研究影响咪达唑仑药动学特性的因素,重点考察CYP3A表型的影响。研究开始前1 d,患者静脉推注1 mg咪达唑仑来判断CYP3A的表型,然后在给药过程中测量咪达唑仑及其代谢物的浓度。研究发现,咪达唑仑符合二室模型,CYP3A5*3的表达量显著影响咪达唑仑的清除率,表达CYP3A5*3的患者体内咪达唑仑清除率比未表达的高11.5%(图2A)。另外,咪达唑仑的清除率与患者的总胆红素呈负相关(图2B)。而对于咪达唑仑的代谢产物来说,体重和肌酐清除率也是影响药动学的因素。因此,在临床上设计咪达唑仑的给药方案时,需要考虑患者体重、肌酐清除率、CYP3A表型、总胆红素等多个因素。

图2 咪达唑仑清除率与CYP3A5*3基因型(A)、总胆红素(B)的关系
万古霉素是一种糖肽类抗生素,临床上作为青霉素的替换药物已经使用了近50年,用于治疗产生青霉素酶的金黄色葡萄球菌感染。万古霉素的药动学参数受多种因素影响[16],同时,万古霉素敏感的介质和万古霉素耐药病原体的出现增加了万古霉素应用的复杂性。临床上,万古霉素一般是根据经验用药,导致不同个体药效不同,易引起不良反应甚至毒副作用,所以必须对万古霉素进行个体化给药和血药浓度监测。
翁芳娟[17]通过监测103例被诊断为G+菌感染患者的血清浓度,以NONMEM法建立了万古霉素的群体药动学模型。研究发现,万古霉素的清除率CL(L/h)与肌酐清除率CLcr(m l/min)呈线性关系:CL=0.044×CLcr;同时,中央室的表观分布容积V1(L)与年龄呈线性相关:V1=0.542×年龄。该模型具有良好的稳定性和预测效能,能够为万古霉素个体化给药方案提供参考。
2.3 联合用药的个体化给药 有些药物虽然具有较明确的药动学参数,但在与其他药物联合运用时,药动学特性会发生改变。在个体化给药方案的设计中,药物之间的相互作用也应当是一个考虑因素。运用群体药动学的方法研究联合给药对药物体内动力学的影响是个体化给药的途径之一。
托吡酯是一种广谱的抗癫痫药,广泛用于成人或儿童的癫痫单一治疗或辅助治疗。60%~70%的托吡酯以原形通过肾脏排泄,部分口服的托吡酯由肝药酶代谢。尽管代谢该药物的药酶亚型还未确定,但肝药酶诱导剂如卡马西平、苯妥英钠等均会对托吡酯的药动学特性产生明显影响[18]。Jovanovic等[19]收集了78名成年癫痫患者的数据,利用NONMEM法构建了群体药动学模型。研究发现,在卡马西平联合治疗的患者中,口服托吡酯的清除率随卡马西平剂量的增加而呈线性增加(图3)。此外,肾脏功能也对托吡酯的清除率有显著影响。经过优化后得到的最终模型为:
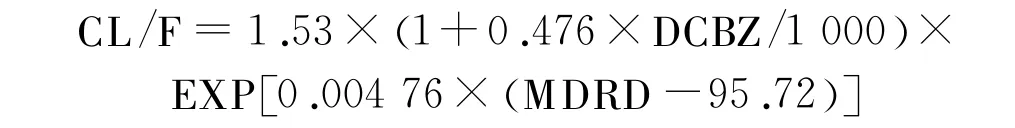
CL/F:托吡酯清除率(L/h);DCBZ:卡马西平每日剂量(mg/d);MDRD:由简化肾脏病膳食改良公式估算的肾功能参数(m l/min)。
该模型能够较好地预测患者体内托吡酯的药动学特性(图4),对托吡酯的个体化给药,尤其是与卡马西平联用的患者的个体化给药有重要参考价值。

图3 口服托吡酯的清除率与卡马西平剂量的关系

图4 直观预测检验法验证最终模型
2.4 特殊人群的个体化给药 同种药物在不同人群中有不同的药动学特性,如儿童和老年人的肝肾功能不如成年人完善,会影响药物的消除;而某些病理条件也会改变药物的体内处置特性。在对特殊人群用药时,应力求设计个体化给药方案。
群体药动学因其取样点少的优点,使得在儿科中建立群体药动学模型成为可能。Marsot等[20]查阅了1985-2010年间用群体药动学研究2岁以下新生儿的文献,综述了30年来群体药动学在新生儿中的应用进展。该综述指出,新生儿的胃肠道pH值与成年人不同,体内水分含量较多,使得亲水性药物的表观分布容积增大;同时,新生儿的肝药酶活性和肾清除率也与成年人有差异。这些因素使得药物在新生儿中的吸收、分布、代谢和排泄均异于成年人。在对这些新生儿的研究中,绝大多数采用了NONMEM研究方法,研究的药物主要为抗生素、麻醉药和抗惊厥药等,考察的变异因素前3位分别为体重、年龄和肾功能。群体药动学在儿科中研究的增加与深入加速了儿童个体化给药的实现。
某些病理条件下,药物的体内动力学特性也会改变。如前文提到的万古霉素,在普通患者中,年龄与肌酐清除率均是影响其药动学特性的因素,但在肾替代疗法的感染患者中,并未发现这些因素的影响[21]。在烧伤患者中,机体产生应激反应,神经内分泌活性增强而导致高代谢状态,此时机体对药物的处置也会产生变化,一般每8 h给予2 g头孢他啶的给药方案在烧伤患者身上并不适用[22]。Conil等[23]用NONMEM法研究了70例高代谢期烧伤患者的头孢他啶使用情况,发现头孢他啶符合开放性二室模型,一级消除,年龄和血清肌酐均能对头孢他啶的体内药动学特性产生影响(图5)。根据需要达到的稳态血药浓度的不同,Conil等为不同患者设计了针对性的给药方案,以实现头孢他啶对烧伤患者的个体化给药。

图5 50岁患者给予2 g头孢他啶后不同维持剂量与不同血清肌酐时达到目标稳态血药浓度(Css)的百分数
2.5 中成药的个体化给药 中药研究是我国的优势领域,将传统中药制成现代制剂使得中药的应用更加方便。由于中成药多为复方,组分复杂而具有多靶点,因而缺乏药动学研究的支持[24],临床用药时只能凭借实践经验设计给药方案。王清等[25]采用NONMEM法,选择稳定型心绞痛患者作为研究对象,研究参麦注射液在该患者群中的群体药动学。该研究选取了72例未见严重原发性疾病的稳定型心绞痛患者(符合中医胸痹心痛、气阴两虚证型者,西医诊断为劳累性稳定型心绞痛),每日静脉滴注参麦注射液,采血后用LC-MS分析血中代表性有效成分的含量,分析对参麦注射液药动学产生影响的因素,构建群体药动学模型。结果显示,参麦注射液符合二室模型,是否吸烟(SMK)和单位体重给药剂量对参麦注射液的清除率有显著影响。其中,吸烟对清除率产生显著负相关影响,这提示冠心病患者长期吸烟可能对参麦注射液主要药效物质组的代谢或排泄产生抑制作用,最终回归模型为:

CL:参麦注射液主要药效物质组清除率。
对该模型进行验证,发现最终回归模型优于药动学基础模型,且能通过Bayesian反馈法,较为有效地预测个体药动学参数,为设计临床给药方案提供依据。
2.6 更改剂型时的个体化给药 环孢素A是肾脏移植中广泛运用的免疫抑制剂之一,然而,环孢素传统制剂的吸收特性具有明显的个体差异。有研究报道[26],一种环孢素的微乳制剂Neoral(MEPC)可以减少个体差异。但是这种新的剂型缺乏药动学数据。因此,Yoshida等[27]采用NONMEM法,对69例肾移植患者口服传统剂型环孢素和MEPC的药动学进行研究,测定其群体药动学参数并进行对比。环孢素在体内的过程符合二室模型,两种剂型的相对生物利用度差别不大,传统剂型为1,MEPC为1.05。但在吸收相时,传统剂型有明显的滞后时间,其个体间差异为18.2,而MEPC的个体间差异为16.0。另外,MEPC的药物平均谷浓度(94.4μg/L)显著低于传统剂型(102.6μg/L)。仅仅剂型的改变对药物体内药动学特性的改变并不是大范围的,通过群体药动学的研究方法对比改变剂型后某些参数的变化能帮助我们迅速、准确地调整给药方案。
3 总结与展望
群体药动学在个体化给药中的运用优于将血药浓度的测定结果与治疗范围简单比较的方法。后者只将测定结果与公开报道的范围比较,判断在范围内还是在范围外,这种简单处理通常是不可靠的。而群体药动学不测定血药浓度,通过公开报道的公式直接推导血药浓度甚至药效,将更为简捷、及时、方便、有效。这种方法既极大地减轻患者的取血痛苦,节省大量的人力、物力,又为临床治疗赢得宝贵的治疗时间,提高治疗效果。目前,国外一些临床实验室已采用此法,但该方法必须建立在有可靠的群体药动学模型基础上。
考虑到一些药物的效应不完全与血药浓度成正相关,应用群体药动学方法进行药动学-药效学结合(PK-PD)的研究已成为目前临床发展的方向之一。将PK和PD数据结合起来加以模型化分析,便可由PD分析测出在靶部位引起所需治疗作用的药物浓度,而由PK分析则可测知为了保证靶部位达到所需药物浓度的剂量方案[2],对临床用药更具指导意义。Yue等[28]在腹膜透析患者中建立了利尿药乙酰唑胺的群体PK-PD模型,通过血药浓度和眼内压分别研究其药动学和药效学特性。此外,Lal等[29]采用NONMEM法建立抗癫痫药加巴喷汀酯的PK-PD模型,不仅研究了加巴喷汀酯的药动学及药效学特性,还对其产生的不良反应进行研究。以上研究虽尚未应用于临床,但为群体PK-PD模型用于临床个体化给药方案的设计提供了思路。
通过群体药动学估计的个体药动学参数与实际参数可能仍存有误差,因此,临床上还是要采用TDM实时观察患者的血药浓度。群体药动学的发展为TDM的发展提供了条件,分析方法的改进使得TDM方便、准确、快捷,使结果更加全面可靠,符合临床实际。随着群体药动学研究的深入,人们对药物体内特性的了解也将提高,从而进一步提高个体化给药水平。
[1] 倪天庆,胡思源,司端运,等.中药儿童群体药动学试验设计要点[J].中草药,2013,44(021):3089-3091.
[2] 张 弨,翟所迪.群体药动学在治序药物监测中的应用[J].临床药物治疗杂志,2006,4(1):45-50.
[3] 蒋新国.生物药剂学与药物动力学[M].北京:高等教育出版社,2009:538-540.
[4] Tatarinova T,Neely M,Bartroff J,etal.Two generalmethods for population pharmacokinetic modeling:non-parametric adaptive grid and non-parametric Bayesian[J].JPharmacokinet Pharmacodyn,2013,40(2):189-199.
[5] Wakefield J,Walker S.Bayesian nonparametric population models:formulation and comparison with likelihood approaches[J].JPharmacokinet Biopharm,1997,25(2):235-253.
[6] Rosner GL,Muller P.Bayesian population pharmacokinetic and pharmacodynam ic analyses using m ix ture models[J].J Pharmacokinet Biopharm,1997,25(2):209-233.
[7] 林翠鸿,王长连,柯 蒙.群体药动学及其在个体化给药中的应用[J].中国临床药学杂志,2005,14(01):58-60.
[8] Schaeftlein A,Minichmayr IK,Kloft C.Population pharmacokineticsmeetsm icrodialysis:benefits,pitfalls and necessities of new analysis approaches for human microdialysis data[J].Eur JPharm Sci,2014,57:68-73.
[9] Jelliffe RW.Some comments and suggestions concerning population pharmacokinetic modeling,especially of digoxin,and its relation to clinical therapy[J].Ther Drug Monit,2012,34(4):368-371.
[10] 胡 敏,张静华,孙 鹤,等.群体药动学原理及NONMEM法数据分析[J].药学服务与研究,2002,2(4):227-230.
[11] Sherw in CM,Kiang TK,SpigarelliMG,etal.Fundamentals of population pharmacokinetic modelling:validation methods[J].Clin Pharmacokinet,2012,51(9):573-590.
[12] K rauss M,Burghaus R,Lippert JOR,etal.Using Bayesian-PBPK modeling for assessment of inter-individual variability and subgroup stratification[J].In Silico Pharmacology,2013,1(1):1-11.
[13] Staatz CE,Tett SE.Clinical pharmacokinetics and pharmacodynam ics of tacrolimus in solid organ transplantation[J].Clin Pharmacokinet,2004,43(10):623-653.
[14] Golubovic B,Vucicevic K,Radivojevic D,et al.Total p lasma protein effect on tacrolimus elim ination in kidney transplant patients—population pharmacokinetic app roach[J].Eur JPharm Sci,2013,52:34-40.
[15] Seng KY,Hee KH,Soon GH,etal.CYP3A5*3 and bilirubin predict m idazolam population pharmacokinetics in Asian cancer patients[J].JClin Pharmacol,2014,54(2):215-224.[16] Yamamoto M,Kuzuya T,Baba H,et al.Population pharmacokinetic analysis of vancomycin in patientsw ith gram-positive infections and the influence of infectious disease type[J].JClin Pharm Ther,2009,34(4):473-483.
[17] 翁芳娟.万古霉素的群体药动学研究[J].海峡药学,2013,25(7):207-209.
[18] N PP,D BBF.The epilepsy prescriber's guide to antiepilep tic d rugs[M].Oxford:Cambridge University Press,2010.
[19] Jovanovic M,Sokic D,Grabnar I,etal.Population pharmacokinetics of topiramate in adult patients w ith epilepsy using nonlinearm ixed effectsmodelling[J].Eur JPharm Sci,2013,50(3-4):282-289.
[20] Marsot A,Boulamery A,Bruguerolle B,et al.Population pharmacokinetic analysis during the first 2 years of life:an overview[J].Clin Pharmacokinet,2012,51(12):787-798.
[21] Udy AA,Covajes C,Taccone FS,et al.Can population pharmacokinetic modelling guide vancomycin dosing during continuous renal replacement therapy in critically ill patients?[J].Int JAntim icrob Agents,2013,41(6):564-568.
[22] Conil JM,Georges B,Fourcade O,et al.Interm ittent administration of ceftazidime to burns patients:influence of glomerular filtration[J].Int J Clin Pharmacol Ther,2007,45(3):133-142.
[23] Conil JM,Georges B,Ravat F,et al.Ceftazidime dosage recommendations in burn patients:from a population pharmacokinetic approach to clinical practice via Monte Carlo simulations[J].Clin Ther,2013,35(10):1603-1612.
[24] 柳晓泉,陈渊成,郝 琨,等.药动学一药效学结合模型的研究进展及在新药研发中的应用[J].中国药科大学学报,2007,38(6):481-488.
[25] 王 清,朱萱萱,周 杰,等.参麦注射液在心肌缺血患者体内的群体药动学研究[J].中华中医药学刊,2013,31(12):2702-2705.
[26] Levy GA.C2 monitoring strategy for optim ising cyclosporin immunosuppression from the neoral formulation[J].Biod rugs,2001,15(5):279-290.
[27] Yoshida K,Kimura T,Hamada Y,etal.Comparative study of population pharmacokinetics upon switching of cyclosporine formulation from sandimmune to neoral in stable renal transplant patients[J].Transplant P,2001,33(7):3146-3147.
[28] Yue CS,Huynh HH,Raymond C,et al.Population pharmacokinetic and pharmacodynamic modeling of acetazolamide in peritoneal dialysis patients and healthy volunteers[J].J Pharm Pharm Sci,2013,16(1):89-98.
[29] Lal R,Sukbuntherng J,LuoW,etal.Population pharmacokinetics and pharmacodynam ics of gabapentin after adm inistration of gabapentin enacarbil[J].J Clin Pharmacol,2013,53(1):29-40.
Research progressof population pharmacokineticsapplying to individualizedmedication
LIN Yan(Department of Pharmacy,Yangpu Hospital affiliated to Tongji University,Shanghai200433,China)
Combining the classic pharmacokinetic principles and statisticalmethods,population pharmacokinetics(PPK)can predict individual pharmacokinetic parameters accurately w ith sparse data in patients,which may be used for monitoring drug concentration in patients and realizing individual dose regimen.In this article,we review the recent application of PPK in drugsw ith narrow therapeuticwindows or great individual differences,combiningmedication,medication in special populations and so on,providing useful information for further investigation of PPK and its application in clinicalmedication.
population pharmacokinetics;individual dose regimen;nonlinearmixed effectmodel;Bayesian forecasting
R96
A
1006-0111(2015)04-0293-06
10.3969/j.issn.1006-0111.2015.04.002
2014-07-18
2015-03-14[本文编辑]李睿旻
林 艳,本科,药师.研究方向:临床用药及药动学.Tel:18964322358;E-mail:lyyph2000@126.com
