应用高效液相色谱法测定猫人参中积雪草酸的含量
2015-05-15张国庆第二军医大学附属东方肝胆外科医院药材科上海200438
吕 昉,周 瑾,费 扬,陈 雨,张国庆,赵 亮(第二军医大学附属东方肝胆外科医院药材科,上海 200438)
・研究报告・
应用高效液相色谱法测定猫人参中积雪草酸的含量
吕 昉,周 瑾,费 扬,陈 雨,张国庆,赵 亮(第二军医大学附属东方肝胆外科医院药材科,上海 200438)
目的建立猫人参药材中积雪草酸的含量测定方法。方法采用高效液相色谱法,色谱柱为Agilent HC-C18柱(4.6 mm×250mm,5.0μm),流动相为乙腈(30 mmol/L)-醋酸铵水溶液(35∶65),流速1.0 m l/min,柱温25℃,紫外检测波长210 nm,进样量25μl,运行时间35 min。结果积雪草酸与周围干扰峰达到基线分离,线性范围25.3~506.0μg/m l,r=0.999 6;日内及日间精密度均<3%(n=5),平均回收率为99.4%(RSD=1.9%,n=6),猫人参中积雪草酸的含量为0.751 mg/g。结论该法简便快捷、测定结果准确、实用性强,可用于猫人参药材中积雪草酸的含量测定。
猫人参;积雪草酸;含量测定;高效液相色谱法
猫人参为猕猴桃科植物镊合猕猴桃(Actinidia valvata Dunn)的根,具有清热解毒、消肿疖的功效,主要用于治疗骨髓炎、疮疡脓肿、肝硬化、黄疸、腹水、消化系统肿瘤等[1]。药理学研究表明,猫人参提取液具有良好的抗肝癌作用[2,3],对猫人参药材化学成分的研究表明其含有积雪草酸[4,5]。积雪草酸是乌苏烷型五环三萜酸,具有抑制肝癌细胞增生、保肝及诱导肿瘤细胞凋亡等多种作用[6-9]。目前针对猫人参药材的质量控制方法鲜有报道,而积雪草酸的含量测定方法文献报道也较少[10]。为了对猫人参药材进行质量控制,保障临床用药安全有效,本研究以积雪草酸为对象,采用高效液相色谱(HPLC)法对猫人参中的积雪草酸进行含量测定。
1 仪器与试药
Agilent-1100系列HPLC仪(美国安捷伦公司),包括G1379A真空脱气机、G1311A四元泵、G1367A自动进样器、G1316A柱温箱和G1315A单波长紫外检测器;AE240型十万分之一电子天平(瑞士梅特勒公司)。
猫人参药材饮片(产地:安徽,批号:120503、100901;产地:湖南,批号:130601),经第二军医大学生药学教研室孙连娜副教授鉴定为猕猴桃科植物镊合猕猴桃的根;对照品积雪草酸购自成都思曼特生物科技有限公司(纯度≥98.0%),醋酸铵为分析纯(上海国药集团),甲醇为色谱纯(美国Honeywell),水为超纯水。
2 方法与结果
2.1 色谱条件 色谱柱Agilent HC-C18柱(4.6 mm×250 mm,5.0μm),流动相:乙腈(30 mmol/L)-醋酸铵(35∶65);流速1.0 m l/min,柱温25℃,紫外检测波长210 nm,进样量25μl,运行时间35 m in。
2.2 供试品溶液的制备 取猫人参药材饮片适量,置粉碎机中打碎,过60目筛,取粉末约1 g,精密称定,置50 m l锥形瓶中,加入甲醇20 m l,超声提取60 min,过滤,收集滤液;置水浴(90℃)浓缩甲醇至约5 m l,转移至10 m l量瓶中,用甲醇定容至刻度,混匀,用0.45μm有机滤膜滤过,取续滤液,即得供试品溶液。
2.3 对照品储备液的配制 精密称取积雪草酸对照品10.12 mg,置10 m l量瓶中,加入甲醇溶解并定容至刻度,得积雪草酸浓度为1.012 mg/m l的对照品储备液。
2.4 方法学考察
2.4.1系统适应性 取积雪草酸对照品溶液,按照“2.1”项下色谱条件进样25μl,结果见图1。积雪草酸保留时间约为27.5 m in,峰形对称,理论塔板数>8 000,与周围干扰峰分离度均>1.5。
2.4.2线性关系 按逐级稀释法,精密量取积雪草酸对照品储备液适量,置5 m l量瓶中,用甲醇定容至刻度,得浓度分别为506.0、253.0、101.2、50.6、25.3μg/m l的系列对照品溶液,按上述色谱条件进样分析,以浓度为横坐标(X),色谱峰面积为纵坐标(Y)进行线性回归,得积雪草酸回归方程:Y=7.436 3 X+2.631 9,r=0.999 6,线性范围25.3~506.0μg/m l。
2.4.3 精密度实验 取积雪草酸低(25.3μg/m l)、中(101.2μg/m l)、高(506.0μg/m l)3个浓度的对照品溶液,按上述色谱条件进样,在1 d内分别进样5次,以及连续3 d每天分别进样2次,考察日内、日间精密度。积雪草酸在低、中、高浓度的日内精密度分别为1.8%、2.2%、0.9%,日间精密度分别为2.3%、2.1%、0.9%,均<3%,表明此法精密度良好。
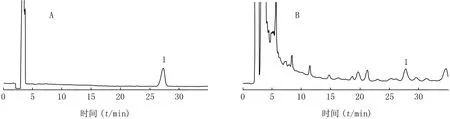
图1 猫人参提取物HPLC图
2.4.4 重复性实验 取猫人参样品(批号:120503)粉末约1 g,精密称定,按“2.2”项下方法制备供试品溶液,平行操作6份,按“2.1”项下色谱条件进样分析,计算积雪草酸的含量,积雪草酸含量RSD=2.6%,表明此法重复性良好。
2.4.5 回收率实验 取猫人参样品(批号:120503)粉末约0.5 g,精密称定,置50 m l锥形瓶中,再加入新配制浓度为1.010 mg/m l的积雪草酸对照品溶液0.4 m l,按“2.2”项下方法制备供试品溶液,平行操作6份,按“2.1”项下色谱条件进样分析,测定含量。积雪草酸的平均加样回收率为101.8%,RSD=1.6%,符合对准确度的要求。
2.4.6 检测限及定量限 取浓度为25.3μg/m l积雪草酸的对照品溶液进样分析,以信噪比为10∶1确定其最低定量限,积雪草酸的最低定量限为25.3μg/m l;将此溶液稀释后进样,以信噪比为3∶1确定其最低检测限,积雪草酸的最低检测限为12.65μg/m l。
2.4.7 稳定性考察 取猫人参样品(批号:120503)粉末约1 g,精密称定,置50 m l锥形瓶中,按“2.2”项下制备供试品溶液,放入进样器样品盘中,分别于0、1、2、4、6、8 h按“2.1”项下色谱条件进样分析,代入标准曲线计算积雪草酸的浓度,计算RSD=2.9%,表明样品溶液在8 h内保持稳定。
2.5 含量测定 取不同批次猫人参药材饮片,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,测定积雪草酸的含量,结果见表1。
3 讨论
3.1 检测波长的选择 由于积雪草酸在紫外检测器上为末端吸收,且吸收较弱,采用210 nm作为检测波长能够降低背景噪音,使积雪草酸达到最好的信噪比,若波长<210 nm则会因为背景吸收太强而导致色谱图在积雪草酸保留时间处出现倒峰。

表1 猫人参中积雪草酸的含量测定结果
3.2 流动相的考察 由于甲醇在210 nm处有紫外吸收,采用含甲醇系统的流动相时,积雪草酸的吸收峰被流动相背景吸收掩盖,故采用乙腈-水系统考察,发现积雪草酸的峰形前延严重、对称性较差。在水相中加入醋酸铵能够改善峰形,考察了浓度为10、20及30 mmol/L醋酸铵时的色谱峰对称性,发现醋酸铵浓度为30 mmol/L时积雪草酸色谱峰形对称,达到定量分析的要求,同时对流动相比例进行了优化,使之与干扰峰达到基线分离。
3.3 色谱柱的考察 猫人参中成分复杂,为达到定量分析的要求,需要对积雪草酸及干扰峰进行完全分离。考察了不同类型填料色谱柱对积雪草酸与杂质分离的影响,如Chromasil-C18、Waters RP-C18、Agilent XDB-C18、SB-C18、Plus C18及HC-C18柱,发现在Agilent HC-C18(4.6 mm×250 mm,5.0μm)色谱柱上,积雪草酸色谱峰与周围峰的分离度良好、保留时间合适,且峰形对称,符合本研究要求。
3.4 前处理方法的考察 为能简便、快速地从猫人参药材中提取积雪草酸,将药材饮片粉碎后采用甲醇超声提取,设计三因素、三水平正交试验,考察提取溶剂体积(10、20、30倍量)、超声时间(20、40、60 min)及超声次数(1、2、3次)对积雪草酸提取结果的影响,结果表明,影响积雪草酸提取效率的因素顺序为溶剂倍数>提取时间>提取次数,最终确定样品前处理方法为20倍量甲醇超声60 min提取1次。
本研究建立了HPLC法测定猫人参中积雪草酸含量的方法,通过对检测波长、色谱柱及流动相组成等条件的摸索,确定最优色谱条件;同时采用正交试验优化得到猫人参中积雪草酸的提取方法。此法前处理条件简便快速,测定结果准确可靠,重复性好,实用性强,可用于对猫人参药材中积雪草酸的含量测定及质量控制。
[1] 叶 春.猫人参的研究概述与利用[J].中国药业,2011,2(6):68.
[2] 万旭英,张亚妮,张 晨.猫人参注射液体外抗肝癌实验研究[J].浙江中医学院学报,2004,28(2):45-47.
[3] 万旭英,张 晨,凌昌全,等.猫人参注射液抗肝癌作用和对免疫功能的影响[J].浙江中医学院学报,2004,28(4):56-59.
[4] 徐一新,项昭保,陈晓晶,等.中药猫人参中的抗肿瘤活性成分[J].第二军医大学学报,2011,32(7):749-753.
[5] 吕 昉,赵 亮,郑 磊,等.HPLC-TOF/MS对中药猫人参化学成分的快速鉴别[J].中南药学,2014,(2):165-168.
[6] 李海艳,徐燕丰,辛海量,等.科罗索酸对SMMC-7721细胞生长抑制作用的初步研究[J].山东医药,2011,51(52):44-46,135.
[7] 杨 光,谭家驹,何瑞华,等.积雪草酸阻断大鼠肝纤维化的实验研究[J].中国中医基础医学杂志,2009,15(7):540-542.
[8] 周 军,高 静,方春钱,等.积雪草酸对肝癌细胞增殖作用的影响[J].江苏大学学报(医学版),2009,19(6):475-479.
[9] 汤丽霞,杨 光,谭家驹.积雪草酸诱导大鼠肝星状细胞凋亡[J].中草药,2009,(S1):230-232.
[10] 夏彬彬,李伊莎,徐唯哲,等.积雪草中积雪草酸的分离、纯化及其含量测定[J].首都医科大学学报,2011,32(04):538-540.
Determ ination of asiatic acid in the root of Actinidia valvata by HPLC
LÜFang,ZHOU Jin,FEIYang,CHEN Yu,ZHANG Guoqing,ZHAO Liang(Departmentof Pharmacy,Eastern Hepatobiliary Surgery Hospital Affiliated to Second M ilitary Medical University,Shanghai200438,China)
ObjectiveTo establish a method for the determination of asiatic acid in the root of Actinidia valvata.MethodsHPLC-VWD was used in the analysis.The column was Agilent HC-C18(4.6mm×250mm,5μm);themobile phase was acetonitrile:(30mmol/L)acetic acid amine solution(35∶65);the flow ratewas 1.0m l/min;the temperature of column was 25℃;the detection wavelength was set at 210 nm;the injection volumewas 25μl;the running timewas 35 min.ResultsAsiatic acid was separated w ith interference in baseline.The linear range was 25.30-506.0μg/m lw ith linear correlation of 0.999 6 for asiatic acid.The resultof intra-day and inter-day precisionswere both within 5%(n=3),and theaverage recovery was 99.4%with RSD 1.9%(n=6).ConclusionThemethod was simple,rapid,accurate and convenient for quality controlof asiatic acid in the root of Actinidia valvata.
Actinidia valvata;asiatic acid;determination;HPLC
R284.2;O657.72
A
1006-0111(2015)04-0356-03
10.3969/j.issn.1006-0111.2015.04.017
2014-03-06
2014-09-09[本文编辑]李睿旻
吕 昉,药师.Tel:(021)81875577;E-mail:lvfang-2005@163.com
赵 亮,主管药师.研究方向:中药质量控制研究.Tel:(021)81875584,E-mail:zhaoliangphar@163.com
