杜仲总黄酮体外抗乙型肝炎病毒的实验研究
2015-05-14遵义医学院生物化学教研室医学与生物学研究中心贵州遵义563000
余 晓,罗 果(遵义医学院:.生物化学教研室;.医学与生物学研究中心,贵州遵义563000)
杜仲是中国特有的名贵中药材和工业原料树种。研究表明,杜仲含许多有效药用成分,如黄酮类、木脂类、萜类、糖类、生物碱和抗真菌蛋白等[1],其中黄酮类化合物具有抗病毒、抗衰老、抗氧化、抑菌、降脂减肥[2]、抗癌防癌等作用[3]。
乙型肝炎是由嗜肝的乙型肝炎病毒(HBV)引起的一种在世界范围的传染性疾病,全世界约有3.5亿人感染HBV,我国约占一半。乙型肝炎给人类健康造成极大的危害,寻求高效低毒的抗HBV的天然药物已经刻不容缓[4]。本实验拟用转染HBV的人肝癌细胞HepG2.2.15作为研究对象[5],观察杜仲总黄酮抗HBV的效果,为杜仲抗HBV的药效成分筛选以及杜仲天然产物的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 杜仲皮采自贵州省正安县田生村。转染HBV的人肝癌细胞系HepG2.2.15购自中国典型培养物保藏中心。
1.1.2 试剂 HBV荧光定量试剂盒(达安基因公司);DMEM细胞培养液(GIBCO公司);乙型肝炎e抗原(HBeAg)、乙型肝炎表面抗原(HBsAg)试剂盒(华美公司);胎牛血清(四季青公司);芦丁标准品(中国药品生物制品检定所,批号:100080-200806)。拉米夫定[葛兰素史克制药(苏州)有限公司,批号:10090046]。
1.1.3 主要仪器 荧光定量PCR仪(美国Bio-Rad公司);ELX800通用酶标仪(美国Bio-techInc公司);CO2孵箱(美国Thermo公司)。
1.2 方法
1.2.1 杜仲总黄酮的提取与含量测定 将杜仲皮制成粉状,采用乙醇分段(60%~90%)提取法提取,醋酸铅胺沉淀过滤,浓缩后过大孔树脂、聚酰胺和硅胶柱,将过柱后样品与标准品芦丁对照,测得总黄酮含量为69%。
1.2.2 杜仲总黄酮对HepG2.2.15细胞的毒性实验 取对数生长期的HepG2.2.15细胞,用细胞培养液调整细胞浓度为 1×105mL-1,将细胞接种于 96 孔板,每孔 200 μL,待其贴壁后,弃掉原培养液。在杜仲总黄酮不同剂量组各孔分别加入总黄酮浓度为 25、50、100、200 μg/mL 培养液200 μL,另设不加药细胞培养孔为空白对照组,每组重复6孔。将各组细胞置CO2孵箱培养72 h,采用MTT法测定各组细胞在490 nm处的OD值。计算不同浓度杜仲总黄酮对HepG2.2.15细胞生长抑制率[6]。细胞生长抑制率(%)=(空白对照组OD值-杜仲总黄酮不同剂量组OD值)/剂量组OD值×100%。根据Reed-Muench公式计算半数毒性浓度(TC50)。
1.2.3 不同浓度杜仲总黄酮对HBV-DNA的作用 按1.2.2项下方法加入不同浓度的杜仲总黄酮药液,另设药物拉米夫定(50 μg/mL)为阳性对照,每组重复3孔。置CO2孵箱培养72 h后,取细胞培养上清液提取HBVDNA,采用Real-time PCR法测定HBV-DNA拷贝数。记录阈值(Ct值),计算各样品的HBV-DNA起始拷贝数和抑制率[7]。DNA抑制率=(空白对照组拷贝数-剂量组拷贝数)/空白对照组拷贝数×100%。
1.2.4 细胞培养上清液中HBsAg和HBeAg含量测定按1.2.2项下方法加入不同浓度的杜仲总黄酮药液并设置空白对照组,收集各组细胞培养的上清液进行酶联免疫吸附试验(ELISA)测定。测定方法按照试剂盒操作说明进行。用酶联免疫检测仪测定450 nm处OD值,并计算抑制率[8]。HBsAg或HBeAg抑制率=(空白对照组OD值-剂量组OD值)/空白对照组OD值×100%。
1.3 统计学处理 应用SPSS13.0统计软件进行数据分析,计量资料以ss表示,采用方差分析。Р<0.05为差异有统计学意义。
2 结 果
2.1 杜仲总黄酮对HepG2.2.15细胞的毒性实验 杜仲总黄酮各剂量组(25、50、100、200 μg/mL)的 OD 值均低于空白对照组,说明杜仲总黄酮对HepG2.2.15细胞的生长有抑制作用。其中,杜仲总黄酮 50、100、200 μg/mL剂量组的抑制率与空白对照组比较,差异有统计学意义(P<0.05)。见表 1。提示杜仲总黄酮的 TC50>200 μg/mL,因此,本实验选取小于或等于200 μg/mL的浓度检测杜仲总黄酮的抗HBV作用。

表1 杜仲总黄酮对HepG2.2.15生长的抑制作用
2.2 不同浓度杜仲总黄酮对细胞上清液中HBV-DNA的影响 用杜仲总黄酮和拉米夫定分别作用细胞72 h,应用Real-time PCR法检测细胞培养上清液中HBVDNA的拷贝数。结果显示,杜仲总黄酮各剂量组和拉米夫定对HBV-DNA的复制均有抑制作用,与空白对照组比较,差异均有统计学意义(P<0.05)。见表 2。

表2 杜仲总黄酮、拉米夫定对细胞上清液中HBV-DNA的影响
2.3 杜仲总黄酮对HepG2.2.15细胞培养上清液中HBsAg和HBeAg含量的影响 用杜仲总黄酮和拉米夫定分别作用72 h,ELISA法测定细胞分泌HBsAg和HBeAg量,采用OD值表示。结果显示,杜仲总黄酮各剂量组和拉米夫定对HBsAg及HBeAg的分泌均有抑制作用,与空白对照组比较,差异有统计学意义(P<0.05)。见表 3、4。
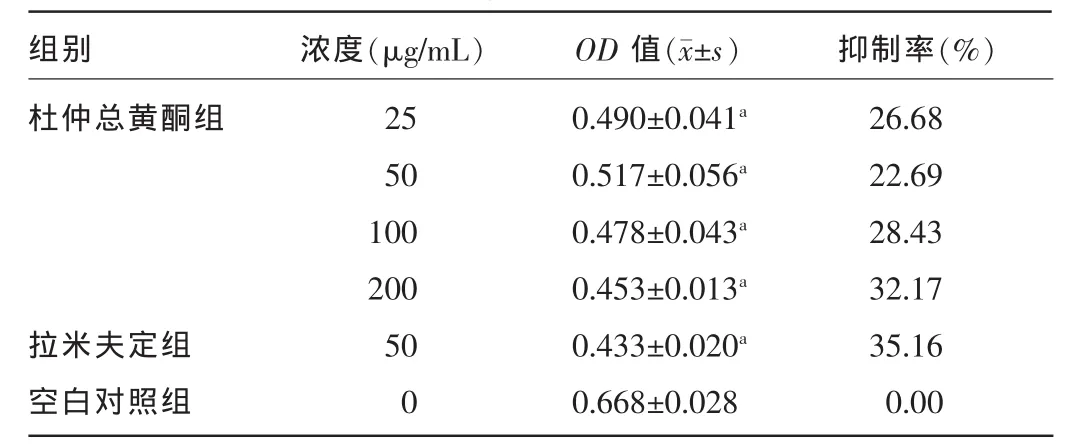
表3 杜仲总黄酮、拉米夫定对HepG2.2.15细胞分泌HBsAg的抑制作用
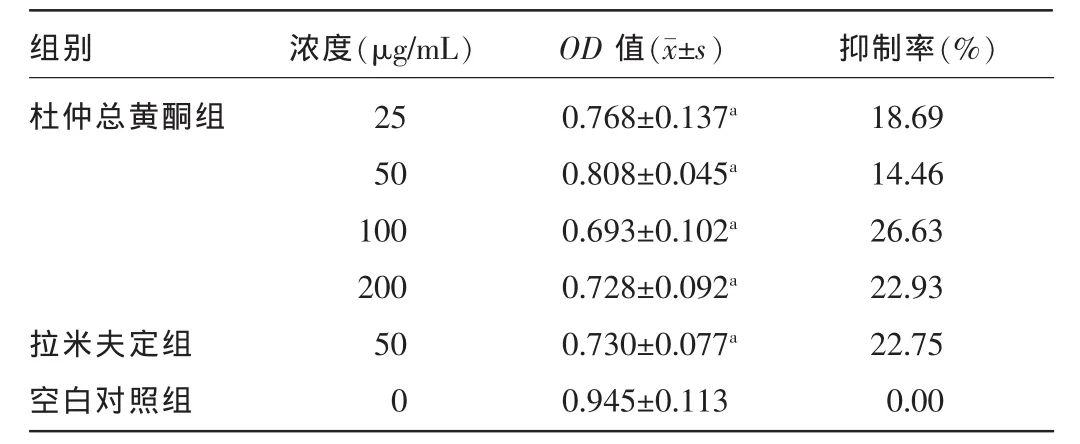
表4 杜仲总黄酮、拉米夫定对HepG2.2.15细胞分泌HBeAg的抑制作用
3 讨 论
黄酮类化合物是杜仲主要活性成分之一,具有抗氧化、调节血脂、抗肿瘤、抗病毒、抗骨质疏松、增强免疫力等多种功效。目前已经有其他物种的黄酮抗HBV的研究报道[9-11],而对杜仲黄酮抗HBV的相关研究报道较少。
本研究以转染HBV的HepG2.2.15细胞为研究对象,该细胞能持续分泌HBV和相关抗原,研究杜仲总黄酮对该细胞分泌HBsAg、HBeAg和HBV-DNA的影响[12]。结果显示,不同浓度的杜仲总黄酮和拉米夫定均对HBVDNA复制有较强的抑制作用。细胞培养上清液中HBsAg和HBeAg检测表明,不同浓度的杜仲总黄酮、拉米夫定均对HBsAg和HBeAg的有抑制作用,其中对HBV-DNA的复制抑制作用强于对HBsAg和HBeAg的作用,说明总黄酮抗HBV的机制可能与抑制病毒DNA复制有关。研究结果表明,杜仲总黄酮在体外具有抗HBV的作用,但是其全面的抗病毒作用还需结合动物体内试验来证明,其抗病毒机制还有待进一步研究。
[1]刘丽君.杜仲化学活性成分及其药理学研究概况[J].亚太传统医药,2013,9(5):82-83.
[2]张丽欣,李垚.植物黄酮抗病毒作用的研究进展[J].黑龙江科学,2010,1(3):33-37.
[3]赵德义,高锦明,许爱遐,等.杜仲黄酮指纹图谱研究[J].西北植物学报,2003,23(11):1988-1990.
[4]刘健.联合抗病毒治疗慢性乙型肝炎新进展[J].临床合理用药杂志,2013,6(26):174-176.
[5]叶军,明安萍.板蓝根颗粒药物血清对HepG2.2.15细胞分泌HBsAg、HBeAg的影响[J].湖北中医药大学学报,2012,14(6):10-12.
[6]周艳萌,吴中明,向晓波.土贝母皂苷体外抗乙型肝炎病毒的药效研究[J].时珍国医国药,2006,17(11):2134-2136.
[7]王玉,吴中明,敖弟书.紫花地丁抗乙型肝炎病毒的实验研究[J].中药药理与临床,2011,27(5):70-74.
[8]韦京辰,杨新平,李俊,等.青钱柳提取物对HepG2.2.15细胞HBsAg和 HBeAg 表达的影响[J].中成药,2012,34(7):1220-1224.
[9]朱华,梁东艳,笪舫芳.拳卷地钱总黄酮提取物抗乙型肝炎病毒体外实验研究[J].大众科技,2013,15(164):110-111.
[10]夏星,郑作文,谭为.白背叶黄酮类化合物抗鸭乙型肝炎病毒活性研究[J].中国药房,2010,21(7):590-592.
[11]郭姗姗,高英杰,时宇静,等.一枝蒿总黄酮体外抗乙肝病毒作用机理的实验研究[J].中国实验方剂学杂志,2009,15(10):72-74.
[12]冉贤金,胡虞乾.氧化苦参碱和拉米夫定体外抗乙肝病毒的比较[J].中国生化药物杂志,2012,33(2):142-144.
