响应面优化牛蒡子多糖的提取及其抗氧化活性研究*
2015-05-12喻俊王涛贾春红孙继业胡尚钦张利
喻俊,王涛,贾春红,孙继业,胡尚钦,张利
1(四川农业大学理学院,四川雅安,625014)2(四川农业大学林学院,四川 雅安,625014)3(四川辅正药业有限责任公司,四川 成都,611730)4(四川省农科院中药材研究中心,四川简阳,641400)
牛蒡子(Fructus arctii)为菊科(Asteraceae)植物牛蒡(Arctium lappa L.)的果实。始载于《本草图经》,其味辛苦、性寒、归肺胃二经,具有疏散风热、祛痰止咳、解毒透疹、利咽消肿等功效[1]。牛蒡子的功效成分主要有多糖类、木质素类、生物碱、挥发油和脂肪酸等[2]。牛蒡子具有抗肿瘤[3]、抗炎、抗糖尿病[4]、抗流感病毒和治疗脑缺血[5]等作用。目前国内外对牛蒡子的研究主要集中于木质素类和多酚类等化学成分的鉴定及药理功能上[6-7],有关牛蒡子多糖(polysaccharides from fructus arctii,简称FAP)的研究较少,关于青蒿、红花等菊科植物多糖研究较多,研究发现多种菊科类植物具有抑制癌症[8]、调节免疫[9]、抗氧化[10]等作用。本研究采用超声波辅助热水法提取牛蒡子多糖,响应面优化法优化提取工艺,对牛蒡子多糖的抗氧化活性进行研究。
1 材料与方法
1.1 材料试剂与仪器
牛蒡子,采自四川简阳牛蒡种植基地;葡萄糖(AR)、苯酚(AR)、浓 H2SO4(AR)、95% 乙醇(AR),成都市科龙化工试剂厂;1,1-二苯基-2-三硝基苯肼(DPPH)、四唑氮蓝(NBT)、还原型辅酶 I钠盐(NADH)、吩嗪硫酸甲酯(PMS),美国Sigma;所用水均为超纯水。
CP-114电子天平,上海洪纪仪器设备有限公司;SB-600DTD超声波清洗机,宁波新芝生物科技股份有限公司;LGJ-12冷冻干燥机,北京松源华兴科技发展有限公司;UV-1600PG紫外可见分光光度计,上海美谱达仪器有限公司;GL-22MS高速冷冻离心机,匡贝实业有限公司;SA-205傅里叶交换光谱分析仪,Thorlabs公司。
1.2 实验方法
1.2.1 单因素试验
取体积分数80%乙醇脱脂后干燥粉末10 g置于圆底烧瓶中,加水混合均匀后400 W超声25 min,之后水浴加热提取牛蒡子多糖。以牛蒡子多糖提取率为指标,分别对液固比(10∶1、15∶1、20∶1、25∶1、30∶1,mL∶g)、提取时间(1、2、3、4、5 h)、提取温度(60、70、80、90、100℃)对提取率的影响进行了研究和分析,确定各因素提取的最佳条件。
1.2.2 多糖含量和提取率测定
提取溶液中多糖含量的测定采用苯酚-硫酸法[11]。取0.1 mL的提取液于试管中,加水至2.00 mL,加入6%苯酚溶液1.00 mL,摇匀,迅速加入浓H2SO45.00 mL,摇匀放置20 min。在490 nm波长处测定吸光度。根据多糖浓度与吸光度作图得标准曲线,回归方程为y=6.942x+0.029 9(R2=0.994),计算可溶性多糖的含量。

1.3 响应面试验设计优化
根据单因素试验结果,采用Box-Behnken design对超声波辅助热水提取进行响应面优化,以固液比(A)、提取时间(B)、提取温度(C)为自变量,以牛蒡子多糖提取率为响应值,确定3因素3水平的最佳参数进行响应面分析,试验设计中的水平及编码表见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experiments
1.4 牛蒡子多糖的红外光谱测定
取最优条件提取的牛蒡子多糖2 mg与100 mg KI在玛瑙研钵中研磨均匀,压片机压片,置于傅里叶变换红外光谱仪中在4 000~450 cm-1波数范围内扫描,观察记录谱峰[12]。
1.5 牛蒡子多糖的抗氧化活性研究
1.5.1 对DPPH·的清除作用
采用DPPH氧化法,用超纯水将多糖配成不同浓度(0.02~2 mg/mL)的多糖溶液,参考聂少平[13]等人的方法测定牛蒡子多糖对DPPH·的清除能力,以Vc做阳性对照。每个样品重复3次,求平均值。计算公式如下:
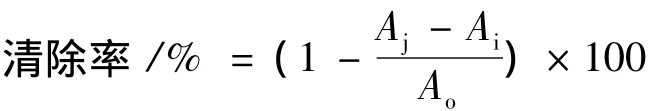
式中:Ao表示水代替样品溶液的DPPH溶液的吸光度;Ai表示样品溶液与DPPH混合溶液的吸光度;Aj表示不加DPPH溶液的样品溶液的吸光度。
1.5.2 对羟基自由基(·OH)的清除作用
用超纯水将多糖配成不同浓度(0.02~2 mg/mL)的多糖溶液,参考吴兰芳[14]等人采用水杨酸法测定牛蒡子多糖·OH的清除能力,以Vc做阳性对照。每个样品重复3次,求平均值。计算公式如下:

式中:Ao表示水代替样品溶液的混合反应溶液的吸光度;Ai表示样品溶液与混合反应溶液的吸光度;Aj表示不加水杨酸混合反应溶液的吸光度。
1.5.3 对超氧阴离子(O2-·)的清除作用
用NBT显色法测定,PMS/NADH体系会产生超氧自由基。用超纯水将多糖配成不同浓度(0.02~2 mg/mL)的多糖溶液,参考宋坤[15]等人采用 NBT显色法测定牛蒡子多糖对O2-·的清除能力,以Vc做阳性对照。每个样品重复3次,求平均值。计算公式如下:

式中:Ao表示水代替样品溶液的混合反应溶液的吸光度;Ai表示样品溶液与混合反应溶液的吸光度。
1.5.4 还原力的测定
用超纯水将多糖配成不同浓度(0.02~2 mg/mL)的多糖溶液。参考WANG[16]等人采用铁离子总还原力测定方法测定牛蒡子多糖的还原能力,以Vc作为阳性对照。每个样品重复3次,求平均值。
1.6 数据分析
采用Excel 2013和Origin 8.0分析软件对单因素试验中的各因素进行比较分析,采用Design-Expert 8.0数据处理软件进行响应面设计和分析。所有试验均重复3次,以平均值表示。
2 结果与分析
2.1 单因素试验
2.1.1 液固比对牛蒡子多糖提取率的影响
液固比是影响多糖提取率因素之一,不同液固比对牛蒡子多糖提取率的影响如图1。

图1 固液比Fig.1 Effect of ratio of water to raw material
由图1可以看出,随着液固比的增大,牛蒡子多糖的提取率先随着液固比的增大而增大,当液固比达到20∶1以后,牛蒡子多糖的提取率随着液固比的增加基本不变。选择最佳液固比20∶1(mL∶g)。
2.1.2 提取时间对牛蒡子多糖提取率的影响
如图2所示,在1~3 h内多糖的提取率随时间的增加而增加,3 h时多糖的提取率为最大值5.87%。随后增长提取时间,多糖的提取率基本趋于不变。这可能是由于时间的延长,牛蒡子多糖不断被溶出,使得提取率上升,但提取时间过3 h以后,多糖已基本溶出,多糖提取率随着提取时间的增加基本不变。选择提取时间3 h为宜。

图2 提取时间对牛蒡子多糖提取率的影响Fig.2 Eeffect of extraction time on the yield of FAP
2.1.3 提取温度对牛蒡子多糖提取率的影响
从图3可以看出,随着提取温度的上升,牛蒡子多糖的提取率先增加后减少,当提取温度为80℃时,多糖的提取率最高,当温度继续升高多糖的提取率缓慢减少,温度的升高可提高牛蒡子多糖的溶解度和多糖从组织中的渗出速率。但温度过高则可能导致多糖分解,从而影响牛蒡子多糖的渗出。提取温度选择80℃为宜。
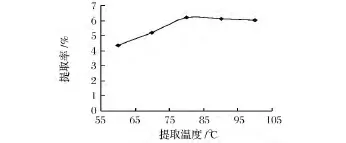
图3 提取温度对牛蒡子多糖提取率的影响Fig.3 Eeffect of extraction temperature on the yield of FAP
2.2 提取条件的优
2.2.1 响应面试验结果
根据Box-Behnken中心组合试验设计原理,综合分析单因素,选取对牛蒡子多糖提取率有影响的固液比、提取时间、提取温度3因素,设计3因素3水平的响应面分析试验。
使用Design Expert 8.0软件,以固液比、提取时间、提取温度为响应变量,以牛蒡子多糖提取率为响应面值对表2的数据进行处理,得到表3回归方程方差分析表,利用软件进行非线性回归的二项式拟合,得到预测模型如下:
多糖提取率(Y)/%=6.32+0.28A+0.17B+0.54C+0.055AB-0.18AC-0.12BC-0.56A2-0.44B2-0.64C2

表2 响应面试验设计及结果Table 2 RSM design matrix and the responses
表3为回归分析结果,该回归模型极显著(P<0.000 1),失拟项(P>0.05)不显著,决定系数R2=0.983 8,=0.963 1,说明该模型与实际拟合较好,误差较小,自变量与响应面值之间线性关系显著,可以用于牛蒡子多糖提取工艺试验的预测。各因素的影响程度分析,由回归系数检验值F值可以反映出各因素对试验指标的重要性,F值越大,表明该因素影响多糖提取率越大。FA=35.20,FB=12.30,FC=129.75,即各因素对提取率的影响程度大小顺序为:提取温度>液固比>提取时间。该模式的变异系CV=2.4%,在可接受范围之内[17-18]。
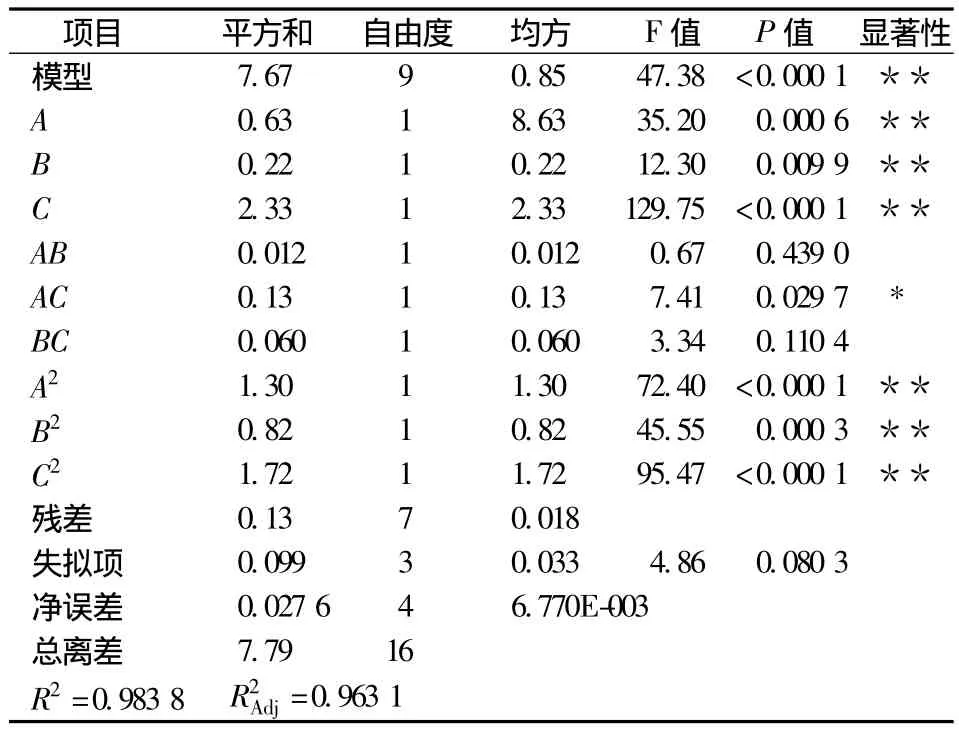
表3 回归方程模型显著性分析表Table 3 Significance testfor cofficients of the regression model developed
2.2.2 响应面分析
根据回归方程,做出响应面分析图和等高线图。如图4所示。等高线的形状可以反映出2个因素交互作用的强弱,椭圆形与圆形可以表示交互作用的显著与不显著。由图4可知,固液比与提取时间交互作用不显著,固液比与提取温度的交互作用较显著,提取时间与提取温度交互作用也较显著。在本实验中,提取温度是影响牛蒡子多糖提取率的最重要的因素,次之为固液比,提取时间影响最小。

图4 响应面图和等高线图Fig.4 Response surface and contour plots
2.2.3 提取工艺条件的验证
通过得出的模型,超声波辅助热水提取牛蒡子多糖的最优条件为:液固比为19.8∶1(mL∶g),提取时间为3.1 h,提取温度为85.1℃,提取率为6.43%。为了验证模型的有效性,按最佳提取条件提取,试验重复3次验证,平均得率为6.40%,与理论值偏差小于0.33%。说明通过响应面设计优化后得到的最优条件参数可靠,能较好的预测实验得率。
2.3 牛蒡子多糖的红外光谱分析
光谱是研究多糖官能团的有效手段,通过对特征峰的分析,可以初步判断多糖的官能团。牛蒡子多糖的红外光谱图如图5所示。3 400-1波数处为多糖的-OH的伸缩振动峰,2 900-1波数处为C-H的伸缩振动峰,在1 600-1波数为 C ═ O 的伸缩振动[19],在 950-1 200-1波数处的吸收峰为 C—O—H和C—O—C的变角振动[20],在 600~800-1有吸收,表明该多糖由-吡喃糖苷键连接[21]。由此可知,牛蒡子多糖具有典型的多糖特征吸收峰[22]。
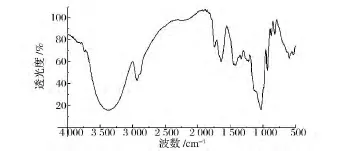
图5 牛蒡子多糖的红外光谱图Fig.5 The IR spectra ofFAP
2.4 牛蒡子多糖的体外抗氧化活性评价
(1)DPPH自由基的清除作用。牛蒡子多糖和Vc对DPPH·的清除作用如图6(a)所示。由图6-(a)可知,牛蒡子多糖对DPPH·具有一定的清除作用。在浓度0.2~2 mg/mL内,牛蒡子多糖和Vc对DPPH·的清除能力随浓度的增大而增大,牛蒡子多糖对DPPH·的清除能力由15.2%增至80.8%,具有量效关系,计算出牛蒡子多糖对DPPH·的IC50值为1.05 mg/mL。
(2)对·OH的清除作用。牛蒡子多糖和Vc对·OH的清除作用如图6(b)所示。由图6-(b)可知,在浓度0.2~2 mg/mL内,牛蒡子多糖和Vc对·OH自由基的清除能力随浓度的增大而增大,牛蒡子多糖对·OH自由基的清除能力随着浓度的增大由11.34%增至70.69%。计算出牛蒡子多糖对·OH自由基的IC50值为1.21 mg/mL。
(3)对O2-·的清除作用。牛蒡子多糖和Vc对·的清除作用如图6(c)所示。由图6(c)可知,在浓度0.2~2 mg/mL内,牛蒡子多糖和Vc对·自由基的清除能力随浓度的增大而增大。在浓度0.2~2 mg/mL范围内,牛蒡子多糖对O2-·阴离子的清除能力随着浓度的增大由10.8%增至68.3%。计算出牛蒡子多糖对O2-·阴离子的IC50值为1.25 mg/mL。
2.4.4 还原力测定
抗氧化剂的还原力与其抗氧化性之间存在一定的关系,抗氧化剂是通过自身的还原作用给出2个电子而清除自由基,还原力越强,抗氧化性越强。因此,可通过测定还原力来说明其抗氧化性的大小。牛蒡子多糖和Vc的还原力如图7所示。牛蒡子多糖和Vc的还原能力随浓度的增大而增大,在浓度0.2~2 mg/mL内,牛蒡子多糖的还原能力随着浓度的增大由12.2%增至58.3%,还原力表现出量效关系。根据计算,IC50值为1.43 mg/mL。

图6 牛蒡子多糖和Vc对DPPH清除作用(a),·OH清除作用 (b),O2-·清除作用 (c),Fig.6 Scavenging effect of FAP and Vc on DPPH radical(a),on hydroxyl radical(b),on superoxide anion free radical(c)

图7 牛蒡子多糖和VC的还原能力Fig.7 Scavenging effect of FAP and Vc on reducing power
3 结论
本研究建立了超声波辅助热水法提取牛蒡子多糖的最佳工艺条件,即液固比19.8∶1(mL∶g)、提取时间3.1 h、提取温度85.1℃,该最优条件下牛蒡子多糖的提取率为6.43%,验证值为6.40%,表明该模型合理可靠,能较好的预测超声波辅助热水法提取牛蒡子多糖的提取率。在测定的质量浓度范围内,牛蒡子多糖清除DPPH·、·OH、O2-·和还原力均随着质量浓度的增大而增大,清除DPPH·、·OH、和还原力的半数有效浓度(IC50)分别为1.05、1.21、1.25和1.43 mg/mL。牛蒡子多糖表现出较好的抗氧化活性,可以作为一种天然抗氧化剂应用在食品和保健品工业中。
[1] 颜正华.中药学[M].北京:人民卫生出版社,1995:89-101.
[2] 曾晓燕.牛蒡子的研究进展[J].中国野生植物资源,2014,33(2):6-9.
[3] 张兴德,张彩琴,刘启迪,等.牛蒡子抗肿瘤活性成分及作用机制研究进展[J].中国现代中药,2012,14(12):12-17.
[4] Ma S T,Lim D T,Deng J J,et al.Effect of arctiin on glomeru lar filtration barrier damage in STZ induced diabetic nephropathy bats[J].Phytotherapy Research,2013,27(10):147-148.
[5] 臧召霞,刘志强,梁庆成.牛蒡子复方制剂对大鼠脑缺血再灌 Caspase-3表达的影响[J].黑龙江医药,2010,13(1):22-27.
[6] Susanti S,Iwasaki H,Inafuku M,et al.Mechanism of srctigenin-mediated specific cytotoxicity against human lung adenocarcinoma cell lines[J].Phytomedicine,2013,21(1):39-46.
[7] Tezuka Y,Yamamoto K,Awale S,et al.Anti-austeric activity of phenolic constituents of seeds of Arctium lappa[J].Nat Prod Commun,2013,8(4):463-466.
[8] 梁颖,张晓莉,陶冀,等.红花多糖对人肝SMMC-7721细胞增殖的抑制作用[J].中医药学报,2011,39(5):32-35.
[9] 薛明,田丽娟.青蒿多糖的免疫活性研究[J].中成药,2008,30(8):1 211-1 213.
[10] 何素芬.红花多糖的初步研究[D].镇江:江苏大学,2009:26-27.
[11] 孟江,周毅生,廖华卫.鱼腥草多糖活性炭脱色工艺研究[J].食品与发酵工业,2009,35(2):112-115.
[12] Ganesh K C,Joo H S,Choi J W,et al.Purification and characterization of an extracellular polysaccharide from Haloalkalophilic bacillus[J].Enzyme and Microbial Technology,2004,34(7):673-681.
[13] 聂少平,谢明勇,罗珍.用清除有机自由基DPPH法评价茶叶多糖的抗氧化性[J].食品科学,2006,27(3):34-36.
[14] 吴兰芳,景永帅,张震东,等.吊灯花提取物体外抗氧化活性评价[J].食品工业科技,2010,31(3):78-80.
[15] 宋坤,刘琴,赵保堂,等.籽瓜多糖的超声波辅助提取工艺、分子量和抗氧化活性的研究[J].食品工艺科技,2014,25(10):269-274.
[16] 刘杰超,焦中高,周红平,等.水果活性多糖的研究现状与展望[J].食品科学,2008,29(10):675-679.
[17] Maran J P,Mekala V,Manikandan S.Modeling and optimization of ultrasound-assisted extraction of polysaccharide from Cucurbita moschata [J].Carbohydrate Polymers,2013,92(2):2018-2026.
[18] SHEN S,CHEN D,LI X.,et al.Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J].Carbohydrate Polymers,2014,32(104):80-86.
[19] GE Y,YU D,ZHEN G,et al.Polysaccharides from fruit calyx of Physalis alkekengi var.francheti:isolation,purification,structural features and antioxidant activities[J].Carbohydrate Polymers,2009,77(3):188-193.
[20] Kacurakova M,Capek P,Sasinkova V.,et al.A FT-IR study of plant cell wall model compounds:Pectic polysaccharides and hemicelluloses[J].Carbohydrate Polymers,2000,43(8):95-103.
[21] YANG L,ZHANG L M.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76(9):349-361.
[22] 宁永成.有机化合物结构鉴定与有机波普学[M].北京:科学出版社,2002:53-54.
