分光光度计比浊法测定抗菌物质效价*
2015-05-12王凯旋卫兰兰洪婷付瑞燕
王凯旋,卫兰兰,洪婷,付瑞燕
(安徽农业大学茶与食品科技学院,安徽合肥,230036)
抗菌物质是指具有杀菌或抑菌活性的物质,包括细菌素、类细菌素和抗生素等生物活性物质。在过去的60多年里,多种能准确测定抗菌物质活性的方法先后被提出,包括ATP生物发光测定法(ATP Bioluminometry)、绿色荧光蛋白测定法(GFP bioassay)、MTT[3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tetrazolium bromide]比色法、免疫学方法等[1-4],然而使用这些方法需要特殊的试剂或仪器设备,因此没有得到广泛应用。长期以来,琼脂扩散法(agar diffusion assay)因无需特殊材料,检测成本低[5-6]而成为测定抗菌物质活性最常用的方法,但是该法耗时耗力、对操作人员经验要求高、人为影响因素多,实验者经常得不到理想的实验结果[7]。1952年,Berridge和Barrett首次应用微孔比浊法来测定抗生素效价[8],经过几十年的不断改进,该法已以成为可以定量测定抗菌物质的一种方法[9-10],但是,需要使用酶标仪这一“短板”限制了其广泛应用,如能建立起分光光度计比浊法无疑将极大提高其应用普遍性。为此本研究对于影响分光光度计比浊法准确定量抗菌物质效价的关键因素进行了研究,建立了测定细菌素nisin、类细菌素NFL[11]和抗生素硫酸庆大霉素等抗菌物质效价的分光光度计比浊法。
1 材料与方法
1.1 材料
1.1.1 菌种
金黄杆菌(Chryseobacterium)NHW菌株、乳酸乳球菌(Lactococcus lactis)NFL菌株和乳酸乳球菌(L.lactis)8148菌株,为安徽农业大学食品微生物实验室保藏。
1.1.2 培养基
STAA培养基:蛋白胨20 g,酵母抽提物2 g,K2HPO41 g,MgSO4·7H2O 1 g,甘油 15 g,琼脂13 g,蒸馏水1 000 mL,pH 7.0±0.2,121℃下15 min灭菌后冷却至40~50℃左右,加入过滤除菌的链霉素500 mg,环己六亚胺50 mg和乙酸盐50 mg混匀,用于培养金黄杆菌NHW菌株。
MRS培养基:牛肉浸膏8.0 g,Tween-80 1.0 mL,葡萄糖20.0 g,胰蛋白胨10.0 g,酵母抽提物4.0 g,K2HPO42.0 g,柠檬酸三铵 2.0 g,醋酸钠 5.0 g,Mn-SO4·H2O 0.05 g,MgSO4·7H2O 0.2 g,蒸馏水 1 000 mL,pH 6.0±0.2。用于培养乳酸乳球菌NFL菌株。
GM17培养基:补充了15 g/L葡萄糖的M17培养基(购自青岛海博),用于培养乳酸乳球菌8148菌株。
1.2 实验方法
1.2.1 抗菌物质抗菌类型的确定
乳酸乳球菌NFL发酵上清液的制备:将活化后的乳酸乳球菌NFL菌株以5%接种量接种于MRS液体培养基中,30℃培养12 h,离心(10 000 r/min,15 min)取上清液,将上清液过滤除菌,取滤液备用。
硫酸庆大霉素、氯霉素和类细菌素NFL抗菌类型的确定:将活化后的指示菌金黄杆菌NHW菌株以5%接种量接种于STAA液体培养基中培养至对数期,离心(10 000 r/min,5 min)取菌体,用生理盐水洗涤1次,将菌体重悬于生理盐水中,分别添加终质量浓度为16.67 μg/mL的氯霉素乙醇溶液、888.89 U/mL的硫酸庆大霉素水溶液、66.67 μL/mL的NFL菌上清液,30℃下振荡 (150 r/min)培养6 h,分别在培养的0时刻和6 h取200 μL发酵液涂布于STAA平板表面,30℃下培养测定菌落总数。
nisin抗菌类型的确定:将活化后的指示菌乳酸乳球菌8148菌株以5%接种量接种于GM17液体培养基中培养至对数期,离心(10 000 r/min,5 min)取菌体,用生理盐水洗涤1次,将菌体重悬于生理盐水中,添加终浓度为1.5 U/mL的nisin盐酸溶液(0.02 mol/L)。30℃下静置培养6 h,分别在培养的0 h和6 h取200 μL发酵液涂布于GM17平板表面,30℃下培养测定菌落总数。
1.2.2 不同抗菌物质抑菌率曲线的测定
将活化后的指示菌以2%的接种量接种于相应的培养基中,实验组分别加入终质量浓度为16.67 μg/mL的氯霉素乙醇溶液(对照为无水乙醇)、888.89 U/mL的硫酸庆大霉素水溶液(对照为无菌水)、66.67 μL/mL的NFL菌株发酵上清液(对照为MRS培养基)和0.5 U/mL的nisin盐酸溶液(对照为0.02 mol/L HCl溶液),培养过程中每隔2 h取样,立即转入冰水浴中以终止微生物生长,于600 nm波长处测定吸光值(上海菁华,752紫外可见分光光度计),连续测定至14 h。对照组加入量与实验组体积相同,其余方法同实验组。
抑菌率/%=(OD对照-OD实验)/OD对照×100
1.2.3 抗菌物质效价分光光度计比浊法的建立
1.2.3.1 指示菌接种量对最佳取样时间点的影响
乳酸乳球菌8148接种量对nisin效价测定取样时间点的影响:将活化后的乳酸乳球菌8148菌株分别以2%、5%、8%的接种量接入GM17培养基,实验组中加入终浓度为0.5 U/mL的nisin盐酸溶液,分别在30℃下静置培养1、2、3 h,取样,测定抑菌率和发酵液浊度增量,浊度增量OD600=OD600实验-OD600起始。
金黄杆菌NHW接种量对类细菌素NFL效价测定取样时间点的影响:将活化后的金黄杆菌NHW分别以1%、2%、3%的接种量接入STAA培养基,实验组中加入终浓度为66.67 μL/mL的NFL菌株发酵上清液,分别在30℃下振荡培养3、4、5 h取样,测定抑菌率和发酵液浊度增量OD600。
1.2.3.2 测定抗菌物质效价标准曲线的建立
nisin效价标准曲线的建立:将活化后的乳酸乳球菌8148菌株以5%的接种量接入GM17培养基,实验组中加入终浓度为 0.2、0.5、0.8、1.1、1.4 U/mL的nisin盐酸溶液,在30℃下静置培养2 h,取样测定抑菌率。另一实验组中加入终浓度为0.4、0.8、1.2、1.6、2.0、2.4 U/mL的nisin盐酸溶液,在30℃下静置培养5 h,取样测定抑菌率。
2 h取样的nisin效价标准曲线的验证性实验:将活化后的乳酸乳球菌8148菌株以5%的接种量接入GM17培养基,实验组中加入终浓度为0.4、1.0 U/mL的nisin盐酸溶液,在30℃下静置培养2 h,取样测定抑菌率。根据标准曲线的回归方程计算这两个样品的测定误差率(RSD)。

类细菌素NFL效价标准曲线的建立:将活化后的金黄杆菌NHW以2%的接种量接入STAA培养基,实验组中加入终浓度为 36.67、43.33、50.00、56.67、63.33 μL/mL 的 NFL 菌株发酵上清液,分别在30℃下振荡培养4 h,取样测定抑菌率。测定终浓度为40、60 μL/mL的NFL菌株发酵上清液的抑菌率,用所得标准曲线的回归方程计算这两个样品的测定误差率(RSD)。
硫酸庆大霉素效价标准曲线的建立:将活化后的金黄杆菌NHW菌株以2%的接种量接入STAA培养基,实验组中加入终浓度为444.44、533.33、622.22、711.10、799.99、888.88 U/mL 的硫酸庆大霉素水溶液,分别在30℃下振荡培养4 h,取样测定抑菌率。测定终浓度为577.77、755.55 U/mL的硫酸庆大霉素水溶液的抑菌率,用所得标准曲线的回归方程计算这两个样品的测定误差率(RSD)。
2 结果与分析
2.1 不同抗菌物质的抑菌率曲线
从图1可以看出,随着指示菌在硫酸庆大霉素水溶液中处理时间的延长,细胞逐步被杀死,失去生长能力。而指示菌在nisin、氯霉素和NFL菌株发酵上清液中处理6 h,活菌数下降幅度均很小,nisin和氯霉素是已知的抑菌剂,表明NFL菌株发酵上清液具抑菌活性而非杀菌活性。
在指示菌培养基中分别添加以上各种抗菌剂后,测定其生长曲线,计算得到抑菌率曲线。从图2可见,抑菌类抗菌剂nisin、氯霉素和NFL菌株发酵上清液的抑菌率曲线趋势基本一致,都是先上升后下降,有一个明显的峰值,也就意味着此时测定抑菌率,对于抗菌剂浓度的变化最为敏感。因此,将此时间点定为抑菌类抗菌剂最佳取样时间点。而杀菌类抗菌剂硫酸庆大霉素的抑菌率曲线是快速上升至一个高点,稳定一段时间后,再缓慢上升。
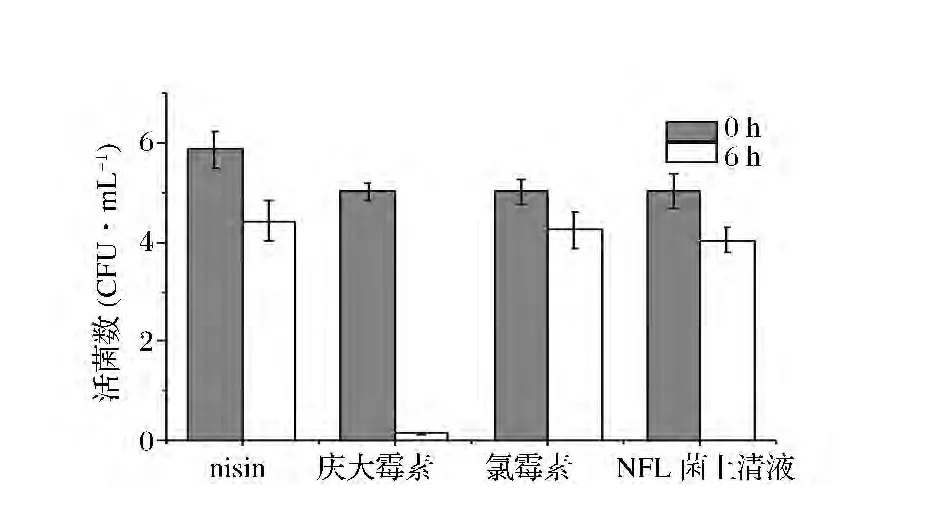
图1 抗菌物质抗菌类型的确定Fig.1 Determination of antimicrobial types of antimicrobial substances

图2 不同抗菌物质的抑菌率曲线Fig.2 The inhibitory rate curves of different antimicrobial substances
2 抗菌物质效价分光光度计比浊法的建立
2.1 接种量对最佳取样时间点的影响
抑菌率计算的依据是生物量,而接种量的大小会直接影响微生物细胞生物量的高低,因此研究了指示菌接种量对最佳取样时间点的影响。从图3可以看出,中等(5%)和较高(8%)接种量下测定nisin浓度的最佳取样时间点均为2 h。低接种量(2%)下,指示菌培养3 h的抑菌率高于2 h的,导致测定nisin浓度的最佳取样时间点延后。最佳取样时间点的确定不仅取决于最高抑菌率,还要兼顾指示菌生长增量和培养时间,如图3所示,低接种量(2%)下指示菌培养3h的对照组(未添加 nisin)发酵液浊度增量(OD600)很低,表明此时体系中的活菌量较低,不能很好地表征nisin的抑菌效力,且培养时间偏长。因此,以乳酸乳球菌8148为指示菌来测定nisin浓度,最佳指示菌接种量为5%,最佳取样时间点为2 h。
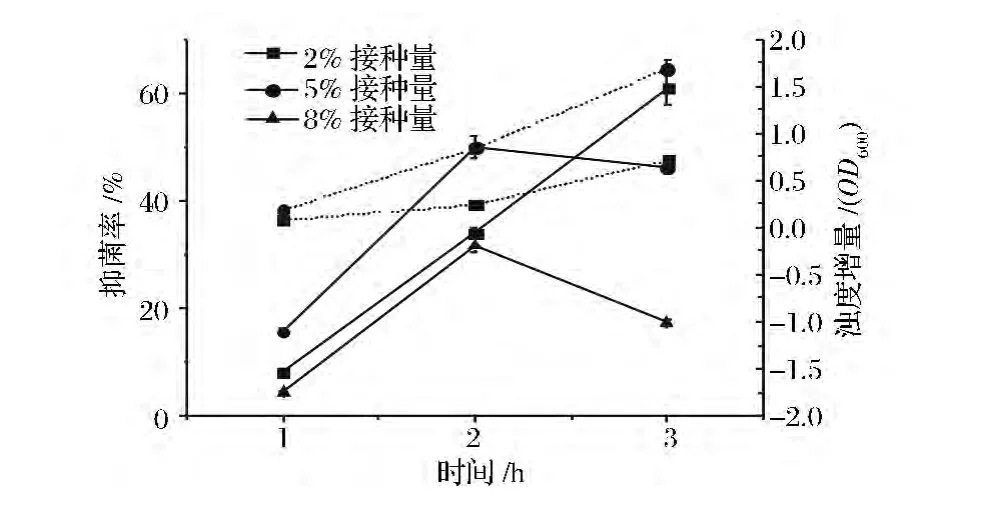
图3 指示菌乳酸乳球菌8148接种量对测定nisin效价的取样时间点的影响(虚线为浊度增量,实线为抑菌率)Fig.3 Influence of inoculum of indicator L.lactis 8148 on the sampling time point of nisin potency determination
由图4可以看出,以金黄杆菌NHW为指示菌来测定类细菌素NFL的效价,同样也表现出相同的趋势,最佳指示菌接种量为2%,最佳取样时间点为4 h。
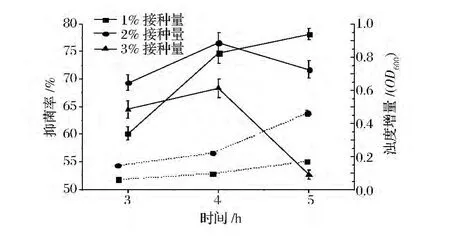
图4 指示菌金黄杆菌NHW接种量对测定类细菌素NFL效价的取样时间点的影响(虚线为浊度增量,实线为抑菌率)Fig.4 Influence of inoculum of indicator Chryseobacterium NHW on the sampling time point of bacteriocin-like substance NFL potency determination
2.2 分光光度计比浊法测定抗菌物质效价的标准曲线的建立
2.2.1 测定nisin效价标准曲线的建立
以5%接种量接种指示菌乳酸乳球菌8148,在GM17培养基中添加不同终浓度的nisin,培养2 h,测定抑菌率,以抑菌率对nisin浓度值进行线性回归。由图5可知,在nisin终浓度为0.2~1.4 U/mL,抑菌率为25%~98%的范围内,nisin浓度与抑菌率之间呈良好的线性关系(R2=0.9921),验证性实验(表1)表明,该方法的准确度较高(RSD<5%)。在非最佳取样时间点测得标准曲线回归方程的R2值低于0.99,表明此时取样测定所得数据的线性相关度偏低;此外,此时回归方程的斜率也低于最佳取样时间点的,表明在非最佳取样时间点下抑菌率对nisin浓度变化的敏感度偏低。
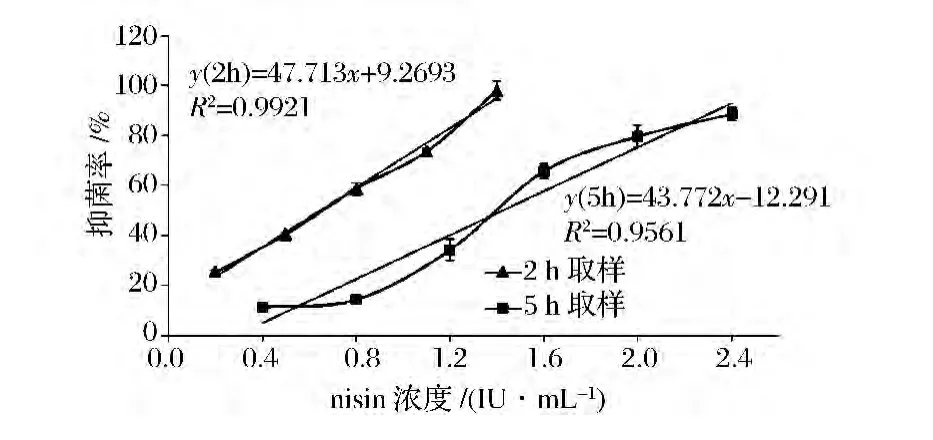
图5 不同取样时间点下nisin标准曲线的测定Fig.5 Determination of nisin standard curve under different sampling time points
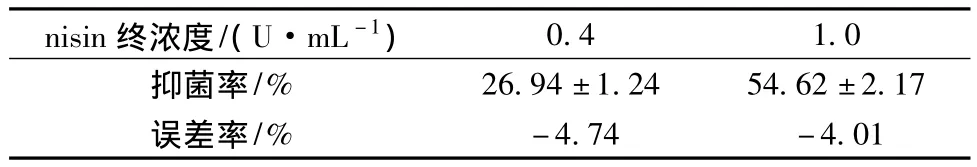
表1 2 h取样时的nisin标准曲线的验证实验Table 1 The verification experiment of 2 h-sampling nisin standard curve
2.2.2 测定类细菌素NFL效价标准曲线的建立
乳酸乳球菌NFL菌株发酵上清液中含有类细菌素NFL,与nisin不同,NFL菌株发酵上清液不是纯品,其中还含有未被细胞利用完的营养物质及代谢产物,实验发现,本比浊法同样适用于发酵液中抑菌物质活性的定量测定。以2%接种量接种指示菌金黄杆菌NHW菌株,在STAA培养基中添加不同体积的NFL菌株发酵上清液,培养4 h,测定抑菌率,以抑菌率对NFL菌株发酵上清液添加量进行线性回归。由图6可知,在NFL菌株发酵上清液添加量为36~64 μL/mL,抑菌率为7% ~58%的范围内,发酵上清液添加量与抑菌率之间的线性相关良好(R2=0.994),验证性实验(表2)表明该方法的准确度较高(RSD<5%)。

图6 乳酸乳球菌NFL菌株发酵上清液标准曲线的测定Fig.6 Determination of standard curve of L.lactis NFL fermentation liquid supernatant

表2 乳酸乳球菌NFL菌株发酵液上清液标准曲线的验证实验Table 2 The verification experiment of supernatant of L.lactis NFL fermentation liquid standard curve
2.2.3 测定硫酸庆大霉素效价的标准曲线的建立
由图7可知,nisin测定最佳取样时间点(2 h)所对应的时刻是实验组(培养基中含0.5 U/mL的nisin)生长曲线的对数前期。如前所述,硫酸庆大霉素的抑菌率曲线与nisin等抑菌剂的不同,并没有呈现明显的峰值,但在4 h时抑菌率会处于一直较高的平台,此时对应的实验组也基本处于对数前期(图8)。

图7 指示菌乳酸乳球菌8148生长曲线及nisin抑菌率曲线Fig.7 Indicator L.lactis 8148 growth curves and inhibitory rate curve of nisin
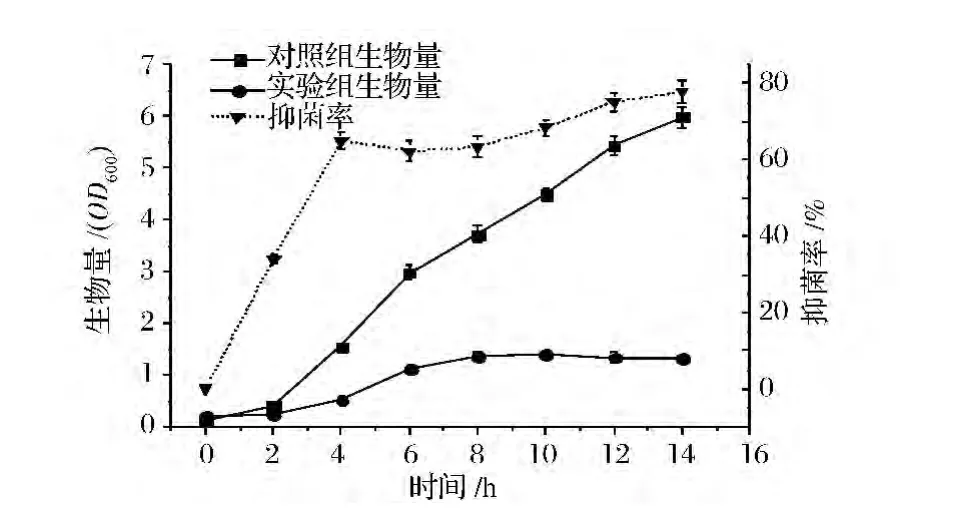
图8 指示菌金黄杆菌NHW生长曲线及硫酸庆大霉素抑菌率曲线Fig.8 Indicator Chryseobacterium NHW growth curves and inhibitory rate curve of gentamicin sulfate
以2%接种量接种指示菌金黄杆菌NHW菌株,在STAA培养基中添加不同浓度的硫酸庆大霉素,培养4 h,测定抑菌率,以抑菌率对硫酸庆大霉素浓度值进行线性回归。由图9可知,在硫酸庆大霉素终浓度为444~888 U/mL,抑菌率为30% ~64%的范围内,硫酸庆大霉素浓度与抑菌率之间的线性相关良好(R2=0.9901),验证性实验(表3)表明该方法的准确度较高(RSD<5%)。实验发现,如果以6 h(即对应的实验组对数末期)为取样时间点所取得的标准曲线回归方程的R2值只有0.9673(图9),表明此时的硫酸庆大霉素浓度与抑菌率之间的线性关系较差。
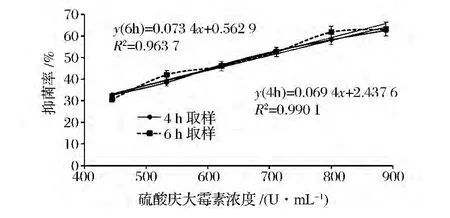
图9 不同取样时间点下硫酸庆大霉素效价标准曲线的测定Fig.9 Determination of gentamicin sulfate standard curve under different sampling time points

表3 硫酸庆大霉素4h取样标准曲线的验证实验Table 3 The verification experiment of 4 h-sampling gentamicin sulfate standard curve
3 讨论
采用比浊法测定抗菌物质特别是抗生素效价的文献不少,方法大致都是将抗菌物质加入指示菌培养体系中培养一段时间(一般为2~5h)测定浊度,抗菌物质浓度的对数与浊度在一定范围内线性关系良好(R2> 0.99)[12-14]。但这些报道中均没有说明抗菌物质与指示菌培养时间(即取样测定浊度的时间点)的确切依据。李秀兰等采用分光度度计比浊法测定抗菌肽活性,抗菌肽浓度与活力单位之间线性关系良好,但是操作较为复杂,需要将对数期的指示菌菌体洗涤后重悬于缓冲液中,加入抗菌肽样品振荡培养30 min后测定浊度,将所测结果代入经验公式得到活力单位[15]。同样,作者也没有说明为何要培养30 min,这样对于其他种类抗菌物质效价的测定,并不具有直接的借鉴意义。
本研究所建立的比浊法是将抑菌率与抗菌物质浓度之间直接建立线性相关,并且找到了抑菌剂和抗菌剂效价线性定量测定的关键因子,即取样时间点。以nisin和硫酸庆大霉素的效价测定为例(图5和图9),如果取样时间点选择得不好,所得的标准曲线R2值就会小于0.99,达不到线性相关的要求。无论是nisin这种抑菌剂还是硫酸庆大霉素这种杀菌剂,最佳取样时间点对应的都是实验组(即培养基中加入抗菌物质)生长曲线的对数前期(图7和图8),这种规律性可能是因为本法采用的抑菌率指标依据的是对照组活细胞与实验组中未被抑制或杀死的活细胞生长能力的比较,当取样时间点为实验组的对数前期,实验组生物量基本可以反映当时的活细胞数;如果取样时间点为实验组的对数末期,实验组生物量会包含部分死细胞,就会偏离效价与抑菌率之间的线性相关了。
除此之外,接种量的大小对抑菌率的高低有显著的影响(图3和图4),虽然低接种量下最高抑菌率值较高,但最佳取样时间点会延后,且指示菌生长速度偏低,并不能很好地表现出抑菌物质的作用;高接种量从检测时间和最高抑菌率方面均较差,因此,接种量的优化对于提高本方法的应用效果十分必要。
本研究所建立的分光光度计比浊法不仅可用来准确测定nisin、类细菌素NFL和庆大霉素的效价,而且具有设备简单、操作简单等优点。有理由相信,本方法也可以适用于其他抗菌物质效价的测定。首先,测定抗菌物质抑菌率曲线,以此为依据,抑菌剂以最高抑菌率对应的时间点为取样时间点,杀菌剂可以结合实验组生长曲线和抑菌率曲线,综合考虑实验组对数前期和抑菌率峰值选择出合适的取样时间点;随后,测定指示菌不同接种量下的抑菌率,确定合适的指示菌接种量;最后,建立抑菌率与抗菌物质效价之间的标准曲线。
[1] Daoudi L,Turcotte C,Lacroix C,et al.Production and characterization of anti-nisin Z monoclonal antibodies:suitability for distinguishing active from inactive forms through a competitive enzyme immunoassay[J].Appl Microbiol Biotechnol,2001,56(1 - 2):114 -119.
[2] Hakovirta J,Reunanen J,Saris PE.Bioassay for nisin in milk,processed cheese,salad dressings,canned tomatoes,and liquid egg products[J].Appl Environ Microbiol,2006,72(2):1 001 -1 005.
[3] Valat C,Champiat D N,Guyen TT,et al.Use of ATP bioluminescence to determine the bacterial sensitivity threshold to a bacteriocin[J].Luminescence,2003,18(5):254-258.
[4] WANG F,CAO LT,HU SH.A rapid and accurate 3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tetrazolium bromide colorimetric assay for quantification of bacteriocins with nisin as an example[J].J Zhejiang Univ Sci B,2007,8(8):549-554.
[5] Lalpuria M,Karwa V,Anantheswaran RC,et al.Modified agar diffusion bioassay for better quantification of Nisaplin[J].Appl Microbiol,2013,114(3):663 -671.
[6] Bonev B,Hooper J,Parisot J.Principles of assessing bacterial susceptibility to antibiotics using the agar diffusion method[J].J Antimicrob Chemoth,2008,61:1 295 -1 301.
[7] Papagianni M,Avramidis N,Filioussis G,et al.Determination of bacteriocin activity with bioassays carried out on solid and liquid substrates:assessing the factor"indicator microorganism"[J].Microbial Cell Factories,2006,5:30-44.
[8] Berridge NJ,Barrett J.A rapid method for the turbidometric assay of antibiotics[J].J Gen Microbiol,1952,6:14-20.
[9] 张恩户,乔慧,王光建,等.微孔比浊法测定牛黄上清片的抗菌效价[J].中药药理与临床,2012,28(3):23-25.
[10] WU Z,LI X.Modification of the data-processing method for the turbidimetric bioassay of nisin[J].Appl Microbiol Biotechnol,2007,74(2):511 -516.
[11] 倪萍,黄洁洁,纪文营,等.1株具广谱抑菌活性的乳酸乳球菌的分离鉴定与保鲜效果[J].食品与发酵工业,2013,39(4):53 -57.
[12] 张胜波,屈胜环.微生物比浊法测定硫酸庆大霉素颗粒效价[J].济宁医学院学报,2013,36(4):259-260.
[13] 吴兆亮,贾永生,谭相伟,等.分光光度法快速测定乳链菌肽效价[J].分析化学研究简报,2006(34):227-230.
[14] 应茵,楼娉婷.比浊法测定多西环素效价含量[J].药学实践杂志,2013,31(5):368 -370.
[15] 李秀兰,戴祝英,张双全.抗菌肽琼脂糖孔穴扩散法与比浊法测定比较及其相关性[J].南京师大学报(自然科学版),1998,21(2):81 -83.
