α-突触核蛋白通过氨基端引起MN9D细胞线粒体膜损伤
2015-05-11申甲梅段春礼鲁玲玲张建亮
高 歌,申甲梅,段春礼,王 雪,鲁玲玲,张建亮,杨 慧
(首都医科大学 神经生物系 北京脑重大疾病研究院 帕金森病研究所 北京市神经再生修复重点实验室神经变性病教育部重点实验室,北京100069)
帕金森病(Parkinson's Disease,PD)是第二大神经退行性疾病,PD的发病因素涉及基因、环境、神经内毒素和老化等多种因素。这些致病因素中线粒体功能障碍是PD 致病的中心环节[1]。Α-突触核蛋白(α-synuclein,α-syn)是首个被报道的PD 致病基因,因此深入研究α-syn 对线粒体功能的影响,对PD的发生发展及治疗都有重要意义。目前虽然α-syn 被分为3个结构域,即N端,NAC区及C端,但α-syn 各结构域的具体作用仍不清楚。本研究将探讨过表达α-syn的各结构域对细胞及线粒体的影响,进而为阐明PD 发病的可能机制及发现治疗靶点提供依据。
1 材料与方法
1.1 材料
小鼠多巴胺能细胞系(MN9D细胞)(Novartis公司Bastian Hengerer 博士惠赠),人胚肾细胞株(HEK293),DMEM/F12 培养基、DMEM 培养基和胎牛血清(Gibco 公司),胰蛋白酶、JC-1(5,5',6,6'-四氯-1,1',3,3'-甲基苯并咪唑氢碘化物)和DCFH-DA(2',7'-二氯荧光素-二酯),(Sigma 公司),MitoProbeTMTransition Pore Assay Kit (Invitrogen 公司),人源α-syn(α-syn蛋白全长),α-syn/N(α-syn 氨基端),α-syn/delN (α-syn 去氨基端),α-syn/NAC(NAC区),α-syn/C(羧基端),α-syn/delC(去羧基端)质粒均由本实验室构建。
1.2 方法
1.2.1 细胞培养及转染:用含有10% 胎牛血清(FBS)、100 U/mL 青霉素和100 U/mL 链霉素的DMEM/F12 培养基培养MN9D细胞,用含10% FBS,100 U/mL 青霉素和100 U/mL 链霉素的DMEM 培养基培养HEK293T细胞,于37℃的5% CO2培养箱中培养。实验分组:未处理组(control),空载体组(Myc),α-syn 过表达组(α-syn),α-syn/N 过表达组(α-syn/N),α-syn/delN 过表 达组(α-syn/delN),α-syn/NAC过表达组(α-syn/NAC),α-syn/C过表达组(α-syn/C),α-syn/delC过表达组(α-syn/delC)。瞬时转染时间48 h。按照Lipofectamine2000 操作说明书进行质粒转染。
1.2.2 MTT法检测细胞活力:上述各组MN9D细胞用100 μL 培养基按1×105个/孔接种于96孔板,每组细胞接种8个复孔。接种24 h后,向各孔加入MTT(5 mg/L)20 μL,37℃,5% CO2培养箱继续培养4 h。吸弃培养基后,每孔加入100 μL 二甲基亚砜,振荡10 min,使生成的颗粒完全溶解。将孔板置于酶标仪中,读取550 nm 波长处的吸光度值,统计作图。
1.2.3 LDH(乳酸脱氢酶)法检测细胞毒性:分组同MTT 分组,另外加上Triton-100 组。按照LDH 试剂盒操作说明书进行。计算细胞毒性百分比:细胞毒(%)= (检测样本- 低对照)/(高对照- 低对照)%,统计作图。
1.2.4 ROS水平检测:分别过表达α-syn 各个片段48 h后,DCFH-DA 孵育,流式细胞仪检测各组绿色荧光强度,表征细胞内ROS水平。
1.2.5 MN9D细胞线粒体膜渗透性转运孔(mPTP)检测:根据MitoProbeTMTransition Pore Assay Kit 检测线粒体操作说明,过表达α-syn 各个片段48 h后,对各组经流式细胞术检测细胞荧光强度,来表征线粒体mPTP 孔的开放程度。
1.2.6 MN9D细胞内线粒体膜电势检测:在MN9D细胞过表达α-syn 各结构域48 h后与JC-1 共孵育,使用共聚焦显微镜及流式细胞仪检测线粒体膜电势。膜电势正常时,JC-1 呈现红色荧光;膜电势下降时,JC-1 呈现绿色荧光。用红绿荧光的比值变化来表征线粒体膜电势变化。
1.2.7 线粒体形态检测:HEK293T细胞分别于过表达α-syn 各结构域48 h后,细胞进行免疫荧光标记、激光共聚焦显微观察,一抗为Tom20(线粒体外膜组份,用来标记线粒体,显示为红色)和Myc 标签抗体(用来标记过表达的α-syn 各结构域,显示为绿色),DAPI 用于标记细胞核。统计异常的线粒体(空泡样)占总线粒体的百分比。
1.3 统计学分析
所有实验数据均通过SPSS13.0 统计软件进行单因素方差分析进行统计学检验,组间分析用Tukey's multiple comparisons test 检验,以均值±标准差(±s)表示。
2 结果
2.1 分别过表达α-syn、α-syn/N及α-syn/delC 引起细胞活力减低,LDH 释放增加
瞬时转染α-syn、α-syn/N及α-syn/delC 这3 组MN9D细胞活力较对照组明显下降(图1A),LDH的释放量较对照组明显增高(图1B)(P<0.01)。
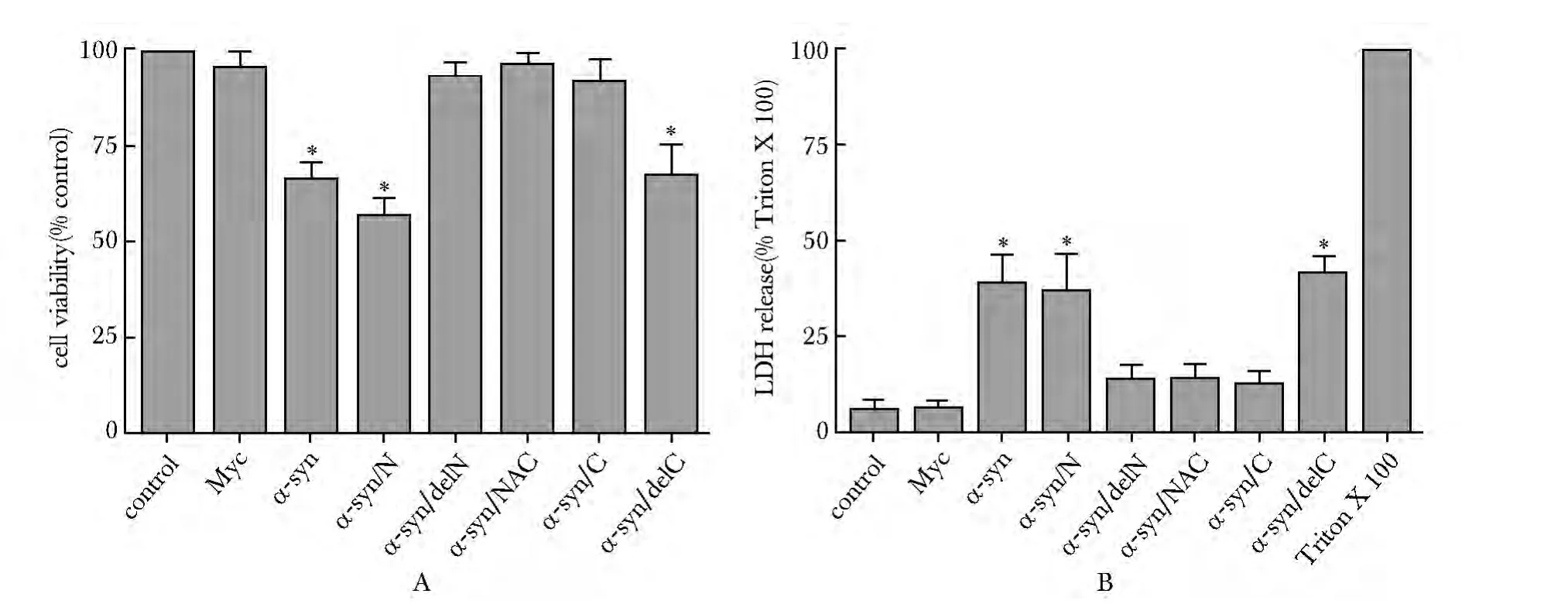
图1 过表达α-syn 各结构域对细胞活力(图1A)及LDH 释放(图1B)的影响Fig1 The effect of cell viability (MTT assay,A)and LDH release (B)in different MN9D cells overexpressing various domains of α-syn(n=12)
2.2 分别过表达α-syn、α-syn/N及α-syn/delC 引起细胞内ROS水平增加
在MN9D细胞分别转染α-syn 各结构域48 h后,过表达α-syn、α-syn/N及α-syn/delC3 组的绿色荧光强度与空载组相比明显增加(P<0.001)(图2)。
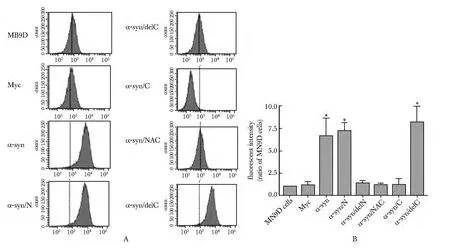
图2 过表达α-syn 各结构域对细胞内ROS水平的影响Fig2 ROS levels in different MN9D cells overexpressing various domain of α-syn(n=3)
2.3 分别过表达α-syn、α-syn/N及α-syn/delC组引起mPTP 孔异常开放
各组加入calcein-AM后荧光强度相对一致,再加入CoCl2后,α-syn、α-syn/N及α-syn/delC组荧光强度与正常、空载组相比明显减弱,α-syn/N 组减弱更加明显(图3A)。显示 α-syn、α-syn/N及α-syn/delC组荧光强度较对照组显著性减弱(图3B)(P<0.01)。

图3 在MN9D细胞中过表达α-syn 各结构域对线粒体mPTP 开放的影响Fig3 mPTP opening in different MN9D cell line overexpressing various domain of α-syn(n=3)
2.4 分别过表达α-syn、α-syn/N及α-syn/delC引起线粒体膜电势下降
α-syn、α-syn/N及α-syn/delC组绿色荧光标记的线粒体显著增多(P<0.01)(图4)。
2.5 α-syn 及α-syn/N 过表达引起线粒体形态出现气球样变化(图5)

图4 在MN9D细胞中过表达α-syn 各结构域对线粒体膜电势的影响Fig4 Mitochondrial membrane potential in MN9D cells overexpressing various domain of α-syn(n=3)
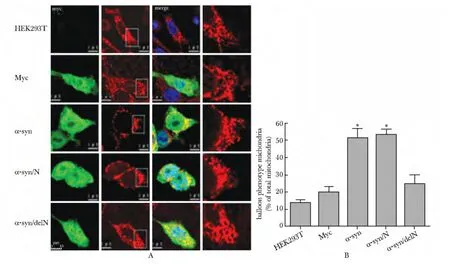
图5 在HEK293T细胞中过表达α-syn 及α-syn/N 对线粒体形态的影响Fig5 Abnormal mitochondrial phenotypes in HEK293T cell line overexpressing α-syn and α-syn/N
3 讨论
α-syn是首个报道的PD 相关基因,α-syn蛋白是由140个氨基酸组成的蛋白质。其N端由1 -60位氨基酸残基构成,核心部分的氨基酸(KTKEGV)高度保守,可与细胞膜可逆结合;中间部分是高度疏水的NAC区(61 -95aa),与形成富含β 片层的淀粉样纤维有关;C-末端(96 -140aa)含有较多的酸性氨基酸,可抑制α-synuclein 纤维的装配并可能使其行使类似分子伴侣的功能。很多文献报道α-syn的N端与膜的结合相关[2-3],有研究显示,α-syn/N端的乙酰化作用参与α-syn的聚集[4]。现有的研究发现α-syn 可以通过其氨基端定位在线粒体[5],且对线粒体产生毒性作用。不管是在PD的病人组织、动物模型还是细胞模型中,野生型或突变型的α-syn过表达都会引起线粒体的功能障碍,主要表现为线粒体分裂融合障碍、线粒体膜电位下降及细胞色素c(Cyto c)的释放、线粒体DNA 损伤和Complex Ⅳ活性下降,并且可以损伤电子传递链引起ROS的产生增加[6-8]。但是α-syn的哪个结构域引起这些损伤是不太清楚的。结果显示,过表达α-syn、α-syn/N、α-syn/delC组细胞活力较对照组明显下降,同时LDH的释放量也显著增多,细胞内ROS水平显著增加,而过表达α-syn/delN,α-syn/NAC 及α-syn/C组与对照组相比都没有显著改变,这提示α-syn是通过其N端发挥细胞毒性作用。大量的实验结果证实ROS是引起PD 病人多巴胺能神经元损伤的的原因,过表达α-syn 能引起ROS的聚集和线粒体膜电势的改变[9]。本实验中检测了线粒体膜孔开放程度,以及线粒体膜电位改变情况,结果显示:α-syn、α-syn/N及α-syn/delC3 组有线粒体膜孔的异常开放和线粒体膜电势下降的出现,而不包含N端的各组都没有显著改变。为了进一步验证α-syn 各结构域对线粒体的作用,使用激光显微共聚焦检测各组线粒体形态变化,发现α-syn/N 可导致线粒体形态变成肿胀的球状,呈现凝聚成小球形结构,产生所谓的气球表型。这些结果都提示α-syn是通过其N端引起线粒体的膜损伤。有研究认为α-syn/N端的乙酰化对于维持其螺旋结构和与膜结合是至关重要的[10],也有研究报道,过表达α-syn 可直接与线粒体膜发生作用来促进线粒体的分裂[11],而野生型α-syn、A53T 和E46K 都能够与线粒体作用,引起线粒体功能下降[12],与实验结果α-syn/N端是作用于线粒体的关键结构域相吻合。
综上,研究结果提示,α-syn的N端是引起线粒体膜损伤的关键结构域,但是其具体作用机制是不清楚的,因此,下一步将围绕α-syn/N端是如何引起线粒体及细胞损伤开展研究。
[1]Lin MT,Beal MF.Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J].Nature,2006,443:787-795.
[2]Karube H,Sakamoto M,Arawaka S,et al.N-terminal region of alpha-synuclein is essential for the fatty acid-induced oligomerization of the molecules[J].FEBS Lett,2008,582:3693-3700.
[3]Bartels T,Ahlstrom LS,Leftin A,et al.The N-terminus of the intrinsically disordered protein alpha-synuclein triggers membrane binding and helixfolding[J].Biophys J,2010,99:2116-2124.
[4]Miotto MC,Valiente-Gabioud AA,Rossetti G,et al.Copper binding to the N-terminally acetylated,naturally occurring form of alpha-synuclein induces local helical folding[J].J Am Chem Soc,2015,in press.
[5]Zhang Y,Ma H,Xie B,et al.Alpha-synuclein overexpression induced mitochondrial damage by the generation of endogenous neurotoxins in PC12 cells[J].Neurosci Lett,2013,547:65-69.
[6]Luk KC,Kehm VM,Zhang B,et al.Intracerebral inoculation of pathological alpha-synuclein initiates a rapidly progressive neurodegenerative alpha-synucleinopathy in mice[J].J Exp Med,2012,209:975-986.
[7]Xie W,Chung KK.Alpha-synuclein impairs normal dynamics of mitochondria in cell and animal models of Parkinson's disease [J].J Neurochem,2012,122:404-414.
[8]Zhu Y,Duan C,Lu L,et al.Alpha-synuclein overexpression impairs mitochondrial function by associating with adenylate translocator[J].Int J Biochem Cell Biol,2011,43:732-741.
[9]Dias V,Junn E,Mouradian M M,et al.2013.Theroleofoxidative stress inParkinson'sdisease [J].Parkinsons Dis.2013,3:461-491.
[10]Dikiy I,Eliezer D.N-terminal acetylation stabilizes N-terminal helicity in lipidand micelle-bound alpha-synuclein and increases its affinity for physiological membranes[J].J Biol Chem,2014,289:3652-3665.
[11]Zigoneanu IG,Yang YJ,Krois AS,et al.Interaction of alpha-synuclein with:vesicles that mimic mitochondrial membranes[J].Biochim Biophys Acta,2012,1818:512-519.
[12]Parihar MS,Parihar A,Fujita M,et al.Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells[J].Int J Biochem Cell Biol,2009,41:2015-2024.
