MEF2A启动子多态性对转录活性及冠心病易感性的影响
2015-05-11刘本荣熊玉娟李爱群熊龙根
刘本荣,熊玉娟,钟 赟,莫 沛,李爱群,熊龙根
(1.广州医科大学附属第二医院 心血管疾病研究所,广东 广州510260;2.广州中医药大学第二临床学院 检验科,广东 广州510105)
肌细胞增强因子2A(myocyte enhancer factor 2A,EF2A)是较早被鉴定出来的与冠心病(coronary artery disease,CAD)相关的常染色体显性基因[1],但其遗传多态是否与CAD 有关存在争议[2]。MEF2A 属于第二类转录调控因子,参与调控心肌转录网络、肌肉组织及血管生成相关特异基因的表达[3-4],其自身表达受到miR-1的调控[5]。MEF2A和MEF2C 缺陷型诱发扩张性心肌病[6],MEF2C 调控心肌发育可能是通过调控DOK5 基因的表达而实现的[7]。在小鼠模型中,MEF2A表达单倍型剂量不足更易导致动脉粥样病变,MEF2A 自身的表达调控可能在CAD的发生发展中发挥重要作用,发生在其调控区的遗传多态或变异可能是导致群体或个体对CAD 易感差异的重要原因,然而国内外未见相关报道。本研究通过测序发现MEF2A启动子区的单核苷酸多态(single nucleotide polymorphism,SNP)位点,利用双萤光素酶报告基因系统研究不同MEF2A启动子单倍型的转录活性,同时比较各单倍型在CAD组和对照组中的频率及纯合率差异。
1 材料与方法
1.1 材料
样本收集及基因组DNA的提取:CAD 患者44名,正常对照45名,各抽取静脉血2 mL,EDTA 抗凝。研究获得广州医科大学医学伦理委员会批准,并与受试者签订知情同意书。
全血基因组提取试剂盒和endo-free plasmid midi kit(广州速研生物公司),PCR扩增试剂(Toyobo公司),T 克隆载体pTZ57R/T(中晶生物公司),限制性内切酶Kpn Ⅰ和Bgl Ⅱ(广州瑞真生物公司),启动子载体pGL3.0 Basic、pRL-TK 和dual luciferase reporter assay system (Promega 公司),人冠状动脉内皮 细 胞(human coronary artery endothelial cell,HCAEC)(Sciencell 公司),lipofectamineTM2000、引物合成和测序(Life Technology 公司),内皮细胞培养基EGM-2(广州仪涛公司)。
1.2 方法
1.2.1 引物设计:以NCBI 数据库中MEF2A 基因序列(NC_000015)为参考序列,利用引物设计软件Primer premier 5.0 进行引物设计。启动子区PCR扩增引物为Kpn Ⅰ_F2AF2:cgg ggtacc CACCTATC TCAGAAAAGGCAAC;Bgl Ⅱ_ F2AR2:ggaagatct G GGGCTATTTTTAGGAGACAAG。测序引物为F2A-S1:CACCTATCTCAGAAAAGGCAAC;F2A-rS1:GGGGC TATTTTTAGGAGACAAG;MEF2AP_seq1:CGATAAG GAGGTTGCTACTG。
1.2.2 PCR扩增:反应体系ddH2O 13.1 μL,10×缓冲液2 μL,DMSO 2 μL,MgSO4(25 mmol/L)0.8 μL,dNTP (2.5 mmol/L)0.5 μL,Kpn Ⅰ-F2A2(10 P)0.3 μL,Bgl Ⅱ-F2AR2(10 P)0.3 μL,KOD Taq 酶(1 U/μL),gDNA(10~30 ng/μL)0.5 μL,总体积20 μL。PCR 反应条件:95℃预变性1 min,95℃10 s,64℃30 s,68℃1 min,共34个循环,最后68℃延伸3 min。
1.2.3 载体构建:选取12种常见单倍型构建MEF2A启动子载体,载体命名同其代表的单倍型名称,分别为H1、H3、H5、H6、H8、H9、H10、H13、H14、H15、H16和H17,载体构建示意图如图1。连接产物转化感受态细胞(DH5α),培养过夜,挑取单克隆于3 mL LB 培养基中,37℃培养过夜,提取质粒,测序鉴定。启动子单倍型的确定采用T 载体克隆测序。

图1 MEF2A启动子载体示意图Fig1 Sketch map of the construction of MEF2A promoter vector
1.2.4 细胞培养及转染:HCAEC 培养在含2%FBS 及相关生长因子的EGM-2 培养基中。转染前24 h 铺板,按5 000个细胞/cm2接种细胞,于二氧化碳培养箱(37℃,5% CO2)中培养过夜。用去内毒素质粒提取试剂盒提取的MEF2A启动子载体与pRL-TK 共转染,按lipofectamineTM2000 说明书操作。
1.2.5 启动子活性分析:细胞转染后48 h 进行萤光素酶活性分析,按dual luciferase reporter assay system 说明书操作。萤光素酶活性测定在化学发光检测仪(Lumat LB 9507,德国)上进行。
1.3 统计学分析
序列比对采用clustalx1.81,转录因子结合位点预测采用 TFSEARCH (http://www.cbrc.jp/research/db/TFSEARCH.html),各单倍型转录活性比较、作图及显著性分析采用GraphPad Prism 5,两单倍型间的萤光素酶活性比较采用T-test,所有单倍型的荧光素酶活性比较采用one-way ANOVA 分析,两组间的杂合率比较采用卡方检验。利用Arlequin3.5 进行Hardy-Weinberg 平衡分析。各单倍型的萤光素酶活性以3次独立试验的平均值±标准差(±s)表示。
2 结果
2.1 SNP 及单倍型分析
在1245 bp MEF2A启动子区域发现9个SNP位点,组成18种单倍型(分别为H1,H2,…,H18),其中H1、H5、H8 和H164种单倍型的频率较高,占79.21%(表1)。3个SNPs 导致转录因子结合位点(transcription factor binding site,TFBS)发生改变(图2)。其中位于启动子-580位C 变为A,导致转录因子ADR1、Sp1的结合位点及GC Box 在此区域丢失(图2A);-646位G 变为T,导致Ttk-69、HSF 结合位点丢失(图2B);-948位C 变为T,导致Sp1 和HSF 结合位点丢失(图2C)。由-948(C/T)、-646(G/T)和-580(C/A)组成的单倍型有CGC(17.98%)、CGA(3.94%)、TGA(36.51%)、TTC(33.15%)、TTA(3.94%)、TGC(3.37%)和CTC(1.69%),其中包含TGA的单倍型转录活性最高。

表1 MEF2A启动子区的SNP位点及各单倍型的频率分布Table1 The relative position of SNP sites in the promoter region of MEF2A and the frequency of each haplotype in the subjects
2.2 各单倍型启动子的转录活性
H5 和H8 转录活性最高,H1 和H9次之,H1、H3、H6、H10、H13、H14、H15、H16和H17 最低(图3)。含-646 T 等位基因的单倍型(H10、H14、H15、H16、H17)的转录活性低(图3)。各单倍型间的转录活性总体差异显著(P<0.001),H8的转录活性显著高于其他单倍型(P<0.05)。
2.3 冠心病的易感性与MEF2A启动子区的纯合率呈正相关
MEF2A 近端启动子在CAD组中的纯合率达到50%,显著高于对照组中的28.9%(χ2= 4.155,P<0.05)(图4)。CAD组中的期望杂合率显著高于实际观测值,不符合Hardy-Weinberg 平衡(表2);在对照组中的期望杂合率与实际观测值之间没有明显差异,符合Hardy-Weinberg 平衡(表2)。表明CAD 易感性与MEF2A启动子区的纯合率存在相关性。

图2 预测的MEF2A启动子区的转录因子结合位点Fig2 The predicted transcription factor binding sites in MEF2A promoter region

表2 Hardy-Weinberg 平衡检测结果Table2 Results of Hardy-Weinberg balance test
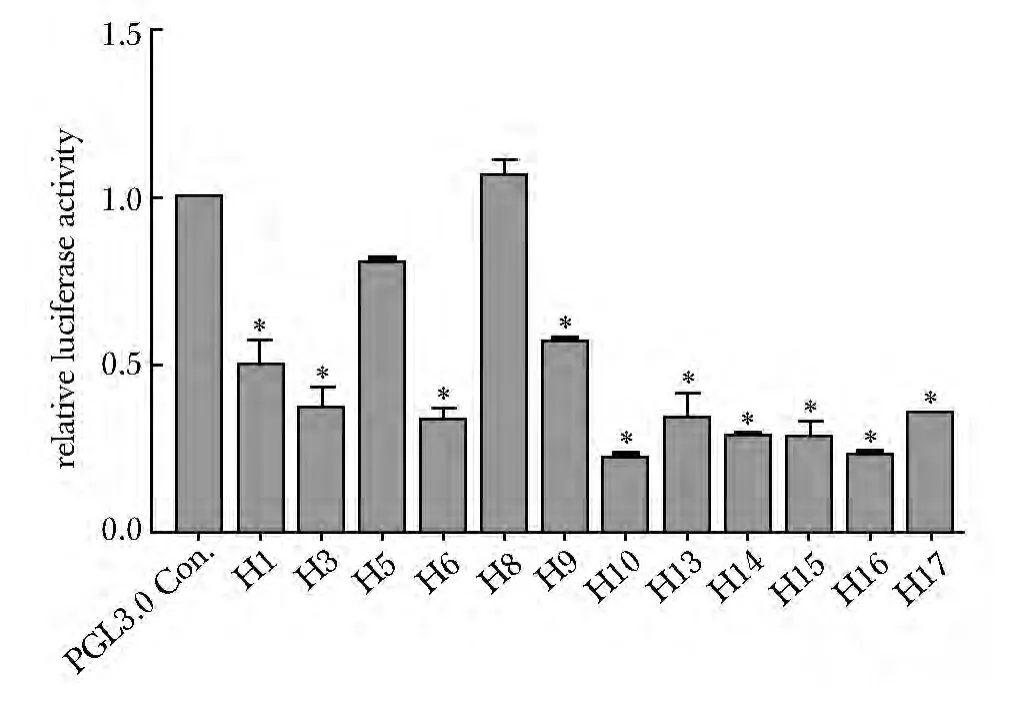
图3 各MEF2A启动子单倍型的转录活性Fig3 The transcription activity of MEF2A promoter haplotypes(±s,n=3)
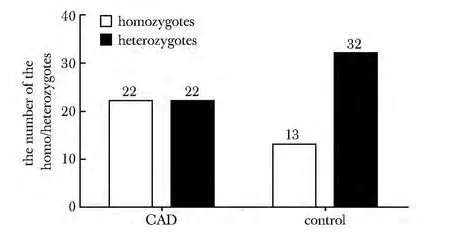
图4 MEF2A 近端启动子的纯合率Fig4 The homozygosity of the proximal promoter of MEF2A
3 讨论
研究发现MEF2A启动子区的SNPs 会导致TFBS的改变,由不同SNPs 组成的单倍型具有不同的启动子活性,可见MEF2A启动子区的SNPs 也许会导致不同个体MEF2A的表达水平差异,从而表现出对某些疾病易感性的差异。通常认为,导致TFBS 改变的SNPs 都将致使启动子活性发生变化[8],MEF2A 近端启动子区中有3个SNPs 可能导致TFBS 丢失,其中含-646(T)的启动子单倍型确实表现出较低的转录活性。然而,由-948、-646和-580 3个SNP位点组成的单倍型中,未丢失任何TFBS的单倍型并未表现出最高的转录活性,而H5 和H8 在-948 和-580位都有TFBS丢失,却表现出最强的转录活性,这种现象可能与基因的稳定性选择有关[9]。因此,仅从SNPs是否导致TFBS 丢失判断其对启动子活性的影响未必准确,必须将由不同等位基因组成的单倍型看作一个整体来考虑,并通过实验验证,探索单倍型与疾病的相关性也许比考察单个SNP 与疾病的相关性更重要。CAD组中MEF2A 近端启动子区的纯合率明显高于对照组,可能是由于MEF2A 在血管内皮及血管平滑肌的修复和功能维护中发挥重要作用,MEF2A启动子区的纯合状态可能导致基因的表达水平不及杂合状态稳定,对外界刺激因子的反应过激或过慢,从而诱发血管病变。可见,MEF2A的表达水平或蛋白活性可能与CAD的发生发展有更密切的关系。
[1]Wang L,Fan C,Topol SE,et al.Mutation of MEF2A in an inherited disorder with features of coronary artery disease[J].Science,2003,302:1578-1581.
[2]Li J,Chen HX,Yang JG,et al.MEF2A gene mutations and susceptibility to coronary artery disease in the Chinese population[J].Genet Mol Res,2014,13:8396-8402.
[3]Schlesinger J,Schueler M,Grunert M,et al.The cardiac transcription network modulated by Gata4,Mef2a,Nkx2.5,Srf,histone modifications,and microRNAs[J].PLoS Genet 7:e1001313.doi:10.1371/journal.pgen.1001313.
[4]Liu G,Han J,Profirovic J,et al.Galpha13 regulates MEF2-dependent gene transcription in endothelial cells:role in angiogenesis[J].Angiogenesis,2009,12:1-15.
[5]Ikeda S,He A,Kong SW,et al.MicroRNA-1 negatively regulates expression of the hypertrophy-associated calmodulin and Mef2a genes[J].Mol Cell Biol,2009,29:2193-2204.
[6]Xu J,Gong NL,Bodi I,et al.Myocyte enhancer factors 2A and 2C induce dilated cardiomyopathy in transgenic mice[J].J Biol Chem,2006,281:9152-9162.
[7]温见燕,阴彬,张英姿,等.MEF2C 调控DOK5 基因的表达[J].基础医学与临床,2009,29:342-346.
[8]Bandele OJ,Wang X,Campbell MR,et al.Human singlenucleotide polymorphisms alter p53 sequence-specific binding at gene regulatory elements [J].Nucleic Acids Res,2011,39:178-189.
[9]Liu B,Fu Y,Wang Z,et al.HLA-DRB1 may be antagonistically regulated by the coordinately evolved promoter and 3'-UTR under stabilizing selection[J].PLoS One,2011,doi:10.1371/journal.pone.0025794.
