HSG通过Wnt/β-catenin通路抑制COPD大鼠气道成纤维细胞增殖
2015-05-11葛正行
葛正行,李 霄,周 洵,李 波,娄 强
(1.贵阳中医学院附属第二医院 呼吸内科,贵州 贵阳550001;2.贵阳中医学院 研究生院,贵州 贵阳550002)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的肺部疾病,气道重建是COPD的关键,其本质是小气道的慢性炎症及纤维化[1],而成纤维细胞过度激活发挥了极大的作用。因此寻找调控气道重建的关键基因并进行干预是寻求慢阻肺新疗法的突破点。本课题组前期证实,当HSG 基因转染到COPD大鼠气道成纤维细胞能抑制其增殖[2]。但调控相关基因及细胞因子的网络通路尚未完全阐明。Wnt/β-catenin通路是目前公认的调节慢阻肺气道重建的重要信号传导通路之一[3]。本实验拟探索HSG 在COPD 气道重建中与Wnt/β-catenin信号传导通路的关系,及其调控气道重建的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠[SCXK(渝2012-0005)重庆腾鑫生物技术有限公司SPF级],体质量(120±20 g),鼠龄6周。
1.1.2 试剂:脂多糖(LPS)(Sigma 公司);Gibco 胎牛血清(Life Technologies 公司);Trizol 试剂(Invitrogen 公司);RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific 公司);Universal SYBR Green Supermix 2×Utaq PCR Master(BIO-RAD 公司);Anti-Mitofusin 2 抗体、Anti-beta Catenin 抗体、Anti-GSK3β抗体、Anti-Lamin B1 抗体、Anti-GAPDH 抗体(Abcam公司)。
1.2 方法
1.2.1 COPD大鼠模型建立及鉴定:将大鼠分为对照组及COPD模型组。造模方法参见文献[4]。造模结束后随机处死对照组大鼠10只及模型组大鼠20只,切取左肺组织用4%多聚甲醛固定,石蜡切片,HE染色。采用图像分析系统进行图像分析,以WAt/Pbm 评价肺组织小气道重构增厚情况,测定方法参见文献[5]。
1.2.2 大鼠气道成纤维细胞培养及鉴定:按照文献[6]分离大鼠小气道进行成纤维细胞原代培养,3~5代细胞用于后续研究。成纤维细胞的鉴定参见文献[2]。
1.2.3 Real ime PCR检测成纤维细胞HSG 和βcatenin表达:Trizol 法提取细胞总RNA 并采用紫外分光光度计测定纯度及浓度。按RevertAid First Strand cDNA Synthesis Kit 说明书进行反转录合成cDNA,反应条件:37℃孵育15 min,85℃5 s 终止反应。引物序列:HSG 正向引物:5'-CACATGGAG CGTTGTACCAG-3',反向引物:5'-TTGAGCACCTCCT TAGCAGAC-3'(104 bp);β-catenin 正向引物:5'-CGAGGACTCAATACCATTCC-3',反向引物:5'-AGC CGTTTCTTGTAGTCCTG-3'(251 bp);β-action 正向引物:5'-GGGA AATCGTGCGTGACATT-3',反向引物:5'-GCGGCAGTGG CCATCTC-3'(76 bp)。PCR反应体系按Universal SYBR Green Supermix 2×Utaq PCR Master 说明书配制。反应条件:95℃预变性30 s;95℃变性5 s,57℃退火/延伸30 s,45个循环;60~95℃熔解曲线分析60 s。参照文献[7]以10倍梯度稀释cDNA 获得6个质量浓度梯度的标准品,分别对目的基因和内参基因制作标准曲线。标准品和待测样品同时进行扩增。目的基因Ct值代入目的基因的扩增直线方程,计算出“起始模板浓度”,同理算出内参基因的“起始模板浓度”。同一样品的目的基因定量值除以内参基因定量值即该样品相对表达量。
1.2.4 Western blot 测定成纤维细胞HSG、β-catenin 和GSK-3β表达:提取细胞总蛋白、核蛋白及磷酸化蛋白,并计算质量浓度[6]。蛋白变性后用Nu-PAGE Bis-Tris Mini Gels 进行电泳,100 V 恒压电泳10 min,200 V 恒压继续进行分离胶部分电泳。200 mA恒流120 min 进行转膜,4℃封闭过夜。分别用一抗HSG(1 ∶2 000)、β-catenin(1 ∶5 000)、P-GSK-3β(1∶1 000)、Lamin B1(1∶1 000)和GAPDH(1∶5 000)室温摇床孵育6 h。TBST 洗膜后二抗室温摇床孵育2 h。ECL 发光、压片、显影和定影。应用ImageJ 软件测定蛋白条带吸光度值。
1.2.5 ELISA 检测成纤维细胞细胞因子TGF-β1 和MMP-9表达:按照ELISA 试剂盒说明书进行测定。
1.3 统计学分析
采用SPSS16.0 软件,计量资料符合正态分布以均值±标准差(±s)表示,两组比较采用完全随机t 检验;不符合正态分布采取M(P25,P75)表示,采用秩和检验。运用Pearson 积差相关系数进行相关性分析。
2 结果
2.1 HE染色
与对照组相比COPD模型组大鼠肺组织出现肺气肿病理变化,肺泡出现扩张,肺泡壁变薄,并逐步断裂融合成肺大疱,肺泡数量显著减少。气道黏膜纤毛出现黏连、变性和坏死,甚至脱落。支气管上皮杯状细胞增生肥大,有大量的炎性细胞如中性粒细胞和巨噬细胞浸润管腔(图1),小气道管腔的狭窄同时伴小气道壁纤维结缔组织增生(图2)。

图1 肺部炎性细胞的浸润Fig1 Lung inflammatory cell infiltration(HE×200)

图2 小气道纤维结缔组织增生Fig2 Small airway fibrous connective proliferation(HE×200)
2.2 大鼠肺组织小气道WAt/Pbm 测定结果
结果采用M(P25,P75)描述,COPD模型组为95.45(66.88,119.03)明显高于对照组的58.09(50.76,78.47)(P<0.05,n=60)。
2.3 成纤维细胞培养及鉴定
纯化后的成纤维细胞镜下可见大部分呈梭形或纺锤状,少部分呈多边形。用细胞免疫组化法,经波形蛋白化学染色后,镜下观察显示胞质呈棕色,波形蛋白鉴定呈阳性(图3)。
2.4 Real time PCR检测成纤维细胞HSG 和βcatenin基因表达(表1)
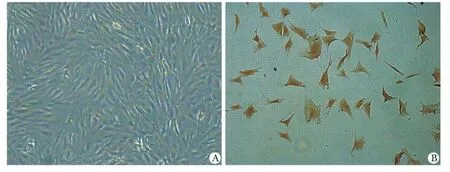
图3 纯化后成纤维细胞与波形蛋白鉴定Fig3 The purified airway fibroblasts(A)(×100);vimentin positive identification(B)(×400)
表1 HSG 和β-catenin mRNA 相对表达量Table1 HSG and β-catenin mRNA relative abundance(±s,n=25)

表1 HSG 和β-catenin mRNA 相对表达量Table1 HSG and β-catenin mRNA relative abundance(±s,n=25)
*P<0.05,**P<0.01 compared with the control group.
group HSG/β-actin β-catenin/β-actin control 0.37±0.02 0.12±0.02 COPD 0.23±0.02* 0.45±0.02**
2.5 Western blot检测蛋白表达(图4,表2)

图4 蛋白免疫印迹检测小气道成纤维蛋白表达Fig4 Western blot assay for protein expression in small airway fibroblasts
表2 蛋白半定量分析Table2 Protein semiquantitative analysis(±s,n=3)

表2 蛋白半定量分析Table2 Protein semiquantitative analysis(±s,n=3)
*P<0.05,**P<0.01 compared with the control group.
group HSG/GAPDH β-catenin/Lamin B1 P-GSK-3β/GAPDH control 0.81±0.04 0.45±0.12 0.13±0.01 COPD 0.38±0.11* 0.73±0.12* 0.45±0.04**
2.6 ELISA 检测TGF-β1、MMP-9表达变化(表3)
表3 酶联免疫法蛋白定量分析Table3 Enzyme-linked immunoassay protein quantitative analysis(±s,n=25)

表3 酶联免疫法蛋白定量分析Table3 Enzyme-linked immunoassay protein quantitative analysis(±s,n=25)
*P<0.05,**P<0.01 compared with the control group.
group TGF-β1/(pg/mL) MMP-9/(ng/mL)control 36.76±3.53 2.44±0.27 COPD 44.94±2.95* 4.04±0.31**
2.7 HSG、β-catenin mRNA表达与TGF-β1、MMP-9细胞因子分泌相关性分析
HSG mRNA与β-catenin mRNA呈负相关(P<0.05),与TGF-β1 呈负相关(P<0.05),与MMP-9呈负相关(P<0.05)。
3 讨论
气道重建是COPD 发病的关键,在气道重建过程中成纤维细胞增殖,不断分泌基质胶原,后者进行性集聚并逐渐取代正常的气道组织结构,严重影响肺通气和换气功能,最终导致肺功能持续性损害。本实验表明COPD组气道内有大量的炎性细胞浸润,管腔狭窄伴小气道壁纤维结缔组织增生。代表小气道增厚的指标WAt/Pbm 在模型组也明显升高。研究气道成纤维细胞增殖的细胞内信号传导通路对揭示COPD 发病机制及改善治疗效果具有重要意义。
众多细胞因子及蛋白酶与气道重建紧密相关,尤以TGF-β1 和MMP-9 最具代表性。TGF-β1 广泛分布于气道内,是最重要的致纤维化因子。作为经典WNT通路靶基因MMP-9是降解胶原的主要酶类,它由肺结构细胞及炎症细胞共同产生,能降解蛋白多糖、促进气道纤维化参与气道重建[8]。本结果也表明,COPD模型组成纤维细胞因子TGF-β1、MMP-9表达均显著高于对照组。
本实验室发现COPD模型组HSG mRNA 和蛋白表达均显著低于对照组。Wnt/β-catenin通路是目前公认的调节慢阻肺气道重建的重要信号传导通路,其组份异常与肺纤维化、特发性肺动脉高压、慢阻肺的发生发展密切相关。笔者发现在COPD模型组成纤维细胞中随着HSG mRNA 下调,Wnt 通路上关键基因β-catenin mRNA表达上调。COPD组成纤维细胞中细胞核β-catenin蛋白表达高于对照组,通路上另外一个关键的磷酸化蛋白P-GSK-3β 也在COPD组中表达升高。提示正是由于HSG 基因在COPD 成纤维细胞中表达下调导致稳态被打破,Wnt/β-catenin通路被异常激活,通路上失去活性的P-GSK-3β 逐渐增多,无法磷酸化β-catenin,使得β-catenin逃离“降解复合体”,进而大量蓄积于细胞浆内,达到一定浓度最终向细胞核内转移。核内的β-catenin 与TCF/LEF 转录复合体结合,最终激活下游靶基因如TGF-β1 和MMP-9 等的转录,从而引发下游一系列异常生物学事件。本结果提示HSG mRNA 与β-catenin mRNA 及TGF-β1、MMP-9表达量均存在线性负相关。
综上所述,HSG 抑制气道成纤维细胞的增殖而参与气道重建,其机制可能是通过调控Wnt/β-catenin通路,下调TGF-β1 和MMP-9 蛋白实现的。促进HSG表达或抑制Wnt/β-catenin 激活可能成为干预气道重建的突破点。
[1]Mitzner W.Emphysema-a disease of small airways or lung parenchyma[J].N Engl J Med,2011,365:1637-1639.
[2]葛正行,李波,周洵,等.rHSG 基因调控COPD大鼠气道成纤维细胞增殖凋亡[J].基础医学与临床,2013,33:1235-1241.
[3]申永春,万春,文富强.Wnt/β-catenin信号通路在气道炎症性疾病中的研究进展[J].临床肺科杂志,2013,18:317-318.
[4]宋一平,崔德健.慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究[J].中华结核和呼吸杂志,2001,24:283-287.
[5]Wang Y,Xue C,Dong F,et al.Hydroxysafflor Yellow A Attenuates Small Airway Remodeling in a Rat Model of Chronic Obstructive Pulmonary Disease[J].Biol Pharmac Bull,2014,37:1591-1598.
[6]葛正行,周洵,高瑞,等.rHSG 对COPD大鼠小气道阻力及成纤维细胞TGF-β1表达的影响[J].基础医学与临床,2014,34:1482-1485.
[7]徐丽华,刘春雷,常玉梅,等.双标准曲线相对定量PCR 试验原理与方法[J].生物技术通报,2011,1:70-75.
[8]Araujo BB,Dolhnikoff M,Silva LFF,et al.Extracellular matrix components and regulators in the airway smooth muscle in asthma[J].Eur Respir J,2008,32:61-69.
