虫草素增强顺铂诱导的食管癌细胞系Eca109凋亡
2015-05-11王聪懿吴庆琛
罗 骏,王聪懿,吴庆琛
(重庆医科大学附属第一医院 胸心外科,重庆400010)
中国是世界上食管癌高发地区之一,食管癌最常见的类型为鳞状细胞癌[1]。顺铂是临床治疗食管癌的常用药物,但常常会出现耐药现象,因此寻找低毒、高效的抗食管肿瘤药物成为目前研究的热点之一。虫草素是从真菌蛹虫草中分离出来的核苷类抗生素,其具有抗肿瘤、免疫调节、消炎、抗菌,抗病毒等多种生理功效[2-4]。核因子NF-κB 存在于多种细胞通路中,在肿瘤化疗过程中可以被激活,越来越多的证据表明其持续活化与肿瘤细胞耐药的发生和发展密切相关[5-7],据报道虫草素具有抑制细胞核因子NF-κB 活性的功能[8-9],可以推测虫草素可能增强顺铂对食管癌细胞Eca109的化疗敏感性。为此进一步研究了虫草素和顺铂单独或联合应用对Eca109细胞的作用及其对NF-κB 信号通路的影响,为虫草素作为辅助药物治疗食管癌和解决肿瘤耐药问题提供一定的理论依据与思路。
1 材料与方法
1.1 材料与试剂
虫草素(中国食品药品鉴定研究所);顺铂(齐鲁制药有限公司);四甲基偶氮唑盐(MTS)(Promega 公司);食管癌细胞系Eca109(重庆医科大学分子与肿瘤实验室馈赠);兔抗人NF-κB P65、Histone H3(Cell Signaling 公司);TransAMTMNF-κB P65 活性检测试剂盒和核蛋白提取试剂盒(Active-Motif 公司);兔抗人Bcl-2、Bax 和β-actin(Bioword公司);BCA蛋白浓度测定试剂盒、HRP 标记山羊抗兔IgG、细胞裂解液、PMSF、SDS-PAGE 凝胶配制试剂盒、5X的SDS-PAGE 蛋白上样缓冲液和Hoechest 33258(江苏碧云天生物技术研究所);ECL 发光试剂盒(Thermo Scientific 公司)。
1.2 方法
1.2.1 细胞培养:Eca109细胞在含10%胎牛血清的RPMI 1640 培养液中,37℃,5% CO2、饱和湿度下常规培养,待细胞汇合度达到80%以上时,0.25%胰蛋白酶消化传代,取对数生长期的细胞进行实验。
1.2.2 MTS法检测虫草素和顺铂对Eca109细胞的增殖抑制率:取对数生长期细胞,消化后调整细胞浓度为8×104/mL,接种于96 孔培养板,每孔加入细胞悬液90 μL,于37℃、5% CO2培养箱中培养,待细胞贴壁良好后加药处理。阴性对照组加入培养基10 μL,溶剂对照组加0.9%氯化钠溶液10 μL,空白对照不加细胞只加培养基100 μL。虫草素处理浓度分别为35、70、105、140 和175 μg/mL,顺铂处理浓度分别为0.4、0.8、1.6、3.2和6.4 μg/mL,联合处理组加入虫草素(70 μg/mL)和顺铂(0.8 μg/mL),每组各设3个复孔。联合组中虫草素浓度与顺铂浓度是通过MTS 检测细胞增殖筛选得到的,且对细胞作用的效果接近。24 h后取出培养板,进行MTS 检测。每孔加入MTS 溶液20 μL,孵育2 h后,用酶标仪于490 nm 处测出各孔吸光度(A)值。细胞增殖抑制率=(阴性对照组A值一实验组A值)/(阴性对照组A值-空白对照组A值)×100%。
1.2.3 Hoechst 33258 染色法检测细胞凋亡:实验分对照组,单用顺铂组(0.8 μg/mL),单用虫草素组(70 μg/mL)和联合用药组(顺铂0.8 μg/mL+虫草素70 μg/mL)。待细胞贴壁后加药处理,然后再继续培养48 h,PBS 洗1次,加入细胞固定液室温固定15 min,PBS 洗2次,加入Hoechst 33258,37℃染色30 min,封片,荧光显微镜下观察细胞核形态。
1.2.4 流式细胞术检测细胞凋亡:分组处理24 h后,用预冷PBS 洗涤3次,胰蛋白酶消化后,收集细胞于离心管中,PBS 洗涤3次,93×g,离心5 min,然后将细胞悬液置于1 mL EP 管中,送重庆医科大学生命科学院,采用流式细胞术annexin Ⅴ-FITC/PIC双染法检测细胞凋亡率。
1.2.5 Western blot 法检测Eca109细胞核内NF-κB P65 及凋亡相关蛋白Bax、Bcl-2表达:收集各分组细胞,提取细胞总蛋白及核蛋白。用BCA 比色法测蛋白浓度,将蛋白质样品与上样缓冲液混合煮沸5 min,行SDS-PAGE后,电转移至PVDF膜,5%脱脂奶粉封闭2 h,4℃下与一抗孵育过夜,以TBST 漂洗后加入二抗常温孵育2 h,洗膜后用显色剂ECL 试剂显色、曝光。
1.2.5 ELISA法检测Eca109细胞核内NF-κB P65与DNA 结合活性:分组处理24 h 收集各组细胞,提取细胞核蛋白,应用TransAMTMNF-κB P65 活性检测试剂盒测定NF-κB P65表达量。
1.3 统计学分析
采用SPSS 17.0 软件对所得数据进行统计处理,数据以均值±标准差(±s)表示。多组间比较采用单因素方差分析,两两比较采用配对t 检验。
2 结果
2.1 虫草素和顺铂对Eca109细胞的增殖影响
虫草素和顺铂均能呈浓度依赖性抑制Eca109细胞的增殖;虫草素与顺铂联合应用使顺铂对Eca109细胞的抑制率由29.3%增加至70.41%(P<0.05),增强了顺铂对Eca109的敏感性(表1)。
表1 不同浓度的顺铂或/和虫草素对Eca109 增殖的影响Table1 The effect on cell proliferation of Eca109 cell by different treatment concentration of cordycepin or/and cisplatin(±s,%,n=3)
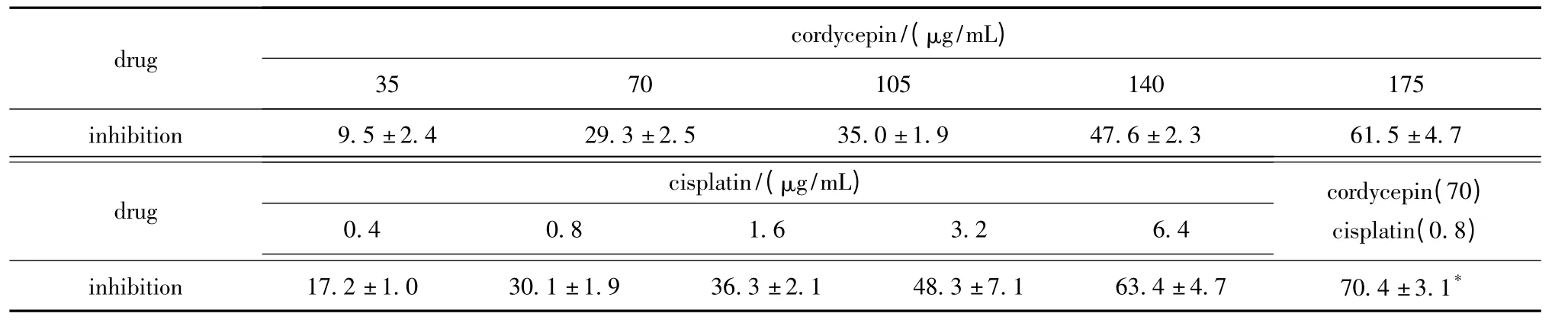
表1 不同浓度的顺铂或/和虫草素对Eca109 增殖的影响Table1 The effect on cell proliferation of Eca109 cell by different treatment concentration of cordycepin or/and cisplatin(±s,%,n=3)
*P<0.05 compared with cisplatin or cordycepin alone group.
drug cordycepin/(μg/mL)35 70 105 140 175 inhibition 9.5±2.4 29.3±2.5 35.0±1.9 47.6±2.3 61.5±4.7 drug cisplatin/(μg/mL)0.4 0.8 1.6 3.2 6.4 cordycepin(70)cisplatin(0.8)inhibition 17.2±1.0 30.1±1.9 36.3±2.148.3±7.1 63.4±4.7 70.4±3.1*
2.2 Hoechst 33258 染色法检测虫草素和顺铂对Eca109细胞凋亡
对照组的Eca109细胞发出较弱的均匀的蓝色荧光,细胞核无明显的形态学改变(图1A 箭头所示);而实验组凋亡细胞出现核浓染、碎裂,发出较强的蓝色荧光(图1B、1C、1D 箭头所示)。虫草素与顺铂联用出现凋亡像的细胞数量明显多于二者单用(图1)。

图1 Hoechst 33258 染色法检测虫草素和顺铂对细胞凋亡的影响Fig1 Hochest33258 staining to observe each cell apoptosis by using cisplatin and cordycepin(×200)
2.3 流式细胞术检测虫草素和顺铂对Eca109细胞凋亡的影响
对照组、顺铂单药组、虫草素单药组和联合用药组的凋亡率分别为2.75%±0.12%、14.50%±1.83%、13.80%±1.73%和41.15%±2.65%。而联合组显著高于各药单用组和对照组(P<0.05),表明虫草素能够增强顺铂对Eca109的凋亡诱导效应(图2)。

图2 流式细胞术测得各组细胞的凋亡率Fig2 Each group of cells apoptosis rate by FCM
2.4 虫草素和顺铂对Eca109细胞核内NF-κB P65表达的影响
虫草素能够抑制Eca109细胞核NF-κB P65 蛋白的表达,而顺铂则引起胞核NF-κB P65 蛋白表达和活性升高;二者联合给药后NF-κB P65 蛋白表达和活性显著降低(P<0.05)(图3,表2)。

图3 Western blot(A)和ELISA (B)检测Eca109细胞核内NF-κB P65表达影响Fig3 Expression of NF-κB P65 in Eca109 nucleus by Western blot(A)and ELISA(B)
表2 Eca109细胞核内NF-κB P65表达量Table2 NF-κB P65 protein expression in Eca109 nucleus(±s,n=3)
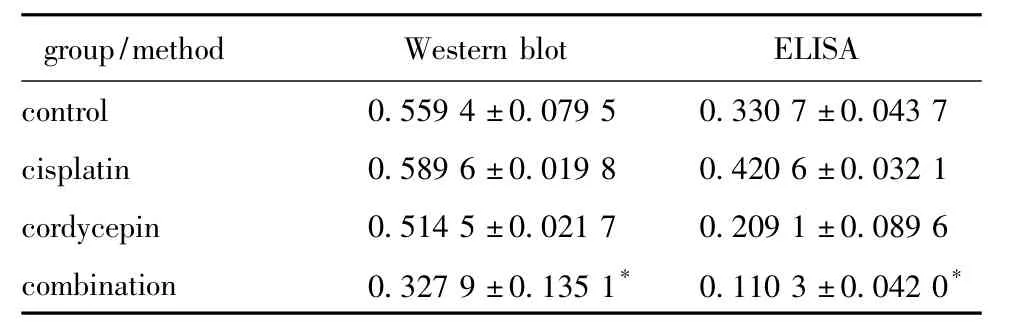
表2 Eca109细胞核内NF-κB P65表达量Table2 NF-κB P65 protein expression in Eca109 nucleus(±s,n=3)
*P<0.05 compared with cisplatin,cordycepin and control group.
group/method Western blot ELISA control 0.559 4±0.079 5 0.330 7±0.043 7 cisplatin 0.589 6±0.019 8 0.420 6±0.032 1 cordycepin 0.514 5±0.021 7 0.209 1±0.089 6 combination 0.327 9±0.135 1* 0.110 3±0.042 0*
2.5 虫草素和顺铂对Eca109细胞凋亡相关蛋白Bcl-2、Bax表达的影响
与对照组相比,虫草素和顺铂均能抑制抗凋亡蛋白Bcl-2的表达,而上调促凋亡蛋白Bax的表达,二者联合给药后Bcl-2的表达显著降低(P<0.05),而Bax表达显著升高(P<0.05)(图4,表3)。
表3 各组细胞中Bax、Bcl-2 蛋白的表达量Table3 Expression index of Bax,Bcl-2 protein in groups of cells(±s,n=3)

表3 各组细胞中Bax、Bcl-2 蛋白的表达量Table3 Expression index of Bax,Bcl-2 protein in groups of cells(±s,n=3)
*P<0.05 compared with cisplatin,cordycepin and control group.
group/protein Bcl-2 Bax control 0.697 1±0.017 9 0.335 4±0.104 1 cisplatin 0.560 3±0.018 6 0.509 8±0.180 4 cordycepin 0.580 9±0.167 7 0.561 0±0.078 0 combination 0.378 8±0.098 1* 0.753 1±0.310 4*

图4 各组细胞中Bax、Bcl-2 蛋白的表达水平Fig4 Expression of Bax、Bcl-2 protein in groups of cells
3 讨论
顺铂是治疗食管癌常用的化疗药物,然而其容易产生耐药和不良反应较大使患者难以承受。NF-κB作为一种特异性核转录因子与肿瘤的增殖,抗凋亡,转移和浸润中起着重要作用[10-11]。在静止细胞中,胞浆中的NF-κB P65 和其抑制性因子IκBα 结合,使NF-κB P65 无法进入核内,其转录功能受到抑制。当细胞受活化刺激后,IκBα 末端的丝氨酸残基发生磷酸化和泛素化,复合物发生解离,释放出游离的NF-κB P65 得以进入细胞核,与靶基因上的κB序列特异结合,启动转录调控。
近年来许多研究发现肿瘤细胞对顺铂产生耐药的机制可能与NF-κB的活化密切相关[5-7]。与顺铂敏感的细胞卵巢癌细胞A2780 相比,顺铂耐药的卵巢癌细胞C200的NF-κB P65 活性增高[12]。相关文献报道[7-8]虫草素在体外能够抑制细胞核因子NF-κB表达,因此可以推测虫草素可能增强顺铂对食管癌细胞Eca109的凋亡诱导作用。
本实验发现虫草素与顺铂联合应用使顺铂对Eca109细胞的抑制率显著增加,增强了顺铂对Eca109的敏感性;Hoechst 33258 染色法及流式细胞术结果均显示,联合用药组显著高于各单用药组,表明虫草素能够增强顺铂对Eca109的凋亡诱导效应。然后对虫草素增强顺铂对Eca109的凋亡诱导效应的机制进行了研究。研究表明虫草素能够抑制Eca109细胞核NF-κB P65 蛋白的表达及其与DNA结合活性,而顺铂则引起胞核NF-κB P65 蛋白表达和活性升高,二者联合给药后NF-κB P65 蛋白表达和活性显著降低。说明顺铂用于肿瘤细胞后可以诱导细胞凋亡,同时也可以不同程度的激活NF-κB,这可能与顺铂的耐药有关,而虫草素却能够抑制NF-κB的激活,二者联合给药后增强顺铂对Eca109的凋亡诱导效应。
Bcl-2和Bax是NF-κB 通路的下游信号分子,与虫草素和顺铂单用相比,联合用药后Bcl-2的表达显著降低,而Bax表达显著升高。凋亡相关蛋白Bcl-2和Bax 属于Bcl-2 蛋白家族成员,Bcl-2与Bax的异常表达与肿瘤的发生发展密切相关[13-14]。
综上所述,实验证实了虫草素能够增强顺铂对Eca109的凋亡诱导效应,其作用机制可能与虫草素抑制NF-κB 途径,调节下游信号分子Bcl-2和Bax的表达有关,这为虫草素单独或联合其他药物治疗食管癌提供了一定的实验依据。然而虫草素是如何抑制NF-κB 信号分子的以及在体内抗肿瘤效果如何,尚不清楚,有待进一步的研究和探讨。
[1]陈孝平,汪建平.外科学[M].第8版,北京人民卫生出版社,2013,3:349-357.
[2]Yue K,Ye M,Zhou Z,et al.The genus Cordyceps:a chemical and pharmacological review[J].J Pharm Pharmacol,2013,65:474-493.
[3]Paterson RR.Cordyceps:a traditional Chinese medicine and another fungal therapeuticbiofactory[J]Phytochemistry,2008,69:1469-1495.
[4]蔡友华,刘学铭.虫草素的研究于开发进展[J].中草药,2007,38:1269-1272.
[5]Li F,Sethi G.Targeting transcription factor NF-κB to overcome chemoresistance and radioresistance in cancer therapy[J].Biochim Biophys Acta,2010,1805:167-180.
[6]He HN,Wang X,Zheng XL,et al.Concurrent blockade of the NF-κB and Akt pathways potently sensitizes cancer cells to chemotherapeutic-induced cytotoxicity[J].Cancer Lett,2010,295:38-43.
[7]Lee CH,Jeon YT,Kim SH,et al.NF-kappaB as a potential molecular target for cancer Therapy[J].Biofactors,2007,29:19-35.
[8]Kadomatsu M,Nakajima S,Kato H,et al.Cordycepin as a sensitizer to tumour necrosis factor (TNF)-α-induced apoptosis through eukaryotic translation initiation factor 2α(eIF2α)-and mammalian target of rapamycin complex 1(mTORC1)-mediated inhibition of nuclear factor (NF)-ΚB[J].Clin Exp Immunol,2012,168:325-332.
[9]Lee YR,Noh EM,Jeong EY,et al.Cordycepin inhibits UVB-induced matrix metalloproteinase expression by suppressing the NF-kappaB pathway in human dermal fibroblasts[J].Exp Mol Med,2009,41:548-554.
[10]Ouk S,Liou ML,Liou HC.Direct Rel/NF-κB inhibitors:structural basis for mechanism of action[J].Future Med Chem,2009,1:1683-1707.
[11]Naugler WE,Karin M.NF-kappaB and cancer-identifying targets and mechanisms[J].Curr Opin Genet Dev,2008,18:19-26.
[12]Solomon LA,Ali S,Banerjee S,et al.Sensitization of ovarian cancer cells to cisplatin by genistein:the role of NF-kappaB[J].J Ovarian Res,2008,1-9.
[13]Tomek M,Akiyama T,Dass CR.Role of Bcl-2 in tumour cell survival and implications for pharmacotherapy[J].J Pharm Pharmacol,2012,64:1695-1702.
[14]Dewson G,Kluck RM.Mechanisms by which Bak and Bax permeabilise mitochondria during apoptosis[J].J Cell Sci,2009,122:2801-2808.
