小鼠肝移植模型中调节性T细胞的数量和表型改变
2015-05-11陈国锋蔡国军李国锋王介川郑树森
陈国锋,蔡国军,李国锋,王介川,郑树森
(浙江大学 医学院1.附属第一医院 肝胆胰外科;2.附属第二医院 滨江院区 普外科,浙江 杭州310003;3.杭州市萧山区第四人民医院 普外科,浙江 杭州311225)
中国是乙型肝炎的高发区,目前全国已有超过3,000万的乙型肝炎患者。相当一部分乙肝患者发展为肝硬化及肝癌[1]。肝移植一直是终末期肝病患者的唯一治疗途径[2]。由于同种异体免疫排斥反应的存在,研究如何诱导和维持免疫耐受一直是器官移植领域的热点和难点[3-4]。
越来越多的实验证实,具有免疫调节作用的CD4+CD25+Foxp3+调节性T细胞(Treg)能够下调宿主内对移植物的排斥反应,延长器官移植物的存活时间,在免疫耐受形成的过程中也发挥重要作用[5]。免疫耐受与肝移植术后宿主内调节性T细胞的数量及表型的变化密切相关。但很多文献也没有阐述该变化的相关性。本实验旨在探究小鼠肝移植术后,移植物的排斥反应和移植物内调节性T细胞的数量和表型随时间变化的规律,为揭示免疫耐受的机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物:清洁级雄性C57Bl/6 小鼠16只,Balb/c小鼠48只,8~12周龄,体质量24~29 g。〔浙江省实验动物中心,许可证:SCXK(浙)2014-0001〕。
1.1.2 主要试剂:肝脏保存液(UW 液),反转录酶(Sigema 公司),SYBN 实时荧光定量试剂盒(Takara公司),抗CD3、B220 和Foxp3 单克隆抗体(Abcam 公司),抗CLAT-4 FITC 荧光抗体(eBioscience 公司)。
1.2 方法
1.2.1 小鼠肝移植模型建立:供肝植入时,用“套袖法”完成门静脉、肝下下腔静脉重建,用支架法重建胆管。
1.2.2 动物分组:实验组行异基因肝移植,C57Bl/6-Balb/c 肝移植;对照组行同基因肝移植,Balb/c-Balb/c肝移植。术后3、7、14 和28 d 分别取肝脏固定或液氮保存,部分用于提取分离调节性T细胞表型鉴定。
1.2.3 HE染色及排斥活性指数评定:将肝脏标本进行HE染色。按照Banff 评分标准(表1)对不同时间点肝脏组织切片进行排斥活性指数的评定。RAI 0~2 分定为无排斥;3 分为不确定性改变;4~5分为轻度排斥(Ⅰ级);6~7 分为中度排斥(Ⅱ级);8~9 分为重度排斥(Ⅲ级)。
1.2.4 免疫组化染色:用抗CD3、B220 及Foxp3 单克隆抗体对肝脏切片标本行免疫组化染色,并高倍镜下计数阳性细胞数量。
1.2.5 实时荧光定量PCR检测Foxp3表达:Trizol提取肝脏组织总RNA,测定含量并计浓度,采用Oligo(dT)反转录法,将RNA 反转录为cDNA。用荧光定量PCR 试剂进行扩增40个循环,采用2-△△Ct法进行结果统计分析。
1.2.6 流式细胞术检测调节性T细胞表型改变:利用胶原蛋白酶IV 对小鼠肝脏进行消化,采用全自动免疫磁珠分选系统对肝脏内的Treg 进行分离提取,利用抗CLAT-4-FITC 抗体对Treg 进行染色后,经BD Laser Ⅱ型流式细胞仪检测。
1.3 统计学分析
实验所得数据应用SPSS 统计软件(V 16.0)进行处理,数据以均数±标准差(±s)表示,组间差异采用单因素方差分析,两两比较采用t 检验。
2 结果
2.1 术后移植肝的排斥反应
同基因组小鼠移植肝脏病理切片可见肝内炎性反应较轻,术后第3 天达到高峰,至第7天左右基本恢复正常。异基因组的小鼠则发生了明显的急性排斥反应:术后第7天排斥反应达到高峰,后逐渐消退,至28天,基本恢复至正常(图1)。对两组移植肝的标本进行病理学评分,结果在移植后早期(移植后3 d),两组移植肝内均有一定量的炎性细胞浸润且数量相当,随后,异基因移植肝总的浸润细胞显著增多,并在移植后7 d 达到高峰(表2)。

表1 肝移植后急性排斥反应的排斥活性指数(RAI)Table1 Rejection activity index(RAI)of acute rejection after liver transplantation
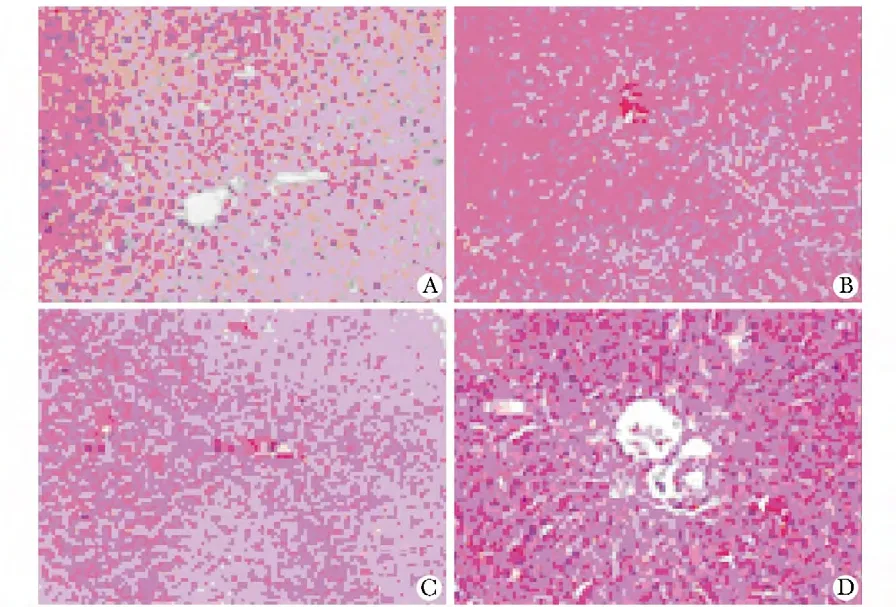
图1 移植肝内组织切片Fig1 Post-operative rejection in liver graft(×200)

表2 同、异基因组肝移植术后病理学排斥评分Table2 RAI in isogenic and allogeneic graft after liver transplantation(RAI)
2.2 移植物内浸润淋巴细胞的类型
T 淋巴细胞是异基因移植肝内浸润的主要淋巴细胞类型(图2)。
2.2 移植肝内Foxp3 阳性T细胞的改变
移植术后不同时间点的异基因移植肝内Foxp3 阳性调节性T细胞主要分布于移植肝脏的汇管区(图3A,B);术后第3 天Foxp3 阳性细胞开始增多,第7~14 天逐渐达到高峰期,第14 天后逐渐下降并趋于稳定维持在相对较高的水平。同基因组移植肝内则未见明显Foxp3 阳性调节性T细胞的改变(图3C)。

图2 移植肝内浸润细胞免疫组化染色Fig2 Infiltrating lymphocytes in liver graft(×400)

图3 移植肝内调节性T细胞表达增加Fig3 Alteration of Foxp3-positive T cells count and Foxp3-mRNA level in liver graft (×400)
异基因组移植肝内Foxp3 mRNA表达水平在术后逐渐升高,第14 天达到高峰,随后下降并稳定维持存在。同基因组移植物内Foxp3 mRNA表达则无明显改变(图3D)。
2.4 调节性T细胞表面CTLA-4的改变
移植术后14 d,异基因移植组的移植肝、脾和移植物引流淋巴结中的Tregs 比例均较同基因移植组明显升高(图4)。
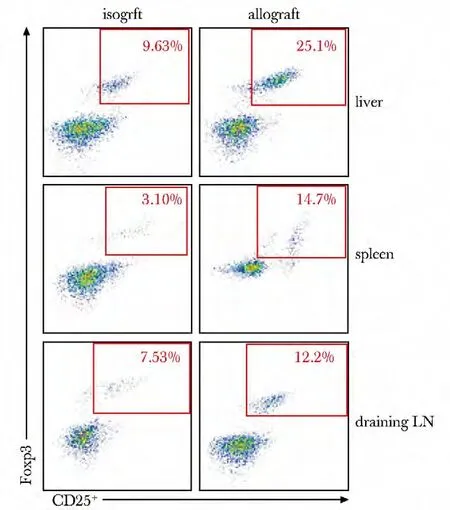
图4 同、异基因移植组术后14 天的移植肝、脾脏和引流淋巴结中Tregs的比例Fig4 Ratios of Tregs cells in graft liver,spleen,drainage lymph nodes in Allogeneic graft and isogeneic graft
异基因移植肝内浸润的调节性T细胞表面CTLA-4表达显著高于同基因组,且在移植后移植保持较高表达水平(P<0.05)(图5)。
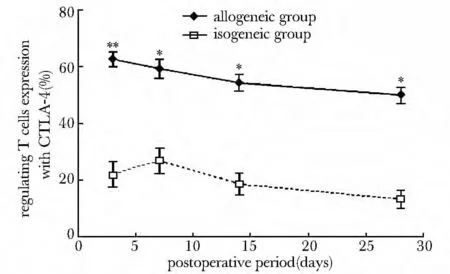
图5 调节性T细胞表面CTLA-4表达增加Fig5 CTLA-4 Expression alteration on regulating T cells
3 讨论
调节性T细胞在移植免疫排斥反应中发挥着作用,同时也参与到移植物免疫耐受的形成[6]。临床及基础研究均发现CD4+CD25+Treg 细胞能够诱导移植免疫耐受的形成[7-8]。Foxp3 也被认为是调节性T细胞(Treg)的重要标志性分子[9]。
本研究在同基因和异基因肝移植模型术后,两组的炎性反应的时间及程度的不同;术后浸润的炎性细胞主要为T 淋巴细胞,其中Foxp3 阳性的调节性T细胞数量及Foxp3 mRNA的变化也与移植物中浸润淋巴细胞的变化一致;流式细胞术分析可见调节性T细胞表面的CTLA-4 也随着Foxp3的改变而出现相应变化。
上述免疫排斥反应随时间的变化规律与Foxp3 mRNA的变化规律及Foxp3 阳性细胞数量的变化规律互相吻合,这也说明了异基因肝移植术后发生了针对同种异体抗原的急性免疫排斥反应,并在第7天后逐渐达到高峰,与此同时Foxp3 mRNA的表达逐渐上调,Foxp3表达量上升,促使调节性T细胞发育和活化;在术后第14 天左右,调节性T细胞的数量逐渐达到高峰,随着其负向调节功能的增强,免疫排斥反应开始逐渐减弱,浸润的淋巴细胞开始逐渐下降;至术后28 天左右,移植物内浸润的淋巴细胞明显减少,排斥活性指数下降至正常提示移植肝达到免疫耐受,此后可见少量调节性T细胞持续存在于移植肝汇管区,以维持免疫耐受的稳态。
CTLA-4 与B7 分子结合后可诱导T细胞无反应,参与免疫反应的负调节[10]。我们的研究发现移植术后随着Foxp3表达的增高,调节性T细胞表面的CTLA-4的表达也达到高峰提示调节性T细胞功能的活化;此后,调节性T细胞表面的CTLA-4则稳定存在,也提示在耐受期,调节性T细胞仍然发挥作用,维持免疫耐受状态的稳定。
本实验证实异基因肝移植术后,肝脏内的调节性T细胞参与了机体对移植物排斥反应的调节,并最终导致移植肝免疫耐受,为下一步揭示移植物内调节性T细胞通过何种机制诱导移植物耐受提供了很好的研究基础;同时也为将调节性T细胞作为一种有效的免疫调节工具应用于器官移植领域提供了理论依据。
[1]Eksteen B.Infections and the liver[J].Dig Dis,2011,29:184-190.
[2]Yuen MF,Lai CL.Treatment of chronic hepatitis B:Evolution over two decades [J].J Gastroenterol Hepatol,2011,26:138-143.
[3]Tan HH,Martin P.Management of end-stage liver disease in chronic hepatitis B[J].Clin Liver Dis,2010,14:477-493.
[4]翟晓强,曾甫清,CD4+CD25+Treg 细胞在移植免疫耐受的研究进展[J].临床外科杂志,2009,1:56-58.
[5]Sánchez-Fueyo A,Strom TB.Immunologic basis of graft rejection and tolerance following transplantation of liver or other solid organs[J].Gastroenterology,2011,140:51-64.
[6]Alex Bishop G,Bertolino PD,Bowen DG,et al.Tolerance in liver transplantation[J].Best Pract Res Clin Gastroenterol,2012,26:73-84.
[7]杨一芬,陈远林,杨静芬.CD4+CD25+Foxp3+Treg 调节性细胞与移植肾长期存活的关系[J].广东医学,2011,1:66-69.
[8]李健,黄赤兵,郑峻松.应用CD4+CD25+Treg 细胞诱导大鼠肾移植免疫耐受的研究[J].重庆医学,2007,12:2396-2410.
[9]Schliesser U,Streitz M,Sawitzki B.Tregs:application for solid-organ transplantation.[J].Curr Opin Organ Transplant,2012,17:34-41.
[10]Agarwal A,Newell KA.The role of positive costimulatory molecules in transplantation and tolerance[J].Curr Opin Organ Transplant,2008,13:366-372.
