血管生成素及其突变体与核糖核酸酶抑制因子蛋白的相互作用
2015-05-11刘玉林陈俊霞
刘玉林,庄 翔,陈俊霞*
(重庆医科大学1.细胞生物学与遗传学教研室;2.分子医学与肿瘤研究中心,重庆400016)
核糖核酸酶抑制因子(ribonuclease inhibitor,RI)是一种重要的胞质内酸性多功能蛋白,可能参与调节细胞内的RNA 水平,能与血管生长因子紧密结合,强烈抑制血管生长[1]。血管生成素(angiogenin,ANG)是一个强有力的血管生成因子,在体内和体外均具有强烈的诱发血管生成的活性,能有效地诱导肿瘤血管新生和肿瘤细胞的增殖,并参与调控其他血管生成因子,具有核转位现象并且能促进核糖体RNA(rRNA)的转录。但是,RI 与ANG的相互作用机制少有报道,RI是否可能直接与体内ANG某一部位结合,从而阻断了肿瘤血管生成和细胞增殖的信号通路和核转位进程,进而抑制肿瘤的生长和转移也是未知。有研究者发现在多人种肌萎缩性侧索硬化症(amyotrophic lateralizing sclerosis,ALS)患者中ANG 基因发生自然突变,提示ANG 突变而导致的成熟蛋白质功能丧失可能与ALS 发病密切相关[2-3]。因此,我们针对ANG的活性位点(Active site)第37位和第138位,即编码蛋白质的第13位和第114位(前24位为信号肽)进行突变,利用蛋白相互作用研究方法初步确定两者是否存在相互作用,为后续研究RI 与ANG的相互作用机制打下基础。
1 材料与方法
1.1 材料和试剂
人膀胱癌BIU-87 细胞(南京凯基生物技术有限公司);质粒pcDNA3.1-myc-RI、pCMV-3×flag-ANG、pGEX-4T-RI(重庆医科大学细胞生物学与遗传学教研室构建保存);RPMI1640 培养基和优质胎牛血清((TBD 公司);转染试剂盒Lipofectamine 2000(Invitrogen 公司);异丙基硫代半乳糖苷(IPTG)(Sigma公司);质粒抽提试剂盒(OMEGA 公司);限制性内切酶和T4 连接酶(Takara 公司);鼠抗人GST 抗体、FLAG 抗体和Protein A/G agarose(碧云天生物技术公司);氨苄青霉素(Amp)和卡那青霉素(Kana)(上海生工生物有限公司);Sepharose 4B gel(GE healthcare 公司);山羊抗小鼠、山羊抗兔二抗和Alexa Fluor 594 标记山羊抗兔IgG、Alexa Fluor 488 标记山羊抗小鼠IgG(北京中杉金桥公司)。
1.2 方法
1.2.1 pCMV-3×flag-ANGH13R和pCMV-3×flag-ANGH114R突变体质粒的构建:以pCMV-3×flag-ANG为模板用Pyrobest 聚合酶进行PCR 突变反应。pCMV-3×flag-ANGH13R突变引物序列:上游引物5'-CACACTTCCTGACCCAGCGCTATGATGCCAAACCAC AG-3' 下游引物5'-CTGTGGTTTGGCATCATAGCG CTGGGTCAGGAAGTGTG-3';pCMV-3×flag-ANGH114R
突变引物序列:上游引物5'-GAAAATGGCTTACCT GTCCGCTTGGATCAGTCAATTTTC-3'下游引物5'-G AAAATTGACTGATCCAAGCGGACAGGTAAGCCATT TTC-3'。PCR引物由上海生工生物公司合成,PCR产物经1%琼脂糖凝胶电泳检测,并对正确PCR 产物胶回收纯化。回收产物经DpnⅠ酶消化质粒模板后转化DH5α 感受态接种于含氨苄抗生素的LB 平板上,次日随机挑取单克隆接种于LB 液体培养基(含Amp)中,37℃,300 r/min 培养12~16 h,甘油保菌,提取质粒,将提取质粒酶切鉴定,并送上海生工测序。
1.2.2 细胞培养:BIU-87 细胞用内含10%优级胎牛血清的RPMI 640 培养基培养于37℃、5% CO2的细胞培养箱中。
1.2.3 荧光共定位:人膀胱癌BIU-87 细胞接种于含盖玻片的6孔板中,待长到80%左右时共转染pcDNA3.1-myc-RI 和 pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R,48 h后取出6孔板,PBS 洗细胞3次,每次5 min;4% 多聚甲醛固定细胞30 min,PBS 洗3次,每次5 min;加适量0.1% Triton X-100 通透10 min,PBS 洗3次,每次5 min;3%BSA 封闭1 h,吸掉液体,加配制好的兔抗人RI 抗体和鼠抗人ANG 抗体,4℃静置过夜,次日用PBS 缓冲液洗细胞3次,每次10 min,用配制好的Alexa Fluor 594 标记山羊抗兔IgG 与Alexa Fluor 488 标记山羊抗小鼠IgG 滴加在细胞面,37℃避光孵育1 h,PBS 缓冲液洗细胞3次,每次10 min;加适量的DAPI避光静置孵育10 min,PBS 缓冲液洗细胞3次后70%甘油封片.共聚焦显微镜观察结果。
1.2.4 GST-RI融合蛋白的诱导表达及纯化:将pGEX-4T-RI 或pGEX-4T-1 质粒分别转化大肠杆菌BL21 菌株,挑取单菌落接种于LB(含Amp)培养基中,150 r/min、37℃摇床过夜,按1%的接种量转入2×YTA(含Amp)培养基中,37℃摇床培养3 h至A600≈0.6~0.8,分别加入终浓度为0.1 mmol/L的IPTG 诱导3 h.离心收集菌体,加入1 mL 预冷的PBS 重悬菌体,冰浴超声破碎(工作4 s,间歇6 s,超声时间10 min),离心收集上清,样品进行10%SDS-PAGE 分离后用考马斯亮蓝染色鉴定融合蛋白表达。证实融合蛋白有正确表达后,大量摇菌诱导融合蛋白表达,冰浴超声破碎菌体离心收集上清,按1 mL 上清加入10 μL的Glutathione sepharose 4B的比例于4℃孵育过夜,将混合液1 000×g 离心5 min,预冷PBS 洗涤3次,每次5 min,收集Glutathione sepharose 4B,用50 mmol/L Tris-HCl(pH =8.0)的还原型谷胱甘肽洗脱液洗脱珠子,1 000×g离心5 min,收集上清进行SDS-PAGE 分析,利用考马斯亮蓝染色法和蛋白印迹法检测纯化效果。
1.2.5 GST 融合蛋白沉降实验:人膀胱癌BIU-87细胞接种于细胞瓶,待增殖至80%汇合左右时按照脂质体Lipofectamine 2000 说明书进行操作,分别将pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R、pCMV-3×flag、pCMV-3×flag-ANG 转染BIU-87 细胞48 h后收集细胞,加入1 mL 预冷细胞裂解液,冰上裂解30 min,离心取上清。向上述蛋白中加入处理过的Glutathione sepharose 4B,4℃孵育过夜离心收集上清。将上清加入结合有GST-RI 或GST 蛋白的Glutathione sepharose 4B 中,4℃摇床孵育2 h,3 000 r/min离心,弃上清,预冷PBS 洗涤3次,每次1 min,小心吸弃上清,加,1×loading 缓冲液,100℃加热10 min,Western blot检测蛋白表达。
1.2.7 免疫共沉淀:人膀胱癌BIU-87 细胞接种于细胞瓶,将pcDNA3.1-myc-RI 或pcDNA3.1-myc 和pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R两质粒共转染,48 h后收获细胞,提取蛋白并加入2 μg的Myc 抗体,4℃孵育过夜,再加入充分重悬的protein A/G agarose,4℃孵育3 h,3 000 r/min离心5 min,收集琼脂糖珠抗原抗体复合物,PBS 洗涤沉淀5次,去除上清,加入1×SDS-PAGE 电泳上样缓冲液,混匀离心,100℃煮沸10 min,Western blot检测分析结果。
2 结果
2.1 pCMV-3×flag-ANGH13R 和pCMV-3×flag-ANGH114R突变体质粒的鉴定
双酶切电泳结果显示,约6 400 bp 处条带为pCMV-3×flag 质粒,约500 bp 处条带即为ANG 突变体,与PCR 结果吻合(图1)。测序结果分析也表明突变体质粒构建成功。

图1 pCMV-3×flag-ANGH13R和pCMV-3×flag-ANGH114R突变体质粒的酶切鉴定Fig1 The expressing plasmid pCMV-3×flag-ANGH13R and pCMV-3×flag-ANGH114R was verified by restriction double enzyme digestion(Hind Ⅲand BamHⅠ)
2.2 RI 和pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R蛋白在BIU-87 细胞中存在共定位
两突变体蛋白主要在胞质中表达,RI 蛋白的表达也主要位于细胞的胞质,两者融合后可观察到有黄色的区域出现,用DAPI 标染细胞系,可以发现RI 和pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R蛋白在BIU-87 细胞胞质有明显的颜色融合(图2)

图2 RI 与ANG 突变体蛋白在BIU-87 细胞中的共定位Fig2 The co-localization between RI and ANG mutant in BIU-87 cells (×400)
2.3 GST-RI融合蛋白的表达及纯化的鉴定
经sepharose 4B gel 纯化后的GST 和GST-RI融合蛋白分别在26和76 ku 处有特异性条带(图3)
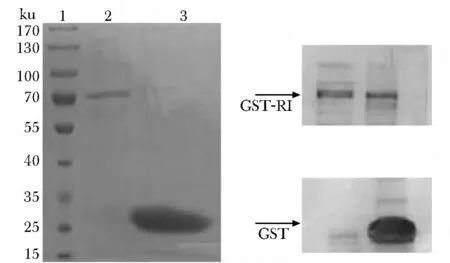
图3 GST 和GST-RI融合蛋白考马斯亮蓝染色及Western blot检测结果Fig3 The result of GST and GST-RI fusion protein coomassie brilliant blue staining and Western blot
2.4 GST pull down 结果
pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R和pCMV-3×flag-ANG 蛋白能与GST-RI融合蛋白结合并被沉降下来;pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R和pCMV-3×flag-ANG 蛋白在BIU-87 细胞内的表达也基本一致(图4)。
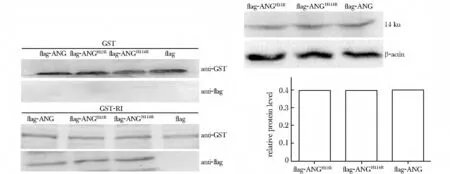
图4 RI 与ANG 及其突变体蛋白的GST-pull down 检测结果Fig4 Verification of interaction between RI and pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R by GST-pull down
2.5 免疫共沉淀证明RI 与ANG 突变体的相互作用
pcDNA3.1-myc-RI 和pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R共转染后,用anti-Flag 抗体于免疫复合物中可检测到ANG 突变体蛋白的存在(图5)。

图5 免疫共沉淀实验鉴定RI 与ANG 突变体蛋白间的相互作用Fig5 Verification of interaction between RI and pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R by co-immunoprecipitation assay
3 讨论
蛋白质-蛋白质相互作用(protein-protein interaction,PPI)在生命活动中扮演着重要的角色。ANG促血管生成和肿瘤细胞的增殖效应的发挥依赖于ANG 与其他蛋白的相互作用。已知的和ANG 相互作用的蛋白有很多,RI 便是其中之一[4]。RI 富含亮氨酸重复序列(LRRs),在含有该序列结构的蛋白中,很多都是通过该区域进行蛋白质间的相互作用。RI在膀胱癌细胞中过表达之后能显著抑制动物新生血管的生成[5-6],同时还能抑制RNAse 活性。实验中pCMV-3×flag-ANGH13R、pCMV-3×flag-ANGH114R两突变体与RI的相互作用和野生型的pCMV-3×flag-ANG 与RI的相互作用相比存在一定的差异(图4)。前期的实验研究发现过表达RI,ANG 在mRNA 转录水平和蛋白翻译水平上都存在表达的下降,并在一定程度上抑制了血管内皮细胞的增殖及迁移,并发现两者在人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)内存在结合[7]。过表达RI 可以抑制人膀胱癌T24 细胞的侵袭、转移及EMT 发生[8]。众所周知,肿瘤的侵袭和转移很大程度上依赖于肿瘤新生血管为其提供基础物质,而肿瘤血管的新生与ANG 之间存在很大关系,RI 抑制人膀胱癌T24细胞侵袭、转移及EMT的发生机制还未阐明,故通过RI 和ANG 突变体之间的相互作用进一步揭示膀胱癌在其发生发展中的生物学上的机制和关系。下调RI 体内可促进肿瘤生长和人膀胱癌BIU-87 细胞转移潜能,体外促进BIU-87 细胞的侵袭迁移能力[9],同时也能够明显的增加T24 细胞的侵袭转移及EMT的能力[10]。干扰ANG 能有效降低ANG的表达,显著抑制膀胱癌T24 细胞的增殖,调节凋亡关键蛋白的表达[11]。通过构建ANG 突变体研究RI 与ANG 突变体相互作用来进一步探索两者是通过怎样形式结合或者相互作用影响肿瘤的发生发展。后续的工作将围绕RI 与ANG 突变体相互作用在膀胱癌的发生发展中的生物学影响来进行,为下一步探索两者相互作用的分子机制奠定基础。
ANG 可以通过核转位和激活PI3K/AKT/mTOR信号通路[12]来刺激肿瘤的生长和发展,RI 与ANG突变体的相互作用可能会在一定程度上通过这两个方式来实现,因此,接下来将对其生物学方面进行研究,继续探讨RI 与ANG 相互作用的意义为肿瘤的发生发展提供理论依据,为肿瘤的治疗提供科学依据。
[1]Dickson KA,Kang DK,Kwon YS,et al.Ribonuclease inhibitor regulates neovascularization by human angiogenin[J].Biochemistry.2009,48:3804-3806.
[2]Del Bo R,Scarlato M,Ghezzi S,et al.Absence of angiogenic genes modification in Italian ALS patients[J].Neurob Aging,2006,29:314-316.
[3]Greenway M J,Andersen P M,Russ C,et a1.ANG mutations segregate with familial and‘sporadic’amyotrophic laterl sclerosis[J].Nat Genet,2006,38:411-413.
[4]Lee F S,Vallee B L.Structure and action of mammalian ribonuclease(angiogenin)inhibitor[J].Prog Nucleic Acid Res Mol Biol,1993,44:1-30.
[5]Gao J,Zhu J,Li H Y,et al.Small interfering RNA targeting integrin-linked kinase inhibited the growth and induced apoptosis in human bladder cancer cells[J].Int J Biochem Cell Biol,2011,43:1294-1304.
[6]Zhu J,Pan X Y,Zhang Z,et al.Downregulation of integrin-linked kinase inhibits epithelial-to-mesenchymal transition and metastasis in bladder cancer cells[J].Cell Signal,2012,24:1323-1332.
[7]李红彦,潘湘阳,姚雪,等.RI 基因真核表达载体的构建及其对人脐静脉内皮细胞的影响[J].第三军医大学学报,2012,34:1591-1595.
[8]Yao X,Li D,Xiong D M,ea tl.A novel role of ribonuclease inhibitor in regulation of epithelial-to-mesenchymal transition and ILK signaling pathway in bladder cancer cells[J].Cell Tissue Res,2013,353:409-423.
[9]Chen J X,Ou-Yang X,Gao J,et al.Knockdown of ribonuclease inhibitor expression with siRNA in non-invasive bladder cancer cell line BIU-87 promotes growth and metastasis potentials[J].Mol Cell Biochem,2011,349:83-95.
[10]Yoshioka N,Wang L,Kishimoto K,et a1.Atherapeutic target for prostate cancel based on angiogenin-stimulated angiogenesis and Cancer cell proliferation[J].Proc Natl Acad Sci U S A,2006,103:14519-14524.
[11]舒静,田文琳,李林,等.下调血管生成素对人膀胱T24细胞增殖、凋亡的影响[J].第三军医大学学报,2014,36:1460-1466.
[12]Li S P,Hu G F.Angiogenin-mediated rRNA transcription in cancer and neurodegeneration[J].Int J Biochem Mol Biol,2010,1:26-35.
