RNA干扰Tb人舌癌细胞整合素连接激酶基因表达可抑制移植瘤生长
2015-05-11邓世雄陈俊霞
幸 宇,邓世雄,齐 进,姜 容,陈俊霞
(重庆医科大学1.基础医学院 法医学与生物信息学研究室;2.附属口腔医院;3.基础医学院 干细胞与组织工程研究室;4.基础医学院 分子医学与肿瘤研究中心,重庆400016)
舌癌是最为常见的口腔恶性肿瘤,男性多于女性,多数为鳞状细胞癌。近年来舌癌的发病率不断增长,并呈现年青化趋势,且预防效果及早期确诊差,愈后差,易转移,5年生存率仅50%左右[1-2]。
在由整合素与细胞外基质(extracellular matrix,ECM)相互作用而引发细胞应答反应中,整合素连接激酶(integrin-linked kinase,ILK)通过其丝氨酸/苏氨酸激酶活性介导细胞内外的信号传导而起着重要作用[3]。除了参与某些基本的细胞生理过程外,ILK 还与多种肿瘤的发生和转移相关。前期作者报道了抑制ILK表达对舌癌Tb 细胞在体外的增殖、转移和侵袭等方面可以产生抑制作用[4]。在此基础上,作者建立裸鼠Tb 细胞移植瘤模型,进一步观察ILK 沉默后对信号传导分子Akt、GSK3β 及其磷酸化状态,以及对移植瘤生长、病理形态、微血管形成情况等方面的影响,并探讨其可能参与肿瘤细胞生长的机制,以期为舌癌的治疗寻找新思路。
1 材料与方法
1.1 材料
1.1.1 细胞、质粒及实验动物:Tb人舌鳞癌细胞(湖南湘雅医学院)、ILK siRNA表达质粒(重庆医科大学细胞生物学及遗传学教研室构建及保存[4-5])。SPF级BALB/c 裸鼠(雌雄不限)24只,4~6周龄,体质量(20±3)g[北京华阜康生物科技股份有限公司,合格证号SCXK(京)2009-004]。
1.1.2 试剂:胎牛血清(Hyclone 公司),DMEM 培养基及G418 (Gibco-BRL 公司),脂质体Lipofectamine 2000 试剂(Invitrogen 公司),鼠抗人ILK单克隆抗体(Santa Cruz 公司),兔抗人CD31、p-Akt、Akt、p-GSK3β、GSK3β 抗体(Bioworld 公司),FITC包被的羊抗兔二抗(北京中杉金桥生物技术有限公司),其他试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养、转染和筛选:Tb 细胞在37℃,5% CO2饱和湿度孵育箱中,用含5%胎牛血清的DMEM 培养基进行常规培养。将对数增殖期细胞按2×105个/孔接种至6孔板,当细胞达70%左右汇合度时,以未转染细胞为正常组,用脂质体Lipofectamine 2000 将ILK siRNA表达质粒及阴性对照质粒分别转染细胞。48 h后以G418 进行筛选,前2周G418 为0.3 mg/mL,后6 周减半培养,获得稳定表达质粒的系,分别命名为Tb 细胞组(未转染质粒的正常Tb 细胞),Tb vector 细胞组(转染阴性对照质粒的Tb 细胞),Tb siILK 细胞组(转染ILK siRNA质粒的Tb 细胞)。
1.2.2 Western blot检测ILK表达:常规提取细胞总蛋白,5%浓缩胶上样40 μg/孔,60 V 电泳,当蛋白质进入10% SDS-PAGE 凝胶时改为100 V 电泳1 h,常规湿法转膜,5%脱脂奶粉封闭1.5~2 h,ILK鼠单抗(1∶300 稀释)4℃孵育12 h,HRP 标记的羊抗鼠IgG(1∶1 000 稀释)37℃孵育2 h,ECL 化学发光显色,Bio-Rad 凝胶成像仪观察照相,Quantity One图像分析。
1.2.3 免疫荧光法检查瘤细胞中Akt、p-Akt、GSK3β和p-GSK3β表达:6孔板内放置盖玻片,接种各组细胞制作细胞爬片。待细胞增殖为单层时(达80%以上汇合度),用80%冰丙酮固定10 min,PBS(含3%BSA)37℃封闭30 min,分别以Akt、p-Akt(S473)、GSK3β 和p-GSK3β(S9)抗体(均按1∶300 稀释)4℃孵育过夜,PBS 清洗5 min×3次,FITC 包被的羊抗兔二抗(1∶100 稀释)于37℃避光孵育1 h,PBS 清洗5 min×3次,50%甘油封片。使用激光共聚集显微镜(Leica TCS-SP2)观察并拍照,SPOT 3.5 软件分析结果。
1.2.4 裸鼠移植瘤模型:胰蛋白酶消化细胞,PBS洗涤,制备成0.1 mL 含有2×106细胞的悬液。将裸鼠以随机数字表法分成3 组,每组8只,分别将前述3 组细胞悬液接种至裸鼠背部皮下,观察各组细胞在裸鼠体内的成瘤率、肿瘤大小及生长速度,5周后处死裸鼠,称取肿瘤质量,对裸鼠内脏器官进行常规病理学检查,并由2名工作8年以上的病理科医生分别复核认定。抑瘤率=[1 - 平均瘤质量(Tb siILK 组)/平均瘤质量(Tb组或Tb vector 组)]×100%。
1.2.5 HE染色及免疫荧光检查移植瘤CD31、p-Akt和p-GSK3β表达:10%多聚甲醛溶液固定肿瘤组织及肺组织。常规脱水、石蜡包埋,制成5 μm 厚组织切片,二甲苯和梯度乙醇常规脱蜡至水,苏木精染色4 min,1%盐酸乙醇分色15 s,流水冲洗,蒸馏水清洗3次,伊红染色5 min,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察并拍照。瘤组织于高倍镜下随机选取10个视野对微血管数目进行计数并取平均值。瘤组织的CD31、p-Akt 和p-GSK3β的免疫荧光检查步骤同1.2.2 所述。
1.3 统计学分析
2 结果
2.1 ILK蛋白表达检测
ILK蛋白的表达水平Tb siILK 组分别为Tb组和Tb vector 组的66%和67%,表达明显下降(P<0.01)(图1)。

图1 Western blot检测细胞ILK蛋白的表达Fig1 Western blot of ILK protein in Tb cells of each group
2.2 ILK siRNA对Tb 细胞及移植瘤Akt 和GSK3β表达的影响
Tb siILK 组与Tb组和Tb vector 组的细胞相比,Akt 和GSK3β 在细胞质中的平均荧光强度(mean fluorescence intensity)无明显改变,而 p-Akt 和p-GSK3β的平均荧光强度则明显减弱(图2);与体外实验相似,在移植瘤组织切片中,Tb siILK 组的p-Akt和p-GSK3β的平均荧光强度也明显减弱(图3);在体外和体内实验中,前述各指标在Tb组和Tb vector 组之间表达情况相似。
2.3 ILK siRNA对裸鼠移植瘤生长的影响
Tb组和Tb vector 组裸鼠于接种后3 d 开始成瘤;Tb siILK 组于接种后5 天开始成瘤。5周后处死裸鼠,取出瘤体并称其质量。Tb siILK组(1.68±1.35)g 较Tb组(3.58±1.04)g 与Tb vector组(3.64±0.65)g,瘤体质量显著降低(P<0.05),抑瘤率分别为53.0%和53.8%(图4)。
2.4 移植瘤组织学观察
Tb组和Tb vector 组移植瘤组织内可见坏死及出血灶,癌细胞体积大而不均匀,核分裂相较多,核质比增大,而Tb siILK 组癌细胞较前2 组体积减小,核分裂相较少,核质比例缩小(图5)。
2.5 ILK siRNA对裸鼠移植瘤自发性转移的影响
Tb组和Tb vector 组裸鼠肺组织内均发现自发性转移瘤细胞巢生成,而Tb siILK 组裸鼠肺组织内未发现自发性转移瘤细胞巢,各组裸鼠的肺以外器官未发现自发性转移瘤(图6)。
2.6 ILK siRNA对裸鼠移植瘤瘤体微血管的影响
HE 检查显示Tb siILK 组瘤组织内微血管计数(5.6±2.2)/视野较Tb组(15.3±2.3)/视野和Tb vector组(14.6±1.4)/视野组明显减少(图5),免疫荧光检查显示Tb siILK 组瘤组织内CD31 阳性细胞明显较Tb组和Tb vector 组减少(P<0.05),与HE 检查结果一致(图7)。
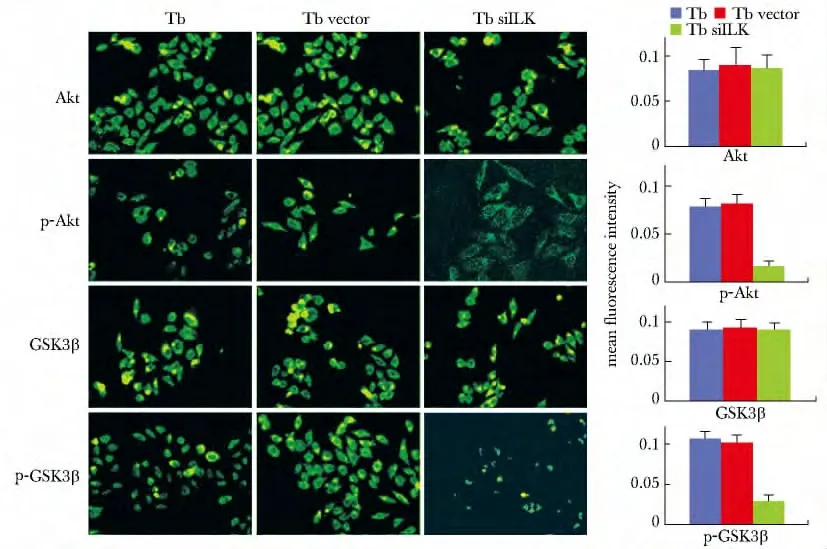
图2 各组细胞中Akt,GSK3β,p-Akt 和p-GSK3β的免疫荧光检查Fig2 In vitro immunofluorescence of Akt,GSK3β,p-Akt and p-GSK3β(×400)

图3 各组移植瘤中p-Akt 和p-GSK3β的免疫荧光检查Fig3 In vivo immunofluorescence of p-Akt and p-GSK3β(×200)

图4 各组移植瘤肉眼检查Fig4 Morphology of xenograft tumor in each group
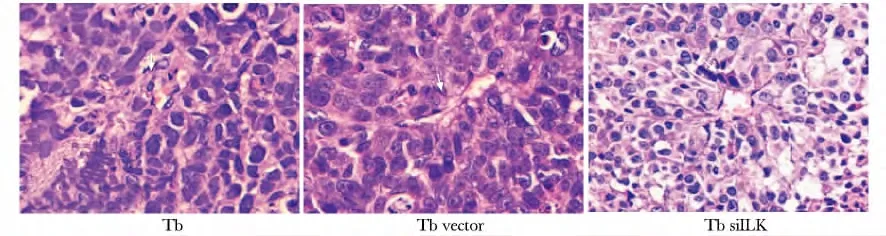
图5 各组移植瘤HE染色Fig5 HE examination for xenograft tumor(×400)

图6 肺内自发性转移瘤检查Fig6 Spontaneous metastasis tumor in lung(×100)

图7 瘤组织微血管免疫荧光检查Fig7 Immunofluorescence examine of micro blood vessel in xenograft tumor(×200)
3 讨论
ILK[3,6]介导由整合素与细胞外基质[7]作用引发的细胞应答反应,除参与如细胞生长、分化等基本生理过程,还与肿瘤的血管生成、瘤细胞黏着、侵袭和迁移等过程密切相关[8]。研究表明,ILK的表达和活性在人类多种恶性肿瘤中均明显升高[9]。抑制ILK 活性,对消化道、乳腺和膀胱等的肿瘤细胞的增殖、迁移、侵袭和血管生成可产生抑制作用。有报道[10]认为ILK 对肿瘤细胞的调控机制存在细胞特异性,而抑制ILK 对口腔肿瘤的影响目前罕有报道。在前期研究中作者发现,抑制ILK表达对体外培养的Tb 舌癌细胞增殖、细胞周期、迁移和侵袭能力产生抑制作用。肿瘤的生长和转移须依赖血管生成提供充足养分和氧气,本研究证实在体内实验中,抑制ILK表达,肿瘤血管生成也明显减少,且Tb siILK 组肿瘤自发性转移受到明显抑制;Tb siILK 组移植瘤成瘤时间较Tb组和Tb vector 组延长,成瘤率及瘤体质量也较之明显下降,病理学检查发现Tb siILK组移植瘤细胞体积减小,核分裂相较少,核质比例缩小;本实验证实对ILK表达抑制可对肿瘤细胞增殖及血管生成产生抑制作用。
GSK3β 对维持细胞的“上皮化状态”有重要作用。ILK 通过其磷酸化酶活性对其下游底物Akt 和GSK3β 进行磷酸化。另外ILK 和Akt 均可磷酸化GSK3β 而使之失活,激活Akt/GSK3β/Snail 通路进而介导上皮-间质转化(epithelial-mesenchymal transition,EMT)。抑制ILK 可抑制Akt 和GSK3β的磷酸化,即Akt的活性被抑制而GSK3β的失活被阻止,故抑制ILK 可抑制Akt/GSK3β/Snail 通路。研究证实抑制ILK 和Akt 活性对乳腺癌细胞EMT 现象及肺癌细胞增殖起到抑制[11-12]。本实验发现抑制ILK表达抑制了Tb 舌癌细胞的Akt 和GSK3β 磷酸化,而对非磷酸化Akt 和GSK3β的水平无明显影响,进一步证实了前述发现,提示ILK 可能通过Akt/GSK3β/Snail 在EMT 现象中起到重要作用。由于ILK信号通路十分复杂,本研究将进一步检验抑制ILK 对其他信号传导通路影响,以期深入地阐明抑制ILK 对舌癌细胞增殖、侵袭、转移等方面的调控机制。
综上所述,本研究发现抑制ILK表达,体内外培养的Tb 细胞中Akt 和GSK3β的磷酸化受到抑制,移植瘤增殖、血管生成和自发性转移均受到明显抑制,提示ILK 有望成为抗肿瘤治疗的靶基因。
[1]Bello IO,Soini Y,Salo T.Prognostic evaluation of oral tongue cancer:means,markers and perspectives(Ⅱ)[J].Oral Oncol,2010,46:636-643.
[2]欧阳紫兰,邱丽华,王婷,等.建立兔舌癌颈淋巴结转移模型的多普勒超声动态监测[J].重庆医科大学学报,2013,38:1002-1005.
[3]Wickstrom SA,Lange A,Montanez E,et al.The ILK/PINCH/parvin complex:the kinase is dead,long live the pseudokinase![J].EMBO J,2010,29:281-291.
[4]幸宇,邓世雄,陈俊霞.RNA干扰整合素连接激酶基因表达对人舌鳞癌Tb 细胞生长、迁移和侵袭能力的影响[J].中国生物制品学杂志,2013,26:916-922.
[5]幸宇,邓世雄,陈俊霞.沉默整合素连接激酶基因抑制TCA8113 舌癌细胞生长和侵袭[J].第三军医大学学报,2013,35:1552-1557.
[6]Qin J,Wu C.ILK:a pseudokinase in the center stage of cell-matrix adhesion and signaling[J].Curr Opin Cell Biol,2012,24:607-613.
[7]刘玉胜,鹿庆华,蒋卫东,等.组织蛋白酶与细胞外基质重塑[J].基础医学与临床,2006,26:1037-1040.
[8]Zervas C G,Psarra E,Williams V,et al.A central multifunctional role of integrin-linked kinase at muscle attachment sites[J].J Cell Sci,2011,124:1316-1327.
[9]Papanikolaou S,Bravou V,Gyftopoulos K,et al.ILK expression in human basal cell carcinoma correlates with epithelial-mesenchymal transition markers and tumour invasion[J].Histopathology,2010,56:799-809.
[10]Sakai T,Li S,Docheva D,et al.Integrin-linked kinase(ILK)is required for polarizing the epiblast,cell adhesion,and controlling actin accumulation[J].Genes Dev,2003,17:926-940.
[11]Serrano I,Mcdonald PC,Lock FE,et al.Role of the integrin-linked kinase (ILK)/Rictor complex in TGFbeta-1-induced epithelial-mesenchymal transition (EMT)[J].Oncogene,2013,32:50-60.
[12]刘元银,雷淑慧,杨燕,等.胡桃醌通过降低AKT 活性抑制肺癌A549 细胞增殖[J].基础医学与临床,2013,33:1032-1037.
