bFGF对神经病理性疼痛大鼠脊髓NMDA受体表达的影响
2015-05-11沈茜,高进,陈萍
沈 茜,高 进,陈 萍
(重庆医科大学 附属第一医院 麻醉科,重庆400016)
N-甲基-D-天门冬氨酸(N-methyl-D-aspartate receptor,NMDA)受体是一种离子型谷氨酸受体,越来越多的证据表明NMDA受体参与疼痛信号传递。在多种疼痛模型中,外周及中枢神经系统内NMDA受体表达明显增高,给予NMDA受体拮抗剂能明显缓解疼痛[1]。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是具有神经营养性的多效性细胞因子,广泛分布在周围和中枢神经系统。近来研究表明,bFGF对神经病理性疼痛的发展也起着重要作用[2]。在坐骨神经分支选择性损伤模型(spared nerve injury,SNI)大鼠脊髓背角,bFGF表达明显升高[3]。bFGF 能通过激活脊髓星形胶质细胞来参与疼痛,而活化的星形胶质细胞又不断分泌bFGF。有研究发现bFGF 能通过影响细胞谷氨酸受体表达来调节细胞对谷氨酸的反应[4]。但bFGF对坐骨神经分支选择性损伤大鼠脊髓内NMDA受体表达的影响尚无相关报道。本研究拟通过建立大鼠坐骨神经分支选择性损伤疼痛模型来观察bFGF对脊髓NMDA受体亚基表达的影响,旨在探讨神经病理性疼痛可能的发生机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠48只,体质量200~250 g,由重庆医科大学实验动物中心提供[动物许可证SYXK(渝)2007-0001]。适应性饲养1周。采用随机数字表法,将大鼠随机分为4组(n=12):假手术组(A组);假手术+bFGF 抗体组(B组);SNI组(C组);SNI+bFGF 抗体(D组)。
1.1.2 主要试剂:兔抗大鼠bFGF、NR2A 一抗和羊抗大鼠NR1、NR2B 一抗(Santa Cruz 公司),小鼠抗大鼠GFAP 一抗(Abcom 公司);羊抗兔IgG、兔抗羊IgG 和羊抗小鼠IgG(武汉博士得生物工程有限公司);DAB 显色剂(北京中杉金桥生物技术有限公司);Trizol 和反转录试剂盒(北京百泰克生物技术有限公司);RIPA 裂解液及BCA蛋白分析试剂盒(江苏碧云天生物技术研究所)。
1.2 方法
1.2.1 模型制备及鞘内给药:采用坐骨神经分支选择性损伤(spared nerve injury,SNI)方法制备神经病理性痛模型[5]。C组和D组暴露坐骨神经及其分支,游离并结扎腓总神经和胫神经,在结扎的远端切断部分神经,保留腓肠神经并避免过分牵拉;A组和B组仅暴露坐骨神经及其分支。采用鞘内直接注射给药法,麻醉后取L5-6椎间隙,50 μL 微量进样器直接穿刺进入蛛网膜下腔,以突然出现侧向甩尾运动作为为穿刺成功[6]。B组和D组分别于建模后1、6、9、13、16、20 天鞘内注射bFGF 抗体18 μg,药物总容量为40 μL[7-8]。A、C组则在相同时间点注射相同体积磷酸盐缓冲液(phosphate buffered saline,PBS)。
1.2.2 机械痛阈测定:参照文献[9]的方法,于术前1天及术后1、4、7、14、21天测定大鼠左后肢机械缩足反射阈值(PWMT)。各组大鼠于第21天测定完机械痛阈值后处死。
1.2.3 免疫组化检测脊髓胶质纤维酸性蛋白(GFAP)表达:4%多聚甲醛溶液经心脏灌注固定后采集脊髓L4-6组织,石蜡包埋切片。切片脱蜡、水化、抗原修复、封闭,加小鼠抗大鼠GFAP 一抗(1∶100)4℃过夜,加生物素标记羊抗小鼠IgG 室温20 min,DAB 显色,苏木素复染,脱水、透明、封片。置于光学显微镜下观察拍照,计算GFAP 免疫反应阳性细胞数。
1.2.4 RT-PCR检测脊髓NR1、NR2A 和NR2B mRNA表达:采集大鼠脊髓L4-6组织保存于液氮中,一部分用于RT-PCR检测,一部分用于Westem blot检测。Trizol 法提取脊髓组织RNA,检测RNA浓度和纯度,取A260/A280值在1.8~2.0的RNA 用反转录试剂盒合成cDNA,PCR 反应采用20 μL 体系,引物序列见表1,扩增条件:95℃5 min;95℃45 s,59℃45 s,72℃1 min,共36个循环;72℃5 min。PCR反应产物行琼脂糖凝胶电泳成像,Quantity One 软件分析条带吸光度值,目的基因相对表达量以目的基因与内参基因吸光度比值来表达。

表1 RT-PCR引物序列Table1 Primer sequence of RT-PCR
1.2.5 Westem bolt 检测脊髓NR1、NR2A 和NR2B蛋白表达:PIPA 裂解液提取脊髓组织蛋白,BCA法测定蛋白浓度,上样,SDS-PAGE 凝胶电泳,电转至硝酸纤维素膜,5%脱脂牛奶封闭,加一抗(1∶1 000)4℃过夜,次日加二抗(1∶1 000)室温1 h,洗膜后ECL 显色,暗室曝光成像,Quantity One 软件分析条带吸光度值,目的蛋白相对表达量以目的蛋白与内参蛋白吸光度比值来表达。
1.3 统计学分析
统计学处理采用SPSS 17.0 统计学软件进行分析,计量资料以均数±标准差(±s)表示。组间比较采用单因素方差分析(one-way ANOVA),组内比较采用重复测量方差分析。
2 结果
2.1 大鼠术后一般情况
大鼠术后一般健康状况良好。A、B组大鼠术后未出现运动障碍和姿势异常,C、D组大鼠则表现出跛行且动作不协调,左后趾并拢,跖屈,轻微外翻畸形,有舔左足、无刺激条件下自发性缩足反射、悬空左后肢等保护姿势;与C组大鼠术后相比,D组大鼠术后运动障碍和姿势异常减轻。
2.2 大鼠机械痛阈值改变
与术前比较,C、D组术后第1天开始出现PWMT 下降(P<0.05),C组在术后第7天达到峰值,并持续至术后21天;与A、B组比较,C、D组PWMT 降低(P<0.05);与C组比较,D组从术后第7天开始PWMT 出现升高(P<0.05,表2)。
表2 鞘内注射bFGF 抗体对大鼠机械性痛阈的影响Table2 Effect of bFGF antibody intrathecal injected on rat paw withdrawal mechanical threshold(g,±s,n=12)

表2 鞘内注射bFGF 抗体对大鼠机械性痛阈的影响Table2 Effect of bFGF antibody intrathecal injected on rat paw withdrawal mechanical threshold(g,±s,n=12)
*P<0.05 compared with group A and B,#P<0.05 compared with group C;△P<0.05 compared with pre-operation.
group pre-operation post-operation 1 day 4 days 7 days 14 days 21 days A 14.17±1.95 14.08±1.34 13.33±2.46 13.00±3.01 13.83±2.72 14.25±1.28 B 13.42±1.20 13.16±2.75 13.75±2.26 13.58±2.61 13.17±2.75 14.58±1.44 C 13.67±1.23 4.50±1.24*△ 3.33±1.30*△ 1.23±0.46*△ 2.13±0.92*△ 2.62±1.04*△D 14.00±2.37 4.83±1.03*△ 3.83±1.34*△ 3.50±1.51* #△ 4.67±1.30* #△ 6.50±1.24* #△
2.3 大鼠脊髓背角星形胶质细胞形态及数量改变
A、B组术侧脊髓背角中GFAP 免疫染色阳性细胞零星表达,染色较淡,胞体小,树突细,与A、B组术侧比较,C、D组GFAP 免疫染色阳性细胞数显著增加,染色增强,胞体增大,突起变粗(P<0.05),与C组相比,D组GFAP表达减少(P<0.05,图1)。
2.4 大鼠脊髓NR1、NR2A 和NR2B mRNA表达
与A、B组比较,C组脊髓NR1、NR2B 基因表达增加(P<0.05)。与C组比较,D组脊髓NR1、NR2B 基因表达降低(P<0.05)(图2,表3)。

图1 鞘内注射bFGF 抗体对大鼠脊髓GFAP 蛋白表达的影响Fig1 Effect of bFGF antibody intrathecal injection on the expression of GFAP protein in the spinal cord of rat(×400)
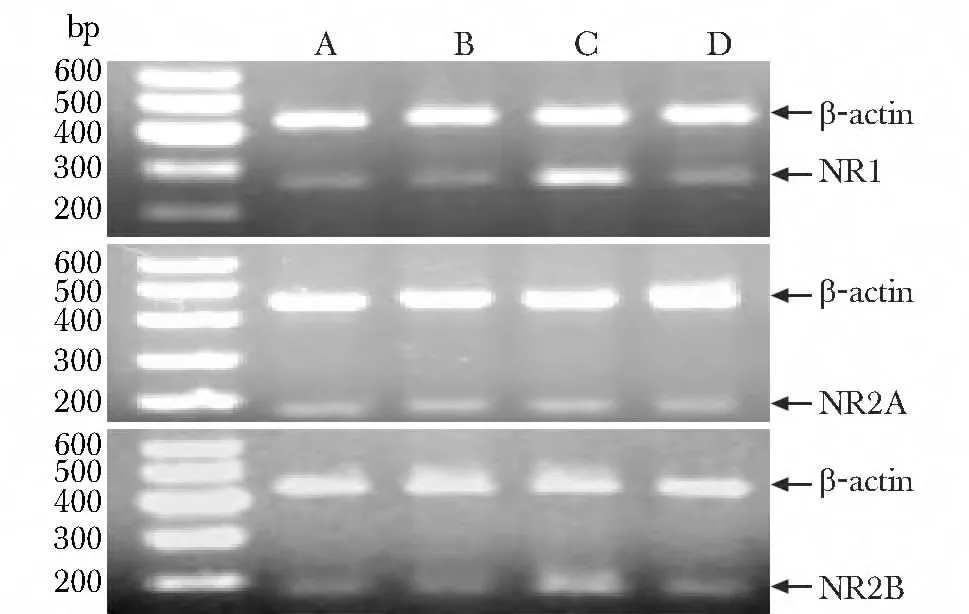
图2 鞘内注射bFGF 抗体对大鼠机脊髓NR1、NR2A 和NR2B mRNA表达的影响Fig2 Effect of bFGF antibody intrathecal injection on the expression of NR1,NR2A and NR2B mRNA in the spinal cord of rat
表3 鞘内注射bFGF 抗体对大鼠机脊髓NR1、NR2A和NR2B mRNA表达的影响Table3 Effect of bFGF antibody intrathecal injection on the expression of NR1,NR2A and NR2B mRNA in the spinal cord of rat(±s,n=6)
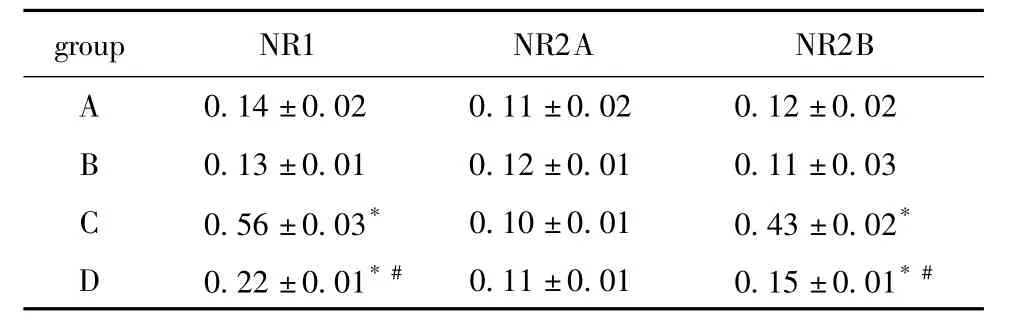
表3 鞘内注射bFGF 抗体对大鼠机脊髓NR1、NR2A和NR2B mRNA表达的影响Table3 Effect of bFGF antibody intrathecal injection on the expression of NR1,NR2A and NR2B mRNA in the spinal cord of rat(±s,n=6)
*P<0.05 compared with group A and B;#P<0.05 compared with group C.
group NR1 NR2A NR2B A 0.14±0.02 0.11±0.02 0.12±0.02 B 0.13±0.01 0.12±0.01 0.11±0.03 C 0.56±0.03* 0.10±0.01 0.43±0.02*D 0.22±0.01* # 0.11±0.01 0.15±0.01*#
2.5 大鼠脊髓NR1、NR2A 和NR2B蛋白表达
与A、B组比较,C、D组脊髓NR1、NR2B蛋白表达增加(P<0.05),与C组术侧比较,D组脊髓NR1、NR2B蛋白表达降低(P<0.05)(图3,表4)。

图3 鞘内注射bFGF 抗体对大鼠脊髓NR1、NR2A和NR2B蛋白表达的影响Fig3 Effect of bFGF antibody intrathecal injection on the expression of NR1,NR2A and NR2B protein in the spinal cord of rat
表4 鞘内注射bFGF 抗体对大鼠脊髓NR1、NR2A和NR2B蛋白表达的影响Table4 Effect of bFGF antibody intrathecal injection on the expression of NR1,NR2A and NR2B protein in the spinal cord of rat(±s,n=6)

表4 鞘内注射bFGF 抗体对大鼠脊髓NR1、NR2A和NR2B蛋白表达的影响Table4 Effect of bFGF antibody intrathecal injection on the expression of NR1,NR2A and NR2B protein in the spinal cord of rat(±s,n=6)
*P<0.05 compared with group A and B;#P<0.05 compared with group C.
group NR1 NR2A NR2B A 0.14±0.01 0.22±0.02 0.10±0.01 B 0.15±0.02 0.21±0.02 0.09±0.01 C 0.76±0.04* 0.20±0.03 0.36±0.02*D 0.45±0.04* # 0.23±0.02 0.17±0.01*#
3 讨论
迄今有多种动物模型能从不同角度模拟外周神经损伤引起的神经病理性疼痛,其中SNI 模型近年来被广泛使用,该模型可重复性好,动物术后能出现明显的机械痛觉过敏[5]。本研究参照Woolf的方法建立SNI 模型,以此探讨神经病理性疼痛可能的产生机制。本研究结果表明,SNI 大鼠术后PWMT 出现明显降低,提示建模成功。
本实验参照前期研究结果选择bFGF的给药剂量和时间,结果表明,bFGF 能减轻大鼠神经病理性疼痛,同时降低星形胶质细胞活化。bFGF是成纤维细胞生长因子家族中的原型成员,参加星形胶质细胞相关的疼痛过敏[2,10]。bFGF 由星形胶质细胞分泌,同时又反过来刺激其活化。Madiai 等[11]研究表明,SNL 模型大鼠脊髓bFGF 增加是伴随着星形胶质细胞活化的,拮抗bFGF 能降低星形胶质细胞及bFGF表达。进一步研究发现,坐骨神经分支选择性损伤后,损伤侧脊髓背角bFGF表达会在4 天后升高,14 天达高峰,并持续至28天,给予bFGF 中和抗体能降低TNF-α 和IL-6表达[3,8]。
NMDA受体参与痛觉信号传递,其表达升高在慢性神经病理性疼痛的产生和维持中起着重要作用。本次研究结果表明,大鼠SNI 术后21天,NR1、NR2B 亚基表达明显升高,而NR2A 亚基表达无差异,基因和蛋白表达结果相一致。该结果进一步证实了NR1 和NR2B 亚基在慢性神经病理性疼痛中起主要作用。鞘内给予bFGF 中和性抗体能明显逆转SNI 引起的NR1 和NR2B 亚基表达升高,提示bFGF 能够通过改变NR1 和NR2B 亚基表达来参与疼痛调控。以往研究一般认为只有神经元的信号传导参与神经病理性疼痛,但随着研究的深入,发现胶质细胞在神经病理性疼痛的发生发展中也起着关键作用,但星形胶质细胞不产生动作电位,其最终还需通过调控神经元来参与疼痛形成。Ji 等[12]研究结果表明,脊髓星形胶质细胞激活后增加IL-1β的表达从而诱导神经元NMDA受体磷酸化来提升疼痛信号的传递。本研究结果也进一步证实了胶质细胞与神经元在神经病理性疼痛中的相互调控作用。
综上所述,bFGF 参与神经病理性疼痛发生和发展,其机制可能与降低脊髓NMDA受体表达,进而减少疼痛信号传递有关。
[1]Wu FX,Pan RR,Chen JY,et al.Lentivirus Mediated siRNA against GluN2B Subunit of NMDA Receptor Reduces Nociception in a Rat Model of Neuropathic Pain[J].Bio Med Res Inter,2014,2014:871637.
[2]Madiai F,Hussain SR,Goettl VM,et al.Upregulation of FGF-2 in reactive spinal cord astrocytes following unilateral lumbar spinal never ligation[J].Exp Brain Res,2003,148:366-376.
[3]You JY,Gao J,Chen P,et al.Changes of basic fibroblast growth factor expression in the spinal cord of rats with spared nerve injury of the sciatic nerve[J].Nan Fang Yi Ke Da Xue Xue Bao,2013,33:563-567.
[4]Cheng B,Furukawa K,O'Keefe JA,et al.Basic fibroblast growth factor selectively increases AMPA-receptor subunit GluR1 protein level and differentially modulates Ca2+responses to AMPA and NMDA in hippocampal neurons[J].Neurochemistry,1995,65:2525-2536.
[5]Decosterd I,Woolf CJ.Spared nerve injury:an animal model of persistent peripheral neuropathic pain[J].Pain,2000,87:149-158.
[6]Zhang EJ,Song CH,Ko YK,et al.Intrathecal Administration of Mesenchymal Stem Cells Reduces the Reactive Oxygen Species and Pain Behavior in Neuropathic Rats[J].Pain,2014,27:239-245.
[7]Madiai F,Goettl VM,Hussain SR,et al.Anti-Fibroblast Growth Factor-2 Antibodies Attenuate Mechanical Allodynia in a Rat Model of Neuropathic Pain[J].Mol Neuroscience,2005,27:315-324.
[8]游霁月,高进,陈萍,等.碱性成纤维细胞生长因子在大鼠神经病理性痛中的作用[J].中华麻醉学杂志,2012,32:1108-1110.
[9]Zhang K,Ramamurthy S,Prihoda TJ,et al.Effect of delayed intrathecal administration of capsaicin on neuropathic pain induced by chronic constriction injury of the sciatic nerve in rats[J].Pain Res,2014,7:547-554.
[10]Sorensen V,Nilsen T,Wiedlocha A,et al.Functional diversity of FGF-2 isoforms by intracellular sorting[J].Bioessays,2006,28:504-514.
[11]Madiai F,Goettl VM,Hussain SR,et al.Anti-fibroblast growth factor-2 antibodies attenuate mechanical allodynia in a rat model of neuropathic pain[J].Molecular Neuroscience,2005,27:315-324.
[12]Ji XT,Qian NS,Zhang T,et al.Spinal astrocytic activation contributes to mechanical allodynia in a rat chemotherapy-induced neuropathic pain[J].PLoS One,2013,8:e60733.doi:10.1371/journal.
