IL-31对人支气管上皮16HBE细胞VEGF、EGF及EGFR表达的影响及作用机制
2015-05-11黄海良丁伟伟张胜权
黄海良,丁伟伟,张胜权,罗 欣
(1.安徽医科大学 生物化学与分子生物学教研室,安徽 合肥230032;2.安徽中医药大学研究生院,安徽 合肥230031)
白细胞介素-31(interleukin-31,IL-31)属于IL-6家族成员,主要由激活的CD4+Th2细胞所产生,主要生物学功能包括调控炎症及免疫反应、诱导细胞因子和趋化因子分泌及调节细胞增殖与分化。最近的研究表明,IL-31 与呼吸系统疾病,例如支气管哮喘及慢性阻塞性肺疾病(COPD)等的气道炎性反应和气道重塑密切相关[1-3]。本实验拟通过研究IL-31对人支气管上皮细胞(16HBE)血管内皮生长因子(vascular endothelial growth factor,VEGF)、细胞表皮生长因子(epidermal growth factor,EGF)和表皮生长因子受体(epidermal growth factor receptor,EGFR)的影响及作用机制,为进一步研究其参与气道重塑的发病机制奠定基础,为气道重塑的临床治疗提供帮助。
1 材料与方法
1.1 细胞及试剂
16HBE细胞(上海博谷生物科技有限公司);IL-31(北京义翘神州生物技术有限公司);RNA 提取试剂盒和real-time PCR 试剂盒(北京康为世纪生物科技有限公司);反转录试剂盒(Thermo Fish 公司);RPMI1640 细胞培养基和胎牛血清(Gibco 公司);β-actin、P38 MAPK、p-P38 MAPK、JNK 和p-JNK抗体(Santa Cruz 公司)。
1.2 PCR引物设计
荧光定量PCR引物由上海生工生物科技有限公司设计、合成(表1)。
1.3 细胞培养及处理
使用RPMI1640 培养基培养16HBE细胞,待细胞增殖至汇合度为80%~90%时,弃培养液并用无菌PBS 清洗2次,然后用0.25%胰蛋白酶消化细胞3 min,细胞计数后按1×105个细胞/孔接种于6 孔培养板,37℃,5% CO2培养箱中继续培养至细胞汇合度为80%时,更换为无血清培养基。

表1 Real-time PCR引物Table1 Primer sequences of real-time PCR
用0、1、10、100 和500 ng/mL的IL-31 处理16HBE细胞24 h,real-time PCR检测VEGF、EGF 和EGFR mRNA的表达。选取100 μg/L的IL-31 分别处理16HBE细胞0、3、6、12、24 和48 h 以及0、5、15、30 和60 min,用real-time PCR检测VEGF、EGF和EGFR mRNA的表达及Western blot检测P38 MAPK 和JNK磷酸化水平。用100 μg/L的IL-31单独及分别联合 SB203580 (10 μmol/L)或SP600125(2 μmol/L)处理16HBE细胞24 h,应用real-time PCR 和Western blot 分别检测VEGF、EGF和EGFR mRNA 和蛋白水平的变化。IL-31 与抑制剂联合应用时,抑制剂先于IL-31 1 h 加入。
1.4 Real-time PCR检测VEGF、EGF 和EGFR mRNA的表达
无菌PBS 洗涤16HBE细胞3次,按RNA 提取试剂盒操作说明书提取细胞总RNA。以RNA 为模板,参照反转录试剂盒说明书进行cDNA 第一链的合成。以cDNA 为模板ABI7500 real-time PCR 仪上检测VEGF、EGF 和EGFR mRNA表达,同时以GAPDH 作为内参,采用2-△△Ct法进行比较分析。realtime PCR 反应程序如下:95℃15 s,60℃1 min,共计40个循环。
1.5 Western blot检测VEGF、EGF、EGFR 及P38 MAPK、JNK信号通路的变化
用RIPA细胞裂解液提取细胞总蛋白,BCA法定量后,按50 μg /孔的量加样、电泳。150 mA、2 h分别将目的蛋白转移至PVDF膜上,50 g/L 脱脂奶粉室温封闭2 h。抗VEGF、EGF、EGFR、P38 MAPK、p-P38 MAPK、JNK 和p-JNK 抗体分别按1 ∶500 稀释,抗β-actin 抗体按1∶1 000 稀释,4℃孵育过夜。TBST 洗膜3次,每次5 min,相应二抗按1∶10 000 进行稀释,室温孵育2 h。TBST 洗膜3次,每次10 min,ECL 发光、显影、定影。以β-actin 作为内参,分析各目的蛋白/β-actin的吸光度比值,并进行统计学分析。
1.6 统计学分析
每组实验均重复3次,采用SPSS11.0 统计软件进行统计分析,结果以均数±标准差(±s)表示。组间比较使用One-way ANOVA 和t 检验进行统计分析。
2 结果
2.1 IL-31对VEGF、EGF 和EGFR mRNA表达的影响
与对照组相比,浓度为10、100 和500 μg/L的IL-31 均显著上调VEGF、EGF 和EGFR mRNA的表达(P<0.01)(图1A),而100 μg/L的IL-31 干预3、6、12、24 和48 h 均显著促进VEGF、EGF 和EGFR mRNA的表达(P<0.01)(图1B)。

图1 IL-31对16HBE细胞VEGF、EGF 和EGFR mRNA表达的影响Fig1 Effects of IL-31 on the mRNA expression of VEGF,EGF and EGFR in 16HBE cells(±s,n=6)
2.2 IL-31对16HBE细胞P38 MAPK 和JNK磷酸化水平的影响
与对照组相比,100 μg/L的IL-31 干预16HBE细胞5 min后即可明显促进P38 MAPK 和JNK磷酸化的表达水平,其中IL-31 干预5、15 和30 min(P<0.01),IL-31 干预60 min(P<0.05)(图2)。

图2 IL-31对16HBE细胞P38 MAPK 和JNK磷酸化表达的影响Fig2 Effects of IL-31 on the phosphorylation expression of P38 MAPK and JNK
2.3 特异性信号通路阻断剂对IL-31激活的信号通路的影响
与对照组相比,IL-31 可显著促进P38 MAPK 和JNK磷酸化的表达水平(P<0.01);与IL-31 组相比,IL-31+SB203580 或SB203580 组p-P38 MAPK的表达水平均明显下降(P<0.01),而IL-31+SP600125 或SP600125 组p-JNK的表达水平均明显下降(P<0.01)(图3)。
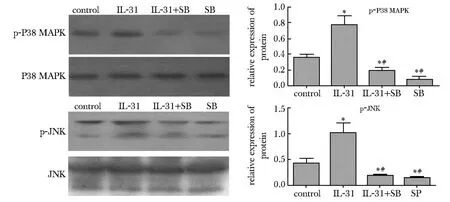
图3 特异性信号通路阻断剂对IL-31激活的信号通路的影响Fig3 Effects of Specific inhibitors on IL-31-induced signal pathways
2.4 IL-31 分别联合SB203580 或SP600125 对VEGF、EGF 和EGFR表达的影响
与对照组相比,IL-31 组VEGF、EGF 和EGFR 在mRNA 和蛋白水平均显著升高(P<0.01);与IL-31组相比,IL-31 分别联合SB203580 或SP600125,VEGF mRNA 和蛋白表达水平发生显著下降(P<0.01),而EGF 和EGFR的表达水平在IL-31 联合SB203580时显著下降(P<0.01)(图4)。
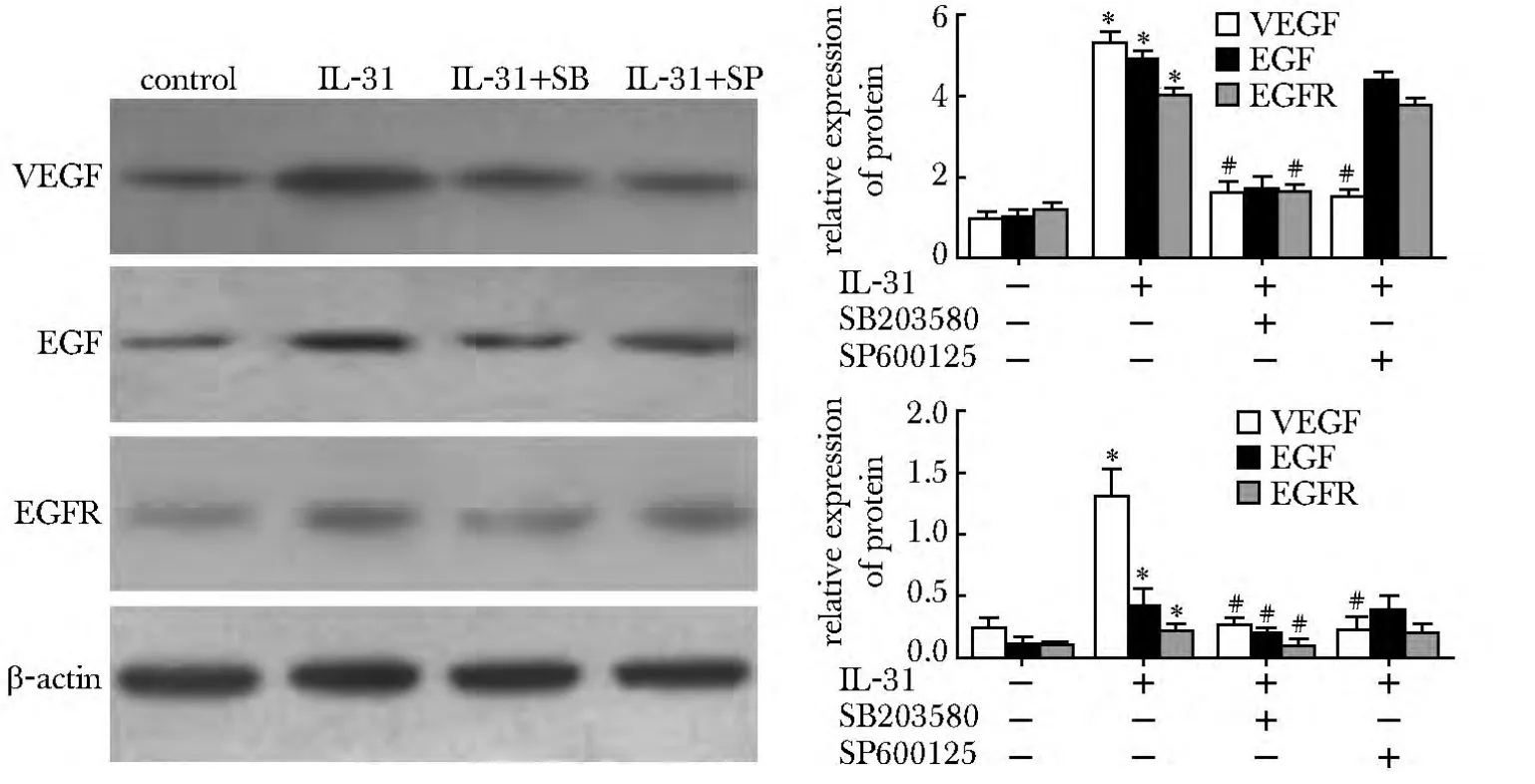
图4 IL-31 单独及分别联合SB203580 或SP600125 对VEGF、EGF 和EGFR 蛋白表达的影响Fig4 Effects of IL-31 on the protein expression of VEGF,EGF and EGFR with or without SB203580 or SP600125
3 讨论
气道重塑与气道慢性炎性反应、气道上皮细胞增生、迁移以及气道平滑肌细胞增生等密切相关。IL-31是机体重要的促炎症性细胞因子,最近的研究表明IL-31 参与了哮喘气道炎性反应、气道重塑,其作为炎性介质介导了支气管哮喘、COPD 等慢性呼吸系统疾病的发生发展。
VEGF是内皮细胞的强效诱导剂,可促进内皮细胞的迁移、增殖以及新生血管的生成等[4-6]。研究发现,哮喘患者气道黏膜组织VEGF、Flt-1 和Flk-1 mRNA的表达量显著高于正常组,并且与气道密度呈正相关[7]。EGF、EGFR是调节细胞分裂的重要因子,对细胞增殖与分化起着重要作用[8-9]。研究表明,组胺在支气管上皮细胞当中能够通过诱导EGFR 配体的表达进而活化EGFR,参与气道重塑[10]。同样,有研究表明与正常小鼠相比,慢性哮喘小鼠肺组织中EGF 和EGFR的表达显著增强,进一步证实了EGF 和EGFR 在气道损伤修复及气道重塑中起着重要作用。此外,使用EGFR的阻滞剂吉非替尼可以抑制哮喘小鼠气道黏液的分泌,提示EGFR 参与了哮喘杯状细胞黏液的分泌、化生、抗凋亡的发病机制,进而导致气道上皮的异常增殖、气道壁增厚及气道重塑[11-12]。
P38 丝裂原活化蛋白激酶(P38 MAPK)和c-JUN氨基末端激酶(JNK)信号通路是机体内重要的信号传导通路,主要参与调控机体炎性反应、细胞周期,细胞发育、分裂和分化等[13-14]。研究表明,P38 MAPK信号通路参与了低氧预适应小鼠的抗凋亡过程,对缺血脑组织损伤起到了保护作用[15]。
本研究发现,IL-31 能够上调16HBE细胞VEGF、EGF 和EGFR的表达,并具有剂量效应,提示IL-31 可能参与了上皮细胞的炎性损伤-修复机制、介导了上皮细胞的增生,进而介导了气道重塑的发生。进一步的机制研究表明,IL-31 可通过激活P38 MAPK 和JNK信号通路而诱导的VEGF 以及通过激活P38 MAPK信号通路而诱导EGF 和EGFR的表达。因此,推测IL-31 可通过激活P38 MAPK 和JNK信号通路进而介导了气道重塑的发生,为进一步深入研究IL-31 在气道重塑中分子生物学作用机制奠定了基础。
[1]Zhang Q,Prabhakar P,Zhou Q,et al.Structures and biological functions of IL-31 and IL-31 receptors[J].Cytokine Growth Factor Rev,2008,19:347-356.
[2]Stott B,Lavender P,Lehmann S,et al.Human IL-31 is induced by IL-4 and promotes TH2-driven inflammation[J].J Allergy Clin Immunol,2013,132:446-454.
[3]Yu JI,Han WC,Yun KJ,et al.Identifying Polymorphisms in IL-31 and their association with susceptibility to asthma[J].Korean J pathol,2012,46:162-168.
[4]Papadaki G,Bakakos P,Kostikas K,et al.Vascular endothelial growth factor and cysteinyl leukotrienes in sputum supernatant of patients with asthma[J].Respir Med,2013,107:1339-1345.
[5]Takyar S,Vasavada H,Zhang JG,et al.VEGF controls lung Th2 inflammation via miR-1-Mpl(myeloproliferative leukemia virus oncogene)-P-selectin axis[J].J Exp Med,2013,210:1993-2010.
[6]杨炼,王娅兰,盛永涛,等.大肠癌ART1的表达与VEGF、整合素Vβ3表达及微血管形成的相关性[J].基础医学与临床,2012,32:1064-1069.
[7]Hoshino M,Fujita Y,Saji J,et al.Effect of suplatast tosilate on goblet cell metaplasia in patients with asthma[J].Allergy,2005,60:1394-1400.
[8]Sako Y,Minoghchi S,Yanagida T.Single-molecule imaging of EGFR signaling on the surface of living cells[J].Nat Cell Bil,2000,2:168-172.
[9]Uddin M,Lau LC,Seumois G,et al.EGF-induced bronchial epithelial cells drive neutrophil chemotactic and antiapoptotic activity in asthma[J].PLoS One,2013,8:e72502.doi:10.1371/journal.pone.0072502.
[10]Nobuaki H,Paul-Andre R,Mauro N,et al.Histamine may induce airway remodeling through release of epidermal growth factor receptor ligands from bronchial epithelial cells[J].FASEB,2012,26:1704-1716.
[11]曹卫军,李强,刘忠令.慢性哮喘小鼠EGFR的表达及地塞米松对其的影响[J].第四军医大学学报,2006,27:125-128.
[12]刘大鹏,宋立强.干预支气管哮喘小鼠气道黏液高分泌的研究[J].中华肺部疾病杂志:电子版,2013,6:23-26.
[13]Kumasawa F,Hashimoto S,Mizumura K,et al.Mitogen-activated protein kinase(MAPK)regulates D4-induced HBEGF and ADAM12 expression in human airway smooth muscle cells[J].Asian Pac J Allergy Immunol,2013,31:58-66.
[14]Johnson GL,Lapadat R.Mitogen-activated protein kinase pathways mediated by ERK,JNK and P38 protein kinases[J].Scince,2002,298:1911-1912.
[15]梁婧,杜建丽,朱熠婧,等.P38 MAPK-BCL-xL 途径参与低氧预适应减轻小鼠脑缺血性损伤[J].基础医学与临床,2010,30:1127-1131.
