重组腺相关病毒表达干扰素α体外抑制乙肝病毒的复制
2015-05-11朱江,高蕾
朱 江,高 蕾
(1.成都学院 医护学院 病原免疫教研室,四川 成都610106;2.中国医学科学院 输血研究所,四川 成都610052)
中国是乙型肝炎的高流行区,一般人群乙肝表面抗原(hepatitis B surface antigen,HBsAg)阳性率为7.18%[1]。目前,治疗乙型肝炎的主要方法是干扰素和核苷类似物。使用的干扰素均是外源性干扰素,有很多乙肝患者对于干扰素不敏感,导致治疗无效,且干扰素需要长期使用,增加了患者的负担[2]。重组腺相关病毒(adeno-associated virus,AAV)载体被广泛应用到基因治疗和临床前或临床实验中,尝试着进行多种疾病的治疗[3-4]。HepG2.2.15细胞能产生完整的HBV,稳定分泌HBsAg 和HBeAg,常被作为体外评估抗HBV 药物效果的细胞模型[5]。本实验利用重组病毒AAV-IFN 感染HepG2.2.15细胞的方法,介导干扰素在体内表达,产生内源性干扰素并对其抗病毒效果进行评估。
1 材料与方法
1.1 材料
1.1.1 材料:细胞及质粒:293T细胞、HepG2.2.15细胞、pAAV-IFN(将IFN 基因克隆于去除Rep 和Cap 基因的含有腺相关病毒6型TR 结构的pAAV骨架质粒中获得)、Pxx680(辅助质粒)、Pxr2、Pxr6、Pxr7、pXR8(包装质粒)、pSC-gfp (含有绿色荧光蛋白基因的质粒)和PCP10(含有2个拷贝HBV 基因组的质粒作为Q-PCR 进行HBV 定量的标准品)(中国医学科学院输血研究所输血传播疾病研究实验室冻存)。
试剂:DMEM 高糖培养基和青霉素-链霉素(Hyclone 公司);血清(Gbico 公司);G418 和MTT 试剂盒(Sigma 公司);DNeasy blood& tissue kits(Qiagen 公司);人HBsAg ELISA 检测试剂盒和人HBeAg ELISA检测试剂盒(泉州市蓝图生物技术有限公司);小鼠ALT ELISA 检测试剂盒和小鼠AST ELISA 检测试剂盒(Quantikine® ELISA 公司);Fast Start Universal SYBR Green Master[Rox](Roche 公司);小鼠α 干扰素(IFNα)定量检测试剂盒(R&D 公司)。
1.1.2 小鼠:SPF级BABL/c 小鼠,雄性,8~10周龄,体质量(18±2)g[成都达硕实验动物公司,合格证号:scxk(川)2013-24]。
1.2 方法
1.2.1 细胞培养:293T细胞培养于完全培养基(DMEM 加入10%胎牛血清和1%青霉素-链霉素);HepG2.2.15细胞培养于完全培养基并加入终浓度为400 mg/L的G418;培养条件均为37℃、5% CO2培养箱中培养。
1.2.2 重组病毒的制备与纯化:转染的前1 d,将汇合度达到90%以上的293T细胞,5% CO2、37℃培养。当293T细胞汇合度达到80%~90%时按1∶3的比例分成3盘,接种于新的培养皿内,利用3 质粒共转染技术进行转染,培养72 h 以后,收获病毒。收获的病毒利用氯化铯超速离心法进行纯化。
1.2.3 重组病毒AAV-GFP 感染HepG2.2.15细胞:感染的前1 d,将HepG2.2.15细胞以4×104个/孔接种于6孔板。次日,吸取6孔板内培养基,将2、6、7 和8 血清型的AAV-GFP 以MOI =103的感染剂量,分别接种于HepG2.2.15细胞,孵育1 h,倾倒出感染液,加入新鲜的培养基继续培养。感染72 h后,在荧光显微镜下观察GFP 在细胞内表达情况。
同时以质粒pSC-GFP 转染HepG2.2.15细胞作为阳性对照,HepG2.2.15细胞接种初始4×104个/孔,质粒pSC-GFP 用量3μg,转染试剂PEI 用量9 μg,转染72 h,荧光显微镜下观察GFP表达情况。
1.2.4 IFN 体内和体外稳定表达验证:设置PBS 空白对照组、AAV-GFP 阴性对照组、pAAV-IFN 转染阳性对照组和AAV6-IFN 实验组。
AAV6-IFN 感染HepG2.2.15细胞,感染方法同上,感染剂量为MOI =104,分别于1,3,6和9 d 收获培养上清,并利用ELISA 试剂盒测量上清中IFNα的表达量。
同时将AAV6-IFN 以5×1010μg/只的剂量,经尾静脉注射,在1、2、3 及6月取小鼠血液,将小鼠血液冰上放置30 min后,3 000 r/min 离心,收获血清-20℃冻存备用。全部样本用ELISA 试剂盒检测小鼠血清中IFN表达情况、ALT(丙氨酸转氨酶)和AST(天门冬氨酸转氨酶)含量变化。
1.2.5 重组AAV6-IFN 病毒感染HepG2.2.15细胞:AAV6-IFN 感染HepG2.2.15细胞,感染剂量为MOI=104,于1,3,6和9 d 收获各组培养上清及细胞。ELISA 试剂盒测量上清中HBsAg 和HBeAg的变化,并利用DNeasy blood & tissue kits 提取培养上清和细胞中总DNA,qPCR 方法定量培养上清和细胞中HBV DNA 含量的变化。对HBV DNA 定量的qPCR 反应上游引物为5'-CGTTTTTGCCTTCTGACTT CTTTC-3',下游引物为5'-ATAGGATAGGGGCATTTG GTGGTC-3',扩增片段长度为372 bp;同时以质粒PCP10(包含2个拷贝的HBV 基因组的质粒)为标准品,进行10倍梯度稀释,以1.0×103~1.0×109copy/mL绘制标准曲线。
1.2.6 MTT法检测HepG2.2.15细胞增殖:取对数生长期细胞接种于96孔板中,每孔接种4×104个。培养12 h后,洗掉培养液,换1% 胎牛血清的培养基同步化12 h。设置PBS 为空白对照组;AAV-GFP 为阴性对照组;pAAV-IFN 为转染阳性对照组;AAV6-IFN 为实验组。剂量同上,每组样本设3个复孔,37℃、5% CO2孵箱分别培养24、48和72 h,每孔加入20 μL MTT 溶液(5 g/L),继续培养4 h。弃上清液,每孔加入150 μL 二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。用酶标仪在波长570 nm 处测定A值,按以下公式计算抑制率:
抑制率=(空白对照组A值-实验组A值)/空白对照组A值×100%。
1.3 统计学分析
实验动物采用SPSS 17.0 软件,随机分组进行体内实验,结果以小鼠测量值的平均值±标准差(±s)表示,组间比较使用方差分析。
2 结果
2.1 AAV6 可有效介导GFP 在HepG2.2.15细胞内表达
在感染72 h后,AAV6-GFP(图1B)较其他血清型AAV2-GFP(图1A),AAV7-GFP(图1C),AAV8-GFP(图1D),对于HepG2.2.15细胞有更强的感染效率。同时以PBS代替AAV-GFP 作为阴性对照(图1F),72 h后未见GFP表达;以质粒pSC-GFP 转染HepG2.2.15细胞的阳性对照可明显观察到GFP表达(图1E)。

图1 不同血清型AAV-GFP 感染HepG2.2.15细胞后GFP的表达Fig1 Expression of GFP in HepG2.2.15 cells infected with different serotype AAV(×400)
2.2 重组AAV6-IFNα 介导IFN 在体内外有效表达
AAV6-IFNα 感染HepG2.2.15细胞3 d后,培养上清液中能检测出IFNα的表达;持续感染9 d后,表达量可达(36.63±3.27)ng/mL;同时质粒pAAV-IFNα 转染组培养上清中也检测到IFN表达,但是IFNα表达量没有AAV6-IFNα 感染组多(P<0.01)(图2A)。
将AAV6-IFNα 尾静脉注射小鼠1个月后即可检测出血清中IFNα 为(191±19)ng/mL,随后血清中IFNα浓度保持稳定,6个月时IFNα浓度降低了29.28%(图2B)。
2.3 重组AAV6-IFNα 对肝功能指标ALT、AST的影响
注射AAV6-IFNα 6个月后小鼠血清中ALT 和AST 与对照PBS组和AAV6-GFP 组相对比没有区别(图2C,D)。
2.4 AAV6-IFNα体外显著抑制HBV的复制与表达
对各组HepG2.2.15细胞表达HBV DNA 检测显示,培养9 d后AAV6-IFNα 组抑制率[(空白组-实验组)/空白组×100%]可达40.13%(图3A);而AAV6-IFNα 组对培养上清中HBV DNA的抑制效果在感染3 d时即逐渐呈现,在感染9 d时抑制率可达62.93%(图3B)。同时测量培养上清中HBsAg 和HBeAg 含量变化,感染9 d后HBsAg 和HBeAg的抑制率分别为47.33%和37.49%(图3C,D)。HBsAg的抑制效果在感染3 d 以后逐渐呈现,而HBeAg的抑制效果在感染6 d 以后逐渐呈现。AAV6-IFNα 组与转染阳性对照组相比,对于HBV的复制和表达抑制效果更为明显,持续时间更长(P<0.05)。
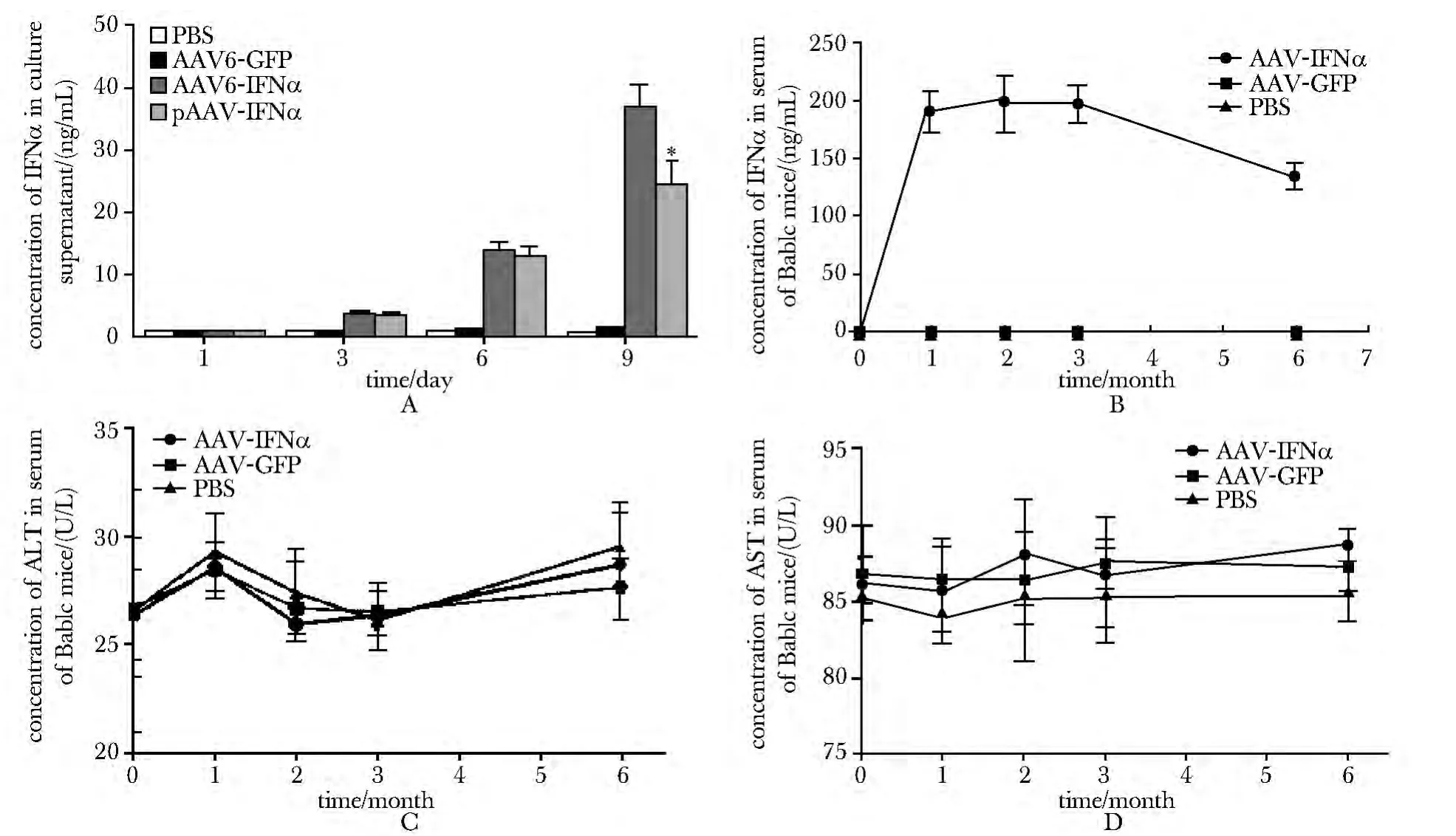
图2 AAV6 有效介导IFN 在体内外表达且不引起急性反应Fig2 Expression of IFN mediated effectively by AAV6 with no acute inflammatory reaction in vivo and in vitro
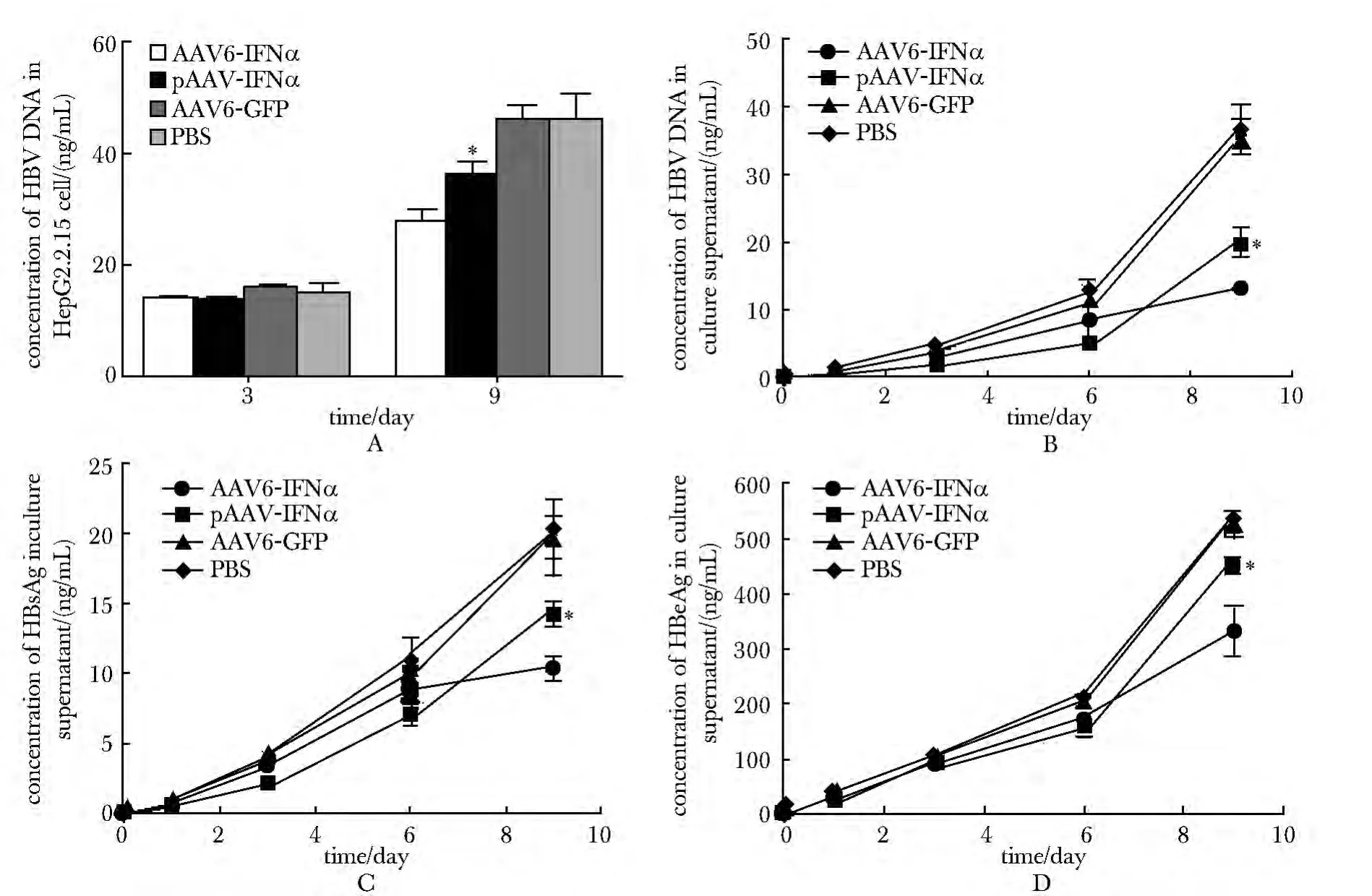
图3 AAV6-IFNα体外有效抑制HBV的复制与表达Fig3 The replication and expression of HBV inhibited by AAV-IFNα in vitro
2.5 AAV-IFN 抑制HepG2.2.15细胞增殖
AAV6-IFN 作用于HepG2.2.15细胞48、72 h后,可表现明显的抑制作用,抑制率分别为35%、69%,并呈现时间依赖关系(图4)。
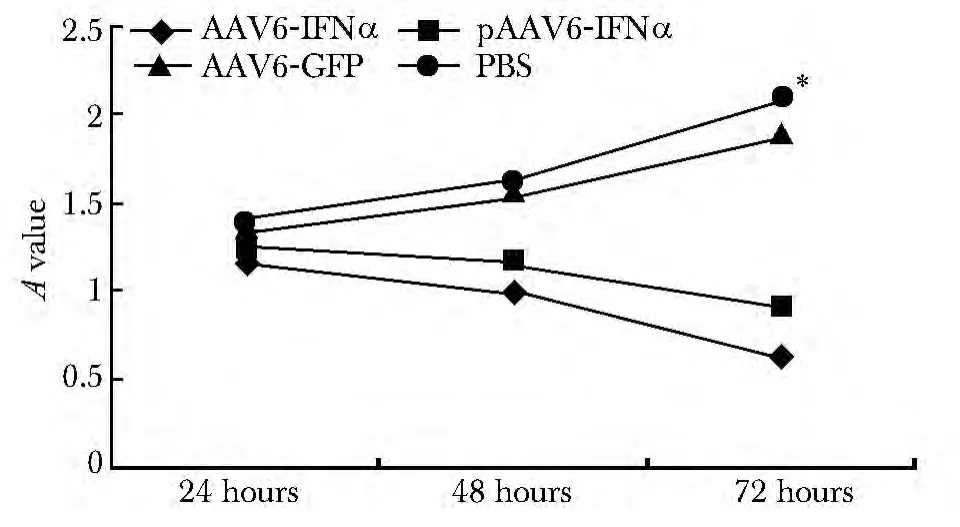
图4 AAV6-IFNα 对细胞增殖的抑制作用Fig4 The proliferation of HepG2.2.15 cells inhibited by AAV6-IFNα
3 讨论
乙肝为高发传染病,目前治疗主要以干扰素及核苷类似物为主。干扰素的长期使用给患者带来痛苦和金钱负担。AAV 载体具有无致病性,低免疫原性,可介导外源基因长期表达等优点,已尝试用于多种疾病的治疗[3-4]。本实验尝试用AAV 载体来介导IFNα的长期表达,从而减少IFNα 注射次数,减轻乙肝患者的痛苦。
不同AAV 血清型对组织的感染率不同,用重组AAV 转染猕猴、小鼠和人的造血干细胞,发现AAV1 转染小鼠造血干细胞的能力强,而AAV6 转染人造血干细胞的能力强[6],但采用AAV 对HepG2.2.15细胞的感染效率的评估鲜有报道。本实验中发现AAV6 对于HepG2.2.15细胞具有更强的感染性,更适合作为体外介导IFN 在HepG2.2.15细胞内表达的载体。
利用AAV6-IFNα 感染HepG2.2.15细胞和尾静脉注射小鼠的方法,在培养上清液和小鼠血清中均检测到IFNα的表达,说明利用AAV 载体介导HepG2.2.15细胞表达IFN 具有可行性。模型小鼠在长达6个月内均有IFN的表达,说明AAV6 载体可介导IFN 长期表达,体现了AAV6 作为载体的优越性。同时实验还对AAV6-IFN 安全性进行了检测,注射AAV6-IFN 小鼠的血清中反应肝细胞损伤的指标ALT 和AST 变化均与对照组没有显著区别。
体外AAV6-IFNα 感染HepG2.2.15细胞,发现表达的内源性IFNα 对HBV DNA、HBsAg 和HBeAg均有显著的抑制作用,抑制率可达50%以上,与阳性对照质粒pAAV-IFN 转染组相比,AAV6-IFNα 组抑制时间更长效果更显著。
AAV6-IFNα 能显著抑制HepG2.2.15细胞的增殖,并有时间依赖性,这可能是AAV6-IFNα 抑制HepG2.2.15细胞HBV 复制与表达的原因。因此,AAV6-IFNα是一种潜在的抗HBV 药物。但是还需要进一步将AAV6-IFN 在乙型肝炎小鼠模型上进行抗病毒效果的评估,观察其体内抑制HBV的复制和表达的能力及机制,本研究为体内实验奠定坚实的基础。
[1]胡晓丽,赵宏伟,胡晓岩,等.乙型肝炎病毒感染的流行现状[J].临床肝胆病杂志,2012:28:413-414.
[2]邱玉琴.慢性乙肝患者使用干扰素治疗中不良反应的观察与护理[J].医学理论与实践,2011:963-964.
[3]Flotte TR.Adeno-associated virus-mediated gene transfer for lung diseases[J].Hum Gene Ther,2005,16:643-648.
[4]Romano G.Current development of adeno-associated viral vectors[J].Drug News Perspect,2005,18:311-316.
[5]Tang J,Huang ZM,Chen YY,et al.A novel inhibitor of human la protein with anti-HBV activity discovered by structure-based virtual screening and in vitro evaluation[J].PLoS One,2012,7:1371-1379.
[6]Song LJ,Kauss MA,Kopin E,et al.Optimizing the transduction efficiency of capsid-modified AAV6 serotype vectors in primary human hematopoietic stem cells in vitro and in a xenograft mouse model in vivo[J].Cytotherapy,2013,15:986-989.
