人胰岛素抑制大鼠肝细胞系BRL-3A凋亡且促增殖
2015-05-11王改平陈莎莎李晓芳赵卫明常翠芳徐存拴
王改平,陈莎莎,李晓芳,杨 婧,赵卫明,常翠芳,徐存拴
(1.河南师范大学 生命科学学院;2.河南省-科技部共建细胞分化调控国家重点实验室培育基地,河南 新乡453007)
胰岛素是一种多功能的蛋白质激素,具有刺激DNA 和蛋白质合成、促进细胞生长的作用。研究发现,胰岛素能有效地促进脂肪细胞3T3-F442A的生成[1]。此外,胰岛素还可促进体外培养的人膀胱癌细胞系(T24)和原代大鼠卵泡膜间质细胞的增殖[2-3]。原代肝细胞的体外培养存在生长条件苛刻、增殖和传代困难等缺点[4],一定程度上限制了其在肝脏功能研究上的应用。研究者尝试加入胰岛素、地塞米松等生长因子以促进原代肝细胞的存活与生长[5]。BRL-3A是来自大鼠肝脏的肝细胞系,并在肝细胞研究中被广泛用作正常肝细胞[6],目前还没有关于人胰岛素对BRL-3A的体外作用研究。因此,本研究将不同浓度的人胰岛素作用于BRL-3A细胞,并通过MTT、流式细胞术和qRT-PCR 等方法检测人胰岛素对肝细胞系的作用。
1 材料与方法
1.1 材料
大鼠BRL-3A 肝细胞系(中国医学科学院基础医学研究所细胞资源中心);DMEM 培养基、100 μg/mL青霉素、100 μg/mL 链霉素和Trizol(Invitrogen 公司);胎牛血清(杭州天杭生物科技有限公司);诺和灵R 人胰岛素(丹麦诺和诺德公司);MTT 和二甲基亚砜(Geneview 公司);DNase Ⅰ和AMV 反转录试剂盒(Promega 公司);qPCR引物(由北京三博远志生物公司合成)。
1.2 方法
1.2.1 BRL-3A细胞的培养:BRL-3A细胞在含10%小牛血清的DMEM 完全培养基(含青霉素100 μg/mL,链霉素100 μg/mL)中,于37℃、5%CO2、饱和湿度条件下进行培养。
1.2.2 MTT 比色法检测BRL-3A细胞活性:取第3代BRL-3A细胞接种于96孔板(3 000个细胞/孔,0.2 mL 培养基),给予诺和灵R 人胰岛素(human insulin,HI)梯度处理,终质量浓度分别为0、10、100、500 和1 000 nmol/L,每个梯度设置3 孔重复,孵育12 h后,加入10 μL MTT,37℃、5% CO2培养箱中继续孵育4 h,吸掉上清,每孔加入100 μL 二甲基亚砜(DMSO),轻轻振荡混匀10 min,使其充分溶解由活细胞产生的甲瓒晶体,于酶标仪检测490 nm 处各孔吸光度A值。按上述操作检测胰岛素作用第1、2、3、4 和5 天的细胞增殖情况。
1.2.3 流式细胞仪分析:取对数期增殖BRL-3A细胞接种于24孔板,细胞调整为2×104个/孔,给予500 nmol/L人胰岛素处理,同时设置未处理对照组,每个样品设置6个孔,并作3次重复,24 h后换液,处理3 d后,收集细胞,用预冷PBS 洗1次(1 000 r/min,4℃,10 min),弃上清,于70%乙醇中-20℃固定过夜,然后,将样品离心(3 000 r/min,10 min,室温),弃上清,沉淀用500 μL 预冷PBS 洗1次(3 000 r/min,10 min,室温),弃上清,再用含0.1 mg/mL RNase A的PI 染色液(50 mg/L)重悬细胞,室温避光孵育15 min,300 目筛网过滤细胞,最后,流式细胞仪测定细胞周期分布情况。
用500 nmol/L人胰岛素处理3 天后,收集细胞,将细胞悬液转移至1.5 mL EP 管中离心(1 000 r/min,4℃,10 min),用PBS 洗2次。每个样品中加入200 μL结合缓冲液重悬细胞,加入10 μL 染液FITC,室温避光孵育15 min,然后补加300 μL 结合缓冲液,加入10 μL 染液PI,室温避光孵育5 min,300 目筛网过滤细胞,最后,用流式细胞仪测定细胞凋亡情况。
1.2.4 qRT-PCR检测CCNA2、BAX、JUN 和MYC 基因的表达:根据GenBank 上大鼠CCNA2 (NM_053702),BAX(NM_017059),JUN(NM_021835.3)和MYC(NM_012603.2 )的mRNA 序列,利用Primer Premier 5.0 设计其qPCR引物。引物序列如下:CCNA2上游5'-CTTTTAGTGCCGCTGTCTCTTT-3',下游5'-GCCCGCATACTGTTAGTGATGT-3';BAX 上游5'-TTTCATCCAGGATCGAGCAG-3',下游5'-CAAAG TAGAAGAGGGCAACCAC-3';JUN 上游5'-GGCTGT TCATCTGTTTGTCTTCAT-3',下 游5'-CCCTTTTCTT TACGGTCTCGGT-3';MYC 上游5'-CCCTACCCGCTC AACGACA-3',下游5'-GCCTCTTTTCCACAGACACC A-3';按Trizol的操作说明分离、纯化BRL-3A细胞的总RNA。反转录前用DNaseⅠ37℃消化总RNA 30 min,以去除残留的基因组DNA 污染。用上述纯化的BRL-3A细胞RNA 为模板,按照AMV 反转录试剂盒操作说明进行反转录,得到cDNA 第一链。然后采用SYBR Green Ⅰ掺入的方法在Rotor Gene 3000(Corbett Robotics,CA)对基因CCNA2、BAX、JUN 和MYC 以及内参基因ACTB 分别进行PCR检测,从而计算出靶基因在胰岛素处理后的相对含量。PCR扩增反应条件为:95℃1 min,95℃15 s,60℃15 s,72℃30 s,40个循环[7]。
1.3 统计学分析
2 结果
2.1 人胰岛素对BRL-3A细胞增殖的影响
100nmol/L人胰岛素作用于BRL-3A细胞第4天时,实验组吸光度值开始高于对照组;当人胰岛素浓度为500 nmol/L,药物消耗量适中,且从第3 天开始,实验组吸光度值即显著高于对照组(P<0.05或P<0.01);而1 000 nmol/L人胰岛素处理后第1天,实验组吸光度值即极显著高于对照组(P<0.01)(表1),但因药物消耗量太大,本文选择500 nmol/L的浓度进行后续实验。
2.2 人胰岛素对BRL-3A细胞周期的影响
500nmol/L人胰岛素处理BRL-3A细胞3 d后,处于G0/G1期的细胞比例为64.16%±1.73%,显著低于对照组的68.16%±1.36%(P<0.05),而处于S期和G2/M期的细胞比例经过处理后开始增多(图1)。
2.3 人胰岛素对BRL-3A细胞凋亡的影响
用500nmol/L人胰岛素处理BRL-3A细胞3 d后,实验组的凋亡率为2.17%±0.36 %,对照组为2.97%±0.20%,处于早、晚期凋亡的细胞比例比对照显著降低(P<0.05)(图2)。
2.4 人胰岛素对目的基因表达的影响
经500nmol/L人胰岛素作用后JUN 和MYC 无显著表达变化,BAX表达显著下调(P<0.05),而CCNA2表达显著上调(P<0.05)(图3)。
表1 MTT法检测不同质量浓度人胰岛素对BRL-3A细胞增殖的影响Table1 Influence of human insulin on the proliferation of BRL-3A detected by MTT method(±s,n=3)
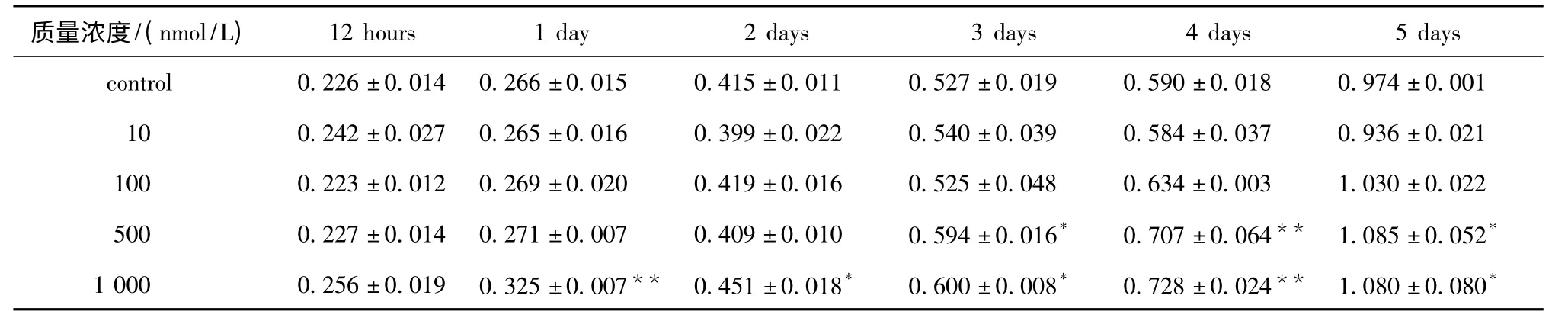
表1 MTT法检测不同质量浓度人胰岛素对BRL-3A细胞增殖的影响Table1 Influence of human insulin on the proliferation of BRL-3A detected by MTT method(±s,n=3)
*P<0.05,**P<0.01 compared with control.
?
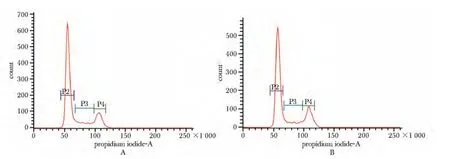
图1 500 nmol/L人胰岛素(HI)处理对BRL-3A细胞周期的影响Fig1 Impact of 500 nmol/L human insulin on cell cycle progression in BRL-3A
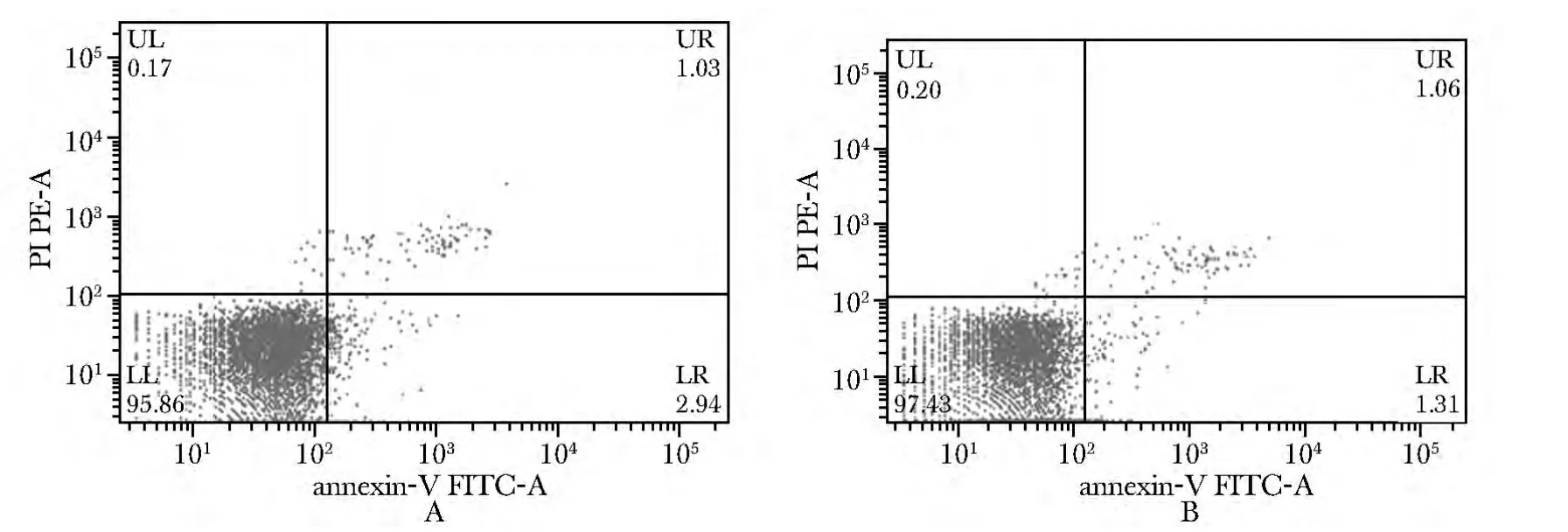
图2 500 nmol/L人胰岛素(HI)处理对BRL-3A细胞凋亡的影响Fig2 Effect of 500 nmol/L human insulin on the apoptosis of BRL-3A cells
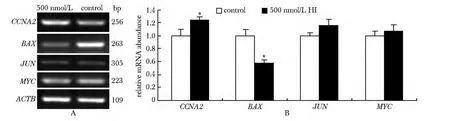
图3 qRT-PCR检测人胰岛素处理后4个目的基因的表达变化Fig3 Expression changes of four target genes after human insulin treatment were detected by qRT-PCR(±s,n=3)
3 讨论
通过体外细胞实验发现,胰岛素可能通过激活大鼠结肠平滑肌细胞(SMCs)的MAPK 通路中的ERK 途径,促进细胞增殖和抑制凋亡[8]。研究胰岛素对大鼠卵泡膜间质细胞的作用时发现,它能诱导该原代细胞增殖,并促进CDK4,CCND3 和PCNA 等蛋白的表达,而用mTOR 抑制剂-雷帕霉素处理后,参与细胞周期G1/S 转换的CCND1 和CCND3 等基因的mRNA表达受到抑制[3]。本研究选择500 nmol/L的人胰岛素处理BRL-3A细胞3 d后发现,处于G0/G1期的细胞比例与对照相比显著降低。通过qRT-PCR 方法继续检测发现,CCNA2基因与对照相比明显上调,却没有发现CCND1 和CCND3 基因的表达上调。CCNA2是编码细胞周期蛋白A2(CCNA2)的基因,CCNA2 可以在S期结合CDK2,在G2/M期结合CDK1,因此CCNA2 对S期和G2/M期的运转至关重要。CCNA2 基因过表达可以促进耳蜗神经祖细胞的增殖[9]。用RNAi 技术敲除人宫颈癌HeLa 细胞的CCNA2 基因后发现,细胞核被膜裂解明显延迟,细胞增殖受抑制[10]。以上结果表明,qRT-PCR检测结果与流式结果具有一致性,CCNA2 可能在人胰岛素处理后参与促进BRL-3A细胞周期的转换,降低G0/G1期细胞的比例,从而促进细胞增殖。
细胞凋亡是指在特定时空发生的、受机体严密调控的细胞自杀现象,是一种基因控制的细胞自主性死亡过程。BAX是与凋亡密切相关的基因,当BAX 过量时,形成BAX 同源二聚体,细胞则趋向凋亡[11]。研究表明,戊地昔布可通过增高BAX表达诱导人乳腺癌MCF-7 细胞的凋亡[12]。此外,胰岛素能通过抑制BAX 基因的表达而抑制神经胶质C6细胞凋亡[13]。与上述研究结果一致,本文的qRTPCR检测结果表明,BAX 基因在500 nmol/L人胰岛素处理后的BRL-3A细胞中明显下调,只有对照的57.43%。因此,大鼠BRL-3A细胞的增殖可能与BAX 基因的下调表达有关。
总之,人胰岛素对大鼠肝细胞BRL-3A 有促进增殖、抑制凋亡的作用,并伴随着CCNA2 基因的表达上调和BAX 基因的表达下调。由此推断,抑制凋亡发生和诱导细胞增殖可能是胰岛素促进BRL-3A细胞增殖的重要机制,然而细胞增殖是非常复杂的过程,涉及的信号通路和具体作用机制还需进一步研究。
[1]Guller S,Corin RE,Mynarcik DC,et al.Role of insulin in growth hormone-stimulated 3T3-cell adipogenesis[J].Endocrinol,1988,122:2084-2089.
[2]Liu S,Li Y,Lin T,et al.High dose human insulin and insulin glargine promote T24 bladder cancer cell proliferation via PI3K-independent activation of Akt[J].Diabetes Res Clin Pract,2011,91:177-182.
[3]Palaniappan M,Menon B,Menon KM.Stimulatory effect of insulin on theca-interstitial cell proliferation and cell cycle regulatory proteins through MTORC1 dependent pathway[J].Mol Cell Endocrinol,2013,366:81-89.
[4]Mizugchi T,Hui T,Palm K,et al.Enhanced proliferentiation of rat hepatocytes cultuerd with bone marrow stromal cells[J].J Cell Physiol,2001,189:106-119.
[5]苏伟燕,徐希明,余江南.原代培养的大鼠肝细胞用于药物代谢的研究进展[J].药物生物技术,2010,17:534-537.
[6]王世美,郑素军,邢欣悦,等.TGF-β1对大鼠肝细胞系BRL-3A凋亡和细胞周期的影响[J].世界华人消化杂志,2011,19:1659-1665.
[7]Wang GP,Xu CS.Reference gene selection for real-time RT-PCR in eight kinds of rat regenerating hEpatic cells[J].Mol Biotechnol,2010,46:49-57.
[8]王宝玉,孙曼怡,林静娜.胰岛素对大鼠结肠平滑肌细胞凋亡及MAPK 通路的影响[J].基础医学与临床,2013,33:726-730.
[9]Zhong C,Han Y,Ma J,et al.Viral-mediated expression of c-Myc and cyclin A2 induces cochlear progenitor cell proliferation[J].Neurosci Lett,2015,591:93-98.
[10]Gong D,Pomerening JR,Myers JW,et al.Cyclin A2 regulates nuclear envelope breakdown and the nuclear accumulation of cyclin B1[J].Curr Biol,2007,17:85-91.
[11]Gavathiotis E,Reyna DE,Davis ML,et al.BH3-Triggered Structural Reorganization Drives the Activation of Pro-apoptotic BAX[J].Mol Cell,2010,40:481-492.
[12]张曼丽,王慧慈,柳金金,等.戊地昔布通过上调ROS诱导人乳腺癌MCF-7 细胞凋亡[J].基础医学与临床,2015,35:491-495.
[13]Ramalingam M,Kim SJ.Insulin involved Akt/ERK and Bcl-2/Bax pathways against oxidative damages in C6 glial cells[J].J Recept Signal Transduct Res,2014,9:1-7.
