骨髓间充质干细胞可分化为溃疡性结肠炎大鼠结肠组织上皮细胞
2015-05-11张夏梦寿折星陈望隆张继红马泽洪任俊红
张夏梦,寿折星,陈望隆,张继红,马泽洪,任俊红
(1.宜昌市第二人民医院 中西医结合科,湖北 宜昌443000;2.华中科技大学同济医学院附属协和医院中西医结合科,湖北 武汉430022;3.三峡大学 医学院,湖北 宜昌443000)
溃疡性结肠炎(ulcerative colitis,UC)是一类病因尚未完全明确的肠道非特异性炎症反应性疾病。骨髓细胞是唯一的胃肠道以外来源的有助于肠上皮再生的细胞,其中骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多分化潜能的细胞,在特定条件下能诱导分化形成各种非造血组织[1-2],且具有很强的免疫调节作用[3]。本实验通过大鼠UC模型,旨在研究MSCs 向结肠黏膜上皮细胞的分化情况,并通过检测MSCs 移植对炎性因子白介素-4(interleukin-4,IL-4)及核因子-κB(nuclear factorκB,NF-κB)表达的影响,为MSCs 移植治疗炎性肠病提供理论和实验依据。
1 材料与方法
1.1 主要试剂
2,4,6-三硝基苯磺酸(Sigma 公司,P2297);大鼠SRY DNA 原位荧光杂交染色系统(天津市灏洋生物公司,RAT2009BIO);兔抗大鼠CK20 单克隆抗体(Abcam 公司,ab76126);NF-κB p65 多克隆抗体(Santa Cruz 公司,sc-8000);浓缩型DAB 显色剂(Bioss 公司,C-0010);羊抗小鼠IgG、SABC-Cy3 试剂盒(武汉博士德公司);SYBR Green 定量PCR 试剂盒(Roche 公司);大鼠白介素4 (IL-4)酶联免疫吸附测定试剂盒(伊莱瑞特公司,E-EL-R0014)。
1.2 实验动物
SPF级SD大鼠,由华中科技大学同济医学院实验动物中心提供,实验动物质量合格证SCKY(鄂)2008-0005,No:4200696100;实验动物设施使用证明SYXK(鄂)2010-0057,No:00116132。3~4周龄雄性大鼠5只,体质量(160±20)g,用于制备MSCs;6~8周龄雌性大鼠30只,体质量(250±20)g,用于分组实验。
1.3 MSCs的分离、传代与鉴定
收集雄性大鼠骨髓细胞,置于CO2细胞培养箱中培养。传代培养,取第3代细胞留用。采用荧光标记的CD29、CD90、CD45 及CD11b,用流式细胞学方法鉴定MSCs。
1.4 UC模型制备及干预
1.4.1 模型制备:用三硝基苯磺酸(TNBS)/乙醇复合法局部灌肠法建立溃疡性结肠炎大鼠模型。
1.4.2 分组:将雌性大鼠随机分为:正常组、模型组、MSCs组,每组10只。模型组和MSCs组建立大鼠UC模型。24 h后,正常组和模型组经尾静脉注入0.9% 氯化钠溶液1 mL;MSCs组经尾静脉注入1×106MSC s 悬液1 mL。
1.4.3 取材:建立模型后,观察大鼠日常活动、进食以及腹泻和黏液脓血便情况。2周后,留取每只大鼠远端结肠组织长约8 cm,比较各组大鼠结肠组织病理学变化。取病变明显的结肠组织标本。
1.5 荧光原位杂交结合免疫荧光染色
1.5.1 Y染色体DNA 荧光原位杂:交采用荧光原位杂交(SRY FISH)及DAPI 复染技术检测,按照大鼠SRY FISH 试剂盒说明书操作以及按DAPI 说明书步骤染色。
1.5.2 免疫荧光染色检测CK20表达:结肠组织连续切片、拷片、脱蜡复水;抗原修复后,孵育,封闭,滴加兔抗大鼠CK20 单克隆抗体,4℃过夜;滴加生物素化羊抗大鼠抗体,孵育;加SABC-CY3,封片;滴加DAPI 避光孵育,核复染;用含抗荧光淬灭剂的封片液封片。
1.5.3 采集荧光图像:各组结肠组织切片按以上步骤处理后,在荧光显微镜下,FAM 激发波长λ=510 nm,观察采集位于细胞核内的黄绿色荧光图像。DAPI 激发波长λ= 360 nm,观察采集细胞核内的蓝色荧光图像。CY 3 激发波长λ = 550 nm,观察采集位于细胞质的红色荧光。应用Imagepro3Dss.1 图像处理软件进行图片扫描、取图、图像叠加。
1.6 RT-PCR 技术检测CK20、NF-κB、IL-4的表达
按照TRIzol 试剂盒说明书提取结肠组织细胞总RNA,反转录成cDNA。取2 μL 转录产物作模板,引物序列如下:β-actin 正向:5'-CACGATGGA GGGGCCGGACTCATC-3',β-actin 反向:5'-TAAAG ACCTCTATGCCAACACAGT-3',扩增长度240 bp;Rat CK20 正向:5'-ATGCGGATAACTGTGGAAGC-3',Rat CK20 反 向:5'-CCTCCACGTTGACATTGTTG-3',扩增长度187 bp;Rat NF-κB 正向:5'-CCGTGAGGC TGTTTGGTTTG-3',Rat NF-κB 反 向:5'-GGTCTGCC CTCCTGACTCTA-3',扩增长度92 bp;Rat IL-4 正向:5'-GTACCAGACGTCCTTACGGC-3',Rat IL-4 反向:5'-CTCAGTTCACCGAGAACCCC-3',扩增长度143 bp;反应条件为:94℃4 min,94℃30 s,54℃30 s,72℃25 s;30个循环,72℃4 min,4℃4 min。采用2-△△Ct方法分析各组相对基因表达差异。
1.7 Westen blot检测NF-κB蛋白的表达
取-80℃低温保存的结肠组织,测定蛋白浓度,制成含蛋白量相等的样品,经电泳、转膜、封闭,加入一抗,4℃孵育过夜;TBS 洗膜3次,加入辣根过氧化物酶耦联的二抗室温孵育2 h,ECL 显色剂显色,用Bio Rad 密度扫描仪进行扫描,测定各蛋白的相对吸光度值。
1.8 ELISA 检测结肠组织中IL-4 含量
将组织样品称重,按组织质量∶PBS 体积=1∶9的比例用预冷的PBS 将组织样品匀浆,4℃10 000 r/min 离心10 min,小心吸取上清检测。ELISA 实验步骤参照说明书进行,采用酶标仪测A值。
1.9 统计学分析
采用SPSS17.0 软件进行统计学数据分析,计量资料数据以均数±标准差(±s)表示,采用单因素方差分析,两两比较用LSD 法。
2 结果
2.1 MSC 形态学特征及鉴定
接种24 h后可见散在分布的贴壁细胞,为短梭形、椭圆形、长梭形;15 d后,细胞的体积增大,呈旋涡状排列。经消化、传代后,第3代MSCs 在24 h 内即可完全贴壁、伸展,呈纺锤状形态。第3代MSCs表达CD29 和CD90,不表达CD45 和CD11b,可判定最终培养的细胞为MSCs(图1,2)。
2.2 造模临床观察
模型组和MSCs组大鼠大部分出现竖毛、活动减少、饮食减少,并出现稀便和黏液脓血便,说明UC造模成功。
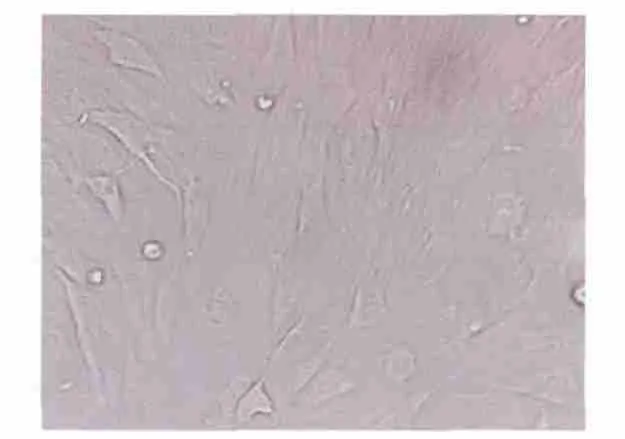
图1 第3代MSCsFig1 The MSCs of passage 3(×200)

图2 F3代MSCs 流式细胞仪检测结果Fig2 Flow cytometry analysis of passage 3 MSCs
2.3 组织病理观察
模型组大鼠结肠有明显的充血水肿,黏膜结构异常,伴坏死和糜烂,部分黏膜上皮损伤脱落,杯状细胞减少,炎性细胞侵袭全层;MSCs组大鼠结肠黏膜结构尚完整,上皮轻度损伤,杯状细胞增多,充血水肿较轻,溃疡较浅表,炎性细胞侵袭减少(图3)。
2.4 Y染色体和CK20 双阳性细胞表达
结肠组织切片可见位于细胞质的红色荧光,即CK20 阳性,主要分布于结肠黏膜上皮细胞;MSCs组结肠组织切片可蓝色荧光的细胞核内有绿色荧光亮点,即Y染色体SRY FISH 阳性表达,在结肠组织肠黏膜上皮和固有层均有分布。部分Y染色体阳性细胞,可见位于细胞质的红色荧光,即Y染色体和CK20 双阳性细胞表达(图4)。
2.5 RT-PCR检测结果
模型组及MSCs组CK20表达较正常组增高P<0.01),MSCs组表达高于模型组(P<0.01),模型组和MSCs组NF-κB表达高于正常组,IL-4表达低于正常组(P<0.01);MSCs组NF-κB表达低于模型组,IL-4表达高于模型组(P<0.01)(表1)。

图3 各组大鼠病变结肠组织病理观察Fig3 Pathologic changes of the colonic tissues of rats in respective experimental group(×100)

图4 SRY FISH 和CK20 免疫荧光染色Fig4 Fluorescent Y chromosome in situ hybridization and immunofluorescent staining of CK20(×400)
表1 各组CK20、NF-κB、IL-4 mRNA 相对表达结果Table1 The mRNA expression of CK20,NF-κB and IL-4 in different groups (±s,n=10)

表1 各组CK20、NF-κB、IL-4 mRNA 相对表达结果Table1 The mRNA expression of CK20,NF-κB and IL-4 in different groups (±s,n=10)
*P<0.01 compared with normal control group;#P<0.01 compared with model group.
group CK20 NF-κB IL-4 normal control 1.060±0.193 0.981±0.130 1.03 5±0.104 model 1.758±0.320* 3.546±0.593* 0.178±0.038*MSCs 2.564±0.429# 1.758±0.221# 0.518±0.029#
2.6 Westen blot检测结果
模型组NF-κB表达显著高于正常组(P<0.01),MSCs 干预组NF-κB表达显著下降(P<0.01),但仍高于正常组(P<0.01)(图5)。
2.7 ELISA 检测结果
模型组及MSCs组IL-4的水平较正常组显著减低(P<0.01),而MSCs组中IL-4的水平比模型组升高(P<0.01)(图6)。

图5 Western blot检测NF-κB蛋白的表达Fig5 The expression of NF-κB proteins detected by Western blot(±s,n=10)

图6 ELISA 检测IL-4的表达Fig6 The expression of IL-4 detected by ELISA(±s,n=10)
3 讨论
结肠黏膜上皮细胞是维持肠道功能的结构基础,UC 常常伴结肠黏膜上皮细胞凋亡加速[4],且由于肠道内产生大量炎性细胞因子及介质,加剧损伤肠黏膜屏障功能[5]。因此抑制肠道炎性反应、修复上皮细胞从而改善肠上皮屏障功能是治疗UC的新思路。
MSCs 有提高受损上皮再生的能力,可能是上皮细胞再生的来源[6]。有研究证明MSCs 能通过分化为上皮细胞促进损伤气道黏膜的修复[7]。本实验检测到雌性大鼠结肠组织中出现带Y染色体标志的雄性供体来源的细胞,主要分布在结肠黏膜上皮及固有层。同时检测大鼠结肠组织上皮细胞表型特征标志物细胞角蛋白20(CK20),CK20表达范围特异,能在胃肠道组织的上皮细胞中表达,可作为检测结肠黏膜上皮细胞的特征性指标。证明结肠组织部分上皮细胞是雄性供体来源的MSCs 分化而成的新生上皮细胞。
免疫异常是UC 发病的重要因素[8]。MSCs 具有很强的免疫调节能力,可以抑制T细胞、B 细胞增殖、影响树突细胞的成熟及功能[9]。NF-κB 和IL-4与UC的发生发展密切相关。本研究表明,MSCs 能通过调节NF-κB 和IL-4的表达,改善肠道的炎性反应状态,另外通过分化为结肠组织上皮细胞,促进黏膜上皮的修复。
[1]王志红,郭坤元,邓兰,等.骨髓间充质干细胞移植减轻衰老大鼠肠损伤[J].基础医学与临床,2011,31:1026-1031.
[2]文通,魏云峰,王梦洪,等.microRNA-1 诱导大鼠骨髓间充质干细胞向心肌样细胞分化[J].基础医学与临床,2011,31:41-46.
[3]孙昭,韩钦,赵春华.骨髓和脂肪来源的间充质干细胞免疫调节作用的比较[J].基础医学与临床,2012,32:128-132.
[4]Scarpa M,Castagliuolo I,Castoro C,et al.Inflammatory colonic carcinogenesis:a review on pathogenesis and immunosurveillance mechanisms in ulcerative colitis[J].World J Gastroenterol,2014,20:6774-6785.
[5]Boldeanu MV,Silosi I,Ghilusi M,et al.Investigation of inflammatory activity in ulcerative colitis[J].Rom J Morphol Embryol,2014,55:1345-1351.
[6]Li K,Han Q,Yan X,et al.Not a process of simple vicariousness,the differentiation of human adipose-derived mesenchymal stem cells to renal tubular epithelial cells plays an important role in acute kidney injury repairing[J].Stem Cells Dev,2010,19:1267-1275.
[7]Kokubun K,Pankajakshan D,Kim MJ,et al.Differentiation of porcine mesenchymal stem cells into epithelial cells as a potential therapeutic application to facilitate epithelial regeneration[J].J Tissue Eng Regen Med,2013,doi:10.1002/term.1758.
[8]Maul J,Zeitz M.Ulcerative colitis:immune function,tissue fibrosis and current therapeutic considerations[J].Langenbecks Arch Surg,2012,397:1-10.
[9]Yi T,Song SU.Immunomodulatory properties of mesenchymal stem cells and their therapeutic applications[J].Arch Pharm Res,2012,35:213-221.
