N1923萃取钒渣无焙烧浸出液中钒的实验探究
2015-05-11张莹张廷安
张莹, 张廷安
(东北大学多金属共生矿生态化利用教育部重点实验室,沈阳110819)
钒作为非常宝贵的战略性资源,其最大的用途在于冶炼含钒高强度低合金钢,在机械加工,汽车制造和航空航天等领域用途广泛[1].可用来生产钒的主要原料有钒钛磁铁矿、石煤矿、钒铀矿、废石油催化剂等资源,其中,钒钛磁铁矿在冶炼过程中产生的转炉钒渣占提钒原料的88%[2]左右.工业上主要采用焙烧-浸出工艺对钒渣进行提钒,其流程普遍存在焙烧过程能耗高、排放CO、Cl2等有害气体、工艺流程较长等缺点,寻找低污染、高效率的提钒工艺己成为钒冶炼工业中一个亟待解决的问题[3].结合攀西地区钛白废酸污染问题,李尚勇等[4]创新性地提出了以转炉含钒渣为原料,使用钛白废酸作为钒渣浸出剂的无焙烧加压酸浸提钒新技术.
但在此技术中,钒渣是物相组成非常复杂的含钒矿物,同时钛白废酸中含有大量杂质元素,浸出过程中钒氧化物将以不同的价态伴随多种变价元素共同进入浸出液.因此,对浸出液中钒的高效、高选择性提取成为了此项技术的关键.考虑到溶剂萃取法具有分离效果好、选择性强、回收率高易于连续操作等优点[5],本文在N1923协同仲辛醇萃取体系中,以正交试验设计、配合单因素试验考察了促进剂用量(仲辛醇)、反应温度、初酸浓度、相比(A/O)、反应时间等条件对无焙烧浸出液中钒萃取率的影响.
1 研究方法
1.1 原料及方法
实验所用原料为四川攀枝花钢铁厂所生产的转炉钒渣,其主要成分见表1.图1为钒渣的XRD分析结果,其显示钒渣中主要物相为钒钛铁相、硅酸盐相,其中钒主要是以铁、钛、锰、铝、硅等夹杂共生矿的形式存在.实验采用的钛白废酸由模拟工业生产中钛白废酸的主要成分制备得到.

表1 转炉钒渣的化学成分(质量分数,%)Table 1 Chem ical com position of converter vanadium slag(m ass fraction,%)

图1 转炉钒渣的XRD图谱Fig.1 XRD patterns of converter vanadium slag
在浸出温度130℃(二段140℃)、浸出时间90 min、钒渣粒度 0.055~0.075 mm(200~600 目)、搅拌速率500 r/min、初酸浓度 200 g/L,液固体积比(VL/VS)10∶1条件下二段浸出液中有价元素成分如表2所示.

表2 浸出液中有价元素成分Table 2 Valuable elem ents leaching solution
实验所需药品主要有用磺化煤油(纯度>99.8%)、NaOH(分析纯)、氨水(分析纯)、N1923 仲辛醇(分析纯).浸出液经过滤分离及氨水调节pH预处理后(调酸后原液中 C[V(T)]=11.7 g/L),以伯胺 N1923 作为萃取剂,煤油为稀释剂,仲辛醇为相调节剂,按相应相比(A/O)与有机相一起加入125 mL分液漏斗,后放入SHA-C型水浴振荡器进行萃取.采用全谱直读等离子光谱发射仪(ICP)检测得液体中有价元素的含量,钒萃取率根据化学平衡计算得出.
1.2 实验原理
在无焙烧酸浸过程中,高酸通氧条件下钒渣中钒几乎全部以五价钒的形式浸出.通过绘制酸浸过程中的相应体系电位-pH图,如图2为高温下V-Fe-H2O电位-pH图[6],经电位及酸度测定可知在相应酸浸条件下,钒主要以四价和五价的形式与其它变价元素Fe2+、Fe3+、Mn2+、Cr2+、Al3+共同浸出[7].经萃取前中和处理后相应浓度下硫酸浸出液中大部分钒以H2V10O284-的形式存在,少部分以VO2+及VO2+的形式存在.
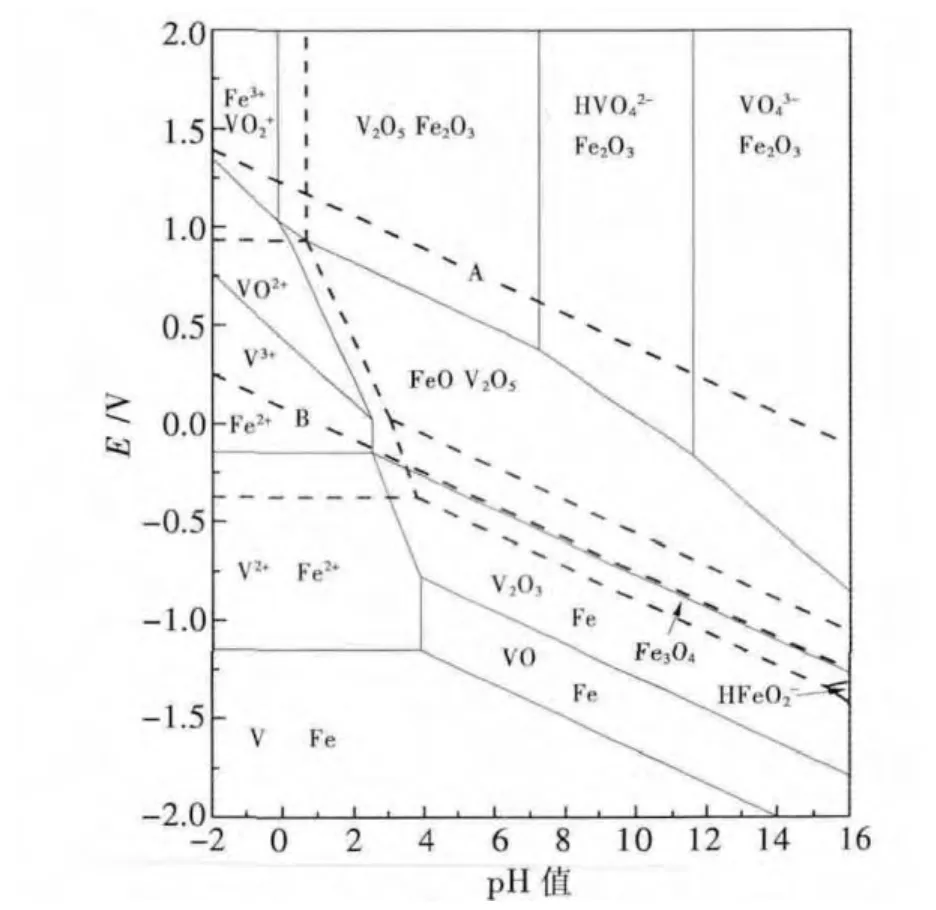
图2 高温V-Fe-H 2O系电位-pH图Fig.2 E-pH diagram of V-Fe-H 2O system at high tem peratures
传统酸性溶液中主要采用酸性磷型萃取剂P204萃取提钒,但其通常以阳离子交换机理进行萃取,且其对三价铁离子选择性较高,并不适宜高铁与钒氧聚合阴离子(H2V10O284-)共存溶液中的钒铁分离.故本实验采用仲碳伯胺N1923(简写为RNH2)作为萃取剂,与钒氧聚合阴离子进行阴离子交换萃取,同时可避免大量三价铁离子进入有机相.与使用普遍的磷型萃取剂(如P204)相比,可采用中性反萃体系反萃,克服了酸性反萃体系带来的弊端,从而降低了中和剂的使用和污水处理量.但由于此萃取体系实验条件较难控制[8],为有效地确定较优实验范围及条件,选用正交试验设计配合单因素试验进行实验探究.
在酸性介质中,V(V)易被伯胺选择性萃取,实现与铁、锰等离子分离,而V(IV)却几乎不被伯胺萃取,但伯胺盐能从酸性溶液中萃取V(IV)[9].本实验采用伯胺煤油溶液和1mol/L的硫酸平衡,然后用5%硫酸钠溶液洗至中性,得到伯胺盐,其组成为(RNH3)2SO4[10].主要萃取反应如式(1),式(2)所示:

2 结果与讨论
2.1 正交试验设计
根据实验研究结果,可确定在温度为0~50℃,水相 pH 值>1.2,仲辛醇为 0~15%,相比(VA/VO)<2∶1,萃取时间>2 min时,为较佳萃取实验条件范围.为直观反映N1923萃取体系萃取钒的实验规律,初步判断各因素对钒萃取影响主次顺序,本实验设计了5因素4 水平的 L16(4,5)正交实验方案[11],并对实验结果进行了计算分析.正交试验设计实验结果如表3所示,其中萃取剂N1923的用量为20%(有机相中体积分数).

表3 N1923体系正交试验设计表Table 3 Orthogonal design table of N1923
各因素对钒浸出率影响的直观分析结果如表3所示,从极差计算结果和方差分析结果可以看出各因素对钒浸出的影响从大到小依次是:仲辛醇>温度>时间>A/O>pH.正交结果分析得到各因素对钒浸出率影响的效应曲线,如图3、图4.

图3 仲辛醇用量正交结果分析效应曲线Fig.3 Effect graph of octanol am ount

图4 萃取时间正交结果分析效应曲线Fig.4 Effect graph of extraction tem perature
由图3可知,仲辛醇的增加量对钒萃取影响显著,其过量加入将使有机相对钒的萃取效率大为降低.这是因为仲辛醇在N1923萃取体系中主要起着相调节剂的作用[12],其可能存在一定反协萃效果.在实验中可观察到不加仲辛醇时,有机相在萃取后与萃余相分相困难,混合相较厚且消失缓慢.而加入少量仲辛醇后,萃取后两相分相界线明显,有机相较为清亮.故仲辛醇的加入量不宜过多,控制在5%左右.
如图4所示,萃取时间的增加也不利于钒萃取的进行,水相中钒酸根离子与萃取剂之间的萃取反应发生相当迅速,过长的萃取时间将促使钒酸根离子重新回到水相当中,同时伴随着其他各种杂质元素(Fe、Al等)萃取反应的发生将使水相pH变化,且易产生乳化相分层缓慢[13].故萃取时间应控制在2 min左右.
由图5可知,水相初始pH对钒萃取率呈现一定不规律性,这是由于随着萃取反应的发生,体系中酸度变化大且不易控制,引起溶剂表面活性的改变,将对金属元素萃取造成一定影响.实验中观察到,水相pH值为1.4左右时,萃取过程中水相中pH变化不大,萃取过程进行顺利.萃取调节水相pH值大于1.8后,水相中Fe3+开始大量水解并吸附一部分钒造成钒损失,对萃钒造成不利影响,需加入一定量稀硫酸对pH进行调整.由正交实验极差和方差分析可知,对于N1923萃取体系,pH对萃取影响程度较小,为减少中和剂用量,较合理的水相初始pH值为1.4.
而从图6中可以看到当温度上升时,钒萃取率出现大幅下降,之后出现一定回升.而图7显示相比的增加将使钒萃取率持续上升.为进一步掌握萃取温度和相比对钒和其他元素萃取规律的影响,本文将配合单因素实验继续探究.

图5 水相初始pH正交结果分析效应曲线Fig.5 Effect graph of aqueous phase initial pH

图6 温度正交结果分析效应曲线Fig.6 Effect graph of extraction tem perature

图7 相比(V A/V O)正交结果分析效应曲线Fig.7 Effect graph of phase ratio(V A/V O)
2.2 单因素试验
在实验条件为:有机相组成为20%N1923-5%仲辛醇-75%磺化煤油、水相初始pH=1.4、震荡时间2 min,分别考察不同萃取温度(VA/VO=1∶2)、不同相比(常温)对钒、铁等萃取率的影响,结果如图8、图9所示.

图8 萃取温度对V、M g、Fe、M n、A l萃取率的影响Fig.8 Effect of tem perature on extraction rates of V,M g,Fe,M n and A l

图 9 不同相比(V A/V O)对 V、M g、Fe、M n、A l萃取率的影响Fig.9 Effect of different(V A/V O)ratio on extraction rates of of V,M g,Fe,M n and A l
由图8可知,当温度由25℃升高到45℃时,钒的萃取率出现先减小后增大的趋势,其它元素萃取率出现小范围不规则性.是由于随着萃取温度升高,体系内能增大,分子热运动加剧,原来相对静止有序的界面膜层遭到破坏.同时相关研究发现[14],萃取温度升高到一定程度时有机相电导率Q呈下降趋势,说明原来增溶到有机相中的水化分子随温度升高而离开有机相返回水相的趋势增大,不利于萃取反应的进行[15].因此,实验时的温度不宜过高,常温萃取即可.
如图9所示,钒萃取率随着相比(VA/VO)的减小而迅速提高,与分离杂质元素分离效果增强.其在相比(VA/VO)<2.5 后增长缓慢,在相比(VA/VO)=3 达到最大值77.69%后迅速降低.这是因为过低的相比将使水相pH值随之上升,液相中铝、铁、磷等离子将发生水解[16],产生沉淀,吸附一定量的钒离子进入渣相,导致钒的损失.故采用中低相比进行萃取的过程中,需加入相应硫酸(1+1),以调节水相适宜的酸度范围[17].故实验采用萃取相比(VA/VO)=1∶3较为合适.
因此可确定针对钛白废酸无焙烧浸出液,20%N1923-5%仲辛醇-70%磺化煤油体系中最佳萃取工艺条件为:常温下,水相初始 pH=1.4,相比(VA/VO)=1∶3,萃取时间为2min.此条件下可算得钒与各元素的分配比及分离系数如表4、表5所示:

表4 萃取体系中各元素的萃取因素Table 4 Distribution rate of each elem ent in extraction system

表5 萃取体系中钒和各元素的分离系数Table 5 Distribution cofficient of each element in extraction system
2.3 多级逆流实验
根据Kremser方程[18],若设经过n级逆流萃取后萃余液中A的萃余分数qA=0.001,可计算得,n=4.实验条件为常温下,水相初始 pH=1.4,相比(VA/VO)=1∶3,萃取时间为2min,在125 mL梨形分液漏斗中进行同时出水相和有机相的4级逆流萃取模拟实验,实验结果见表6.
如表6所示,4级逆流萃取经过2次循环达到平衡后,单级萃取率稳定在83%左右,钒总萃取分数达到0.999 205,与多级计算结果相符.
2.4 萃合物的红外光谱研究
常温下,水相初始 pH=1.4,相比(VA/VO)=1∶3,萃取时间为2min,20%N1923-5%仲辛醇-75%磺化煤油体系中,空载N1923与负载V(V)N1923盐的红外光谱如图10所示.
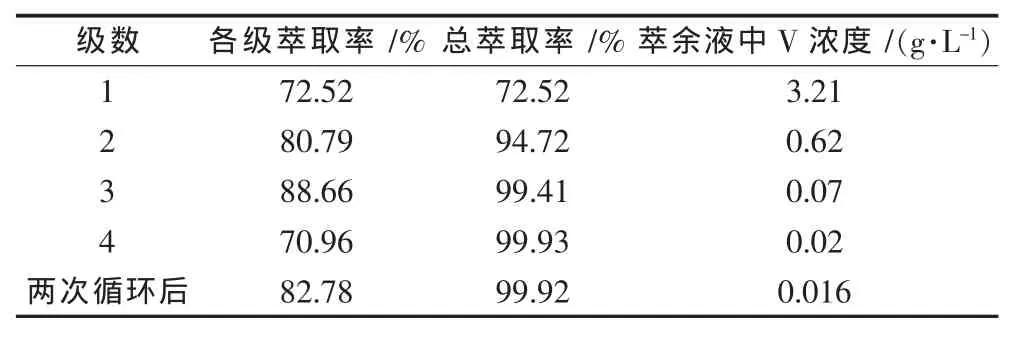
表6 浸出液多级逆流萃取结果Table 6 Resu lts ofm u ltistage counter-current extraction for leaching solution
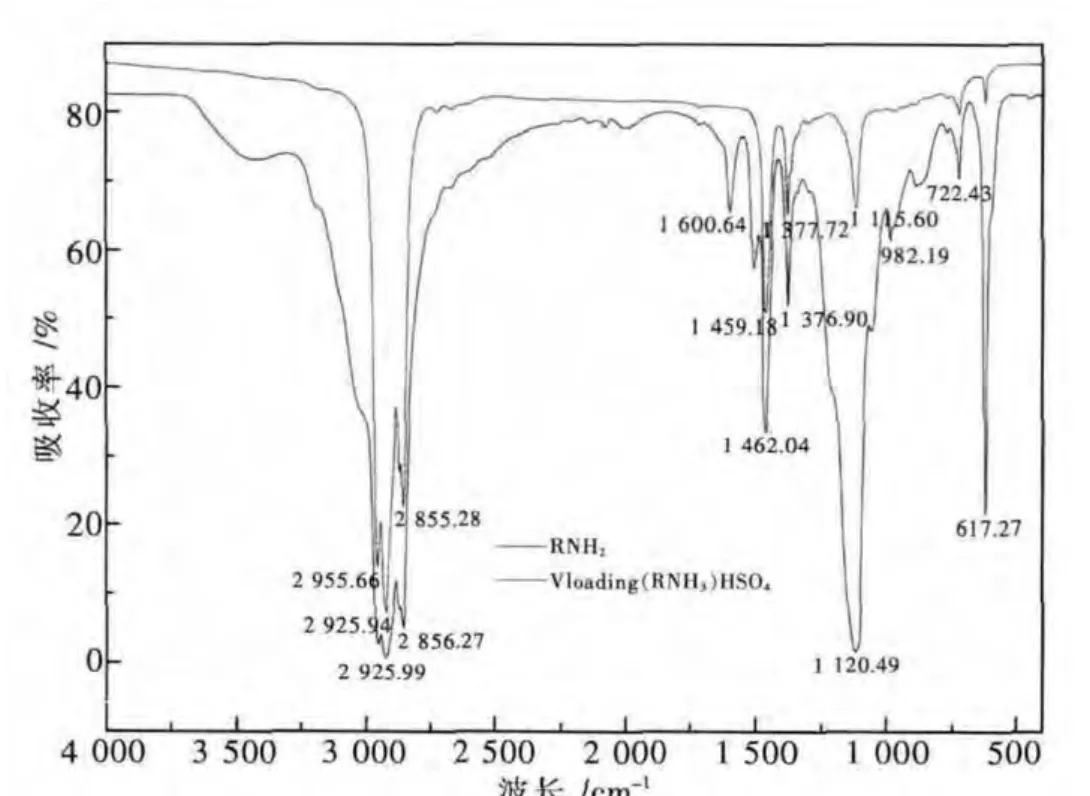
图10 N1923与负载V(V)N1923盐的红外光谱Fig.10 IR-spectroscopy of RNH 2(N1923) and V loading(RNH 2)HSO4
由图10可以看出,N1923用酸处理转化为伯胺盐后,[-NH3]+离子和酸根阴离子之间强烈的晶格作用,使N-H伸缩振动频率大幅降低、吸收强度增加,呈现出一个3 600~2 400 cm-1波长范围内宽而强的谱带,其内杂多峰是 v(N+H3)和 v(CH2)吸收谱带相互重叠的结果,而在1 600 cm-1和1 500 cm-1处的2个较弱谱带为铵盐中 δ(N+H3,as)和 δ(N+H3,s)吸收带,而此谱带向低频方向移动可能为氢键引起的,伯胺盐萃取钒后,982 cm-1附近出现吸收峰,为V=O键的伸缩震动频率[19].萃取后在1 120 cm-1和617 cm-1吸收峰明显增强,其分别为 SO42-的 v3、v4基频峰[20],可能是由于萃取的过程伯胺盐中游离出HSO4-后转化为SO42-,使其特征振频红外活性增强.说明钒氧根阴离子应以的氢键形式与伯胺盐结合,并把伯胺盐中HSO4-置换出来.
3 结 论
1)转炉钒渣钛白废酸浸出液中钒(V)主要以VO2+、H2V10O284-的形态伴随着其余变价元素如铁、锰、镁等共同存在.
2)正交试验及单因素实验结果表明,最佳萃取工艺条件为:常温下,20%N1923-5%仲辛醇-75%磺化煤油体系,水相初始 pH=1.4,相比(VA/VO)=2∶1,萃取时间为2min.此时,钒单级萃取率可达77.69%以上,四级逆流萃取率可达99.9%.
3)通过红外光谱分析,初步判断出伯胺盐萃取体系对五价钒萃取反应机理,钒氧酸根阴离子在适宜条件下把伯胺盐中HSO4-置换并以的氢键形式与伯胺盐结合进入有机相.
[1]有色金属提取冶金手册编辑委员会.稀有高熔点金属[M].北京:冶金工业出版社,1999.
[2]陈家镰.湿法冶金手册:钒、铬的湿法冶金[M].北京:冶金工业出版社,2005.
[3]杨守志.钒冶金[M].北京:冶金工业出版社,2010.
[4]李尚勇,谢刚,俞小花,从含钒浸出液中萃取钒的研究现状[J].有色金属,2011,63(1):100-104.
[5]张廷安,牟望重,豆志河,等.一种利用含钒钛转炉渣的湿法提钒方法[P].CN201010514573.8,2011-02-09.
[6]Zhang G Q,Zhang T A,Lv G Z.Extraction of vanadium from LD Converter slag by pressure leaching process with titanium white waste acid[J].Rare Metal Materials and Engineering, 2015,44 (8):1894-1898.
[7]Moskalyk R R,Alfantazi A M.Processing of vanadium: a review[J].M ineral Engineering,2003,16(9): 793-805.
[8]Wang L,Zhang Y M,Liu T,et al.Comparison of ion exchange and solvent extraction in recovering vanadium from sulfuric acid leach solutions of stone coal[J].Hydrometallurgy,2013,131/132(2):1-7.
[9]Li M T,Wei C, Fan G,et al.Extraction of vanadium from black shale using pressure acid leaching[J].Hydrometallurgy,2009,98(9):308-313.
[10]杨佼庸,刘大星.湿法冶金技术丛书:萃取[M].北京:冶金工业出版社,1988.
[11]张莹,张廷安,张国权,等.转炉钒渣钛白废酸无焙烧浸出液萃取提钒正交试验设计研究[C]//第十七届全国冶金反应工程学术会议论文集,北京:中国金属学会,2013.
[12]Chen L,Liu F Q,Li D B.Precipitation of crystallized hydrated iron(III) vanadate from industrial vanadium leaching solution[J].Hydrometallurgy,2011,105(2): 229-233.
[13]杨天林.水相pH值、水相介质及温度对N1923界面吸附性能的影响[J].宁夏大学学报,2003,24(1):81-83.
[14]Feng QM ,He D S,Zhang G F,et al.Effect of vanadium oxidation and conversion on vanadium leaching in extraction ofvanadium from stone coal[J].The Chinese Journal of Nonferous Metals,2007,17(8):1348-1352.
[15]Angelidis TN,Tourasanidis E,Marinou E,etal.Selective dissolution of criticalmetals from diesel and naptha spent hydrodesulphurization catalysts[J].Resources,Conservation and Recycling,1995 (13):269-282.
[16]Lozano L J,Godinez C.Comparative study of solvent extraction of vanadium from sulphate solutionsby primene 81R and alamine 336[J].Miner Eng,2003 (16):291-294.
[17]Wei C,Deng Z G,Li M T, et al.Selective solvent extraction of vanadium over iron from a stone coal/black shale acidleach solution by D2EHPA/TBP[J].Hydrometallurgy,2011,105:359-363.
[19]曾平,王贵清.N1923盐萃取V(V)的机理及其光谱研究[J].稀有金属,1985,19(3):191-195.
[20]马建华,孙思修.伯胺N1923萃取醋酸的研究[J].应用化学,1997,14(3):70-73.
