大鼠脊髓半横断损伤后胶质细胞反应性增生的变化规律及意义*
2015-05-10余资江林金棠
邹 云, 余资江, 林金棠
(贵州医科大学, 贵州 贵阳 550004)
大鼠脊髓半横断损伤后胶质细胞反应性增生的变化规律及意义*
邹 云, 余资江**, 林金棠
(贵州医科大学, 贵州 贵阳 550004)
目的: 探讨脊髓损伤(SCI)后神经胶质细胞反应性增生的变化规律及其在损伤修复中的可能机制。方法: 将70只雄性成年SD大鼠随机分为正常组(10只)、假手术组(10只)及模型组(行T10脊髓右侧半切术,术后分为1,7,14,21及28 d组,每组各10只),术后于相应时间点采用BBB法行后肢神经功能评分,评分后处死大鼠,分别行HE染色及免疫组化染色,观察各组大鼠SCI后的损伤部位脊髓的组织形态学变化,GFAP及MBP阳性细胞。结果: (1)BBB评分,模型组大鼠麻醉清醒后即出现瘫痪,术后7 d伤侧后肢运动功能开始好转,神经功能逐渐恢复,14 d时恢复最明显;(2)HE染色,模型组大鼠术后1 d可见损伤区域弥漫性出血,神经元变性、坏死,7 d时炎性细胞浸润,14~21 d时囊腔形成,术后28d脊髓损伤处被瘢痕组织替代;(3)GFAP阳性细胞,模型组GFAP表达较正常组及假手术组均增加,星形胶质细胞增生、肥大,术后14 d星形胶质细胞增生达到高峰;(4)MBP阳性细胞,模型组术后1 d MBP表达明显降低,损伤区域内髓鞘破坏,术后7 d轴突间隙增宽,MBP表达开始升高,术后14 d轴突间隙扩大。结论: SCI后,大鼠后肢神经功能的恢复可能与星形胶质细胞及少突胶质细胞反应性增生有关。
脊髓损伤; 神经胶质细胞; 胶质纤维酸性蛋白; 髓鞘碱性蛋白; 大鼠,Sprague-Dawley
脊髓损伤是由于外伤、炎症、肿瘤等原因引起脊髓的横贯性损害而出现损伤平面以下的运动、感觉、括约肌等功能障碍,其致残率、发病率高,给患者带来巨大的心理问题,也给家庭和社会带来沉重的负担。现已明确脊髓损伤(spinal cord injury,SCI)的病理变化机制是原发性损伤和继发性损伤[1]。继发性损伤是神经功能恢复的主要障碍,是目前研究的热点。在继发性损伤中胶质细胞发挥着重要的作用,各种原因引起的中枢神经系统(central nervous system,CNS)损伤,均能激活星形胶质细胞,胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)合成增加[2],同时释放大量神经营养因子,参与神经损伤修复;同时,星形胶质细胞的突起包裹周围的损伤区域,形成胶质瘢痕[3-4]。少突胶质细胞是CNS中第3类重要的细胞,主要参与髓鞘形成,其产生的髓鞘碱性蛋白(myelin basic protein, MBP)是髓鞘的特异性标记物,检测MBP的表达情况,可反映损伤后神经脱髓鞘病变的情况[5]。在SCI中,细胞增生和相关特异性标志蛋白表达变化是胶质细胞活化的标志,本研究观察SCI后神经胶质细胞反应性增生与大鼠后肢神经功能恢复的变化规律,探讨星形胶质细胞和少突胶质细胞反应性增生在SCI修复中的可能作用。
1 材料与方法
1.1 主要材料
伊红、苏木精购于北京索莱宝生物科技有限公,兔抗GFAP多克隆抗体、兔抗MBP多克隆抗体购于武汉博士德生物公司,RM2016轮转切片机购于上海徕卡仪器有限公司,自备常规手术器械。
1.2 方法
1.2.1 实验动物分组及手术方法 选择健康成年雄性SD大鼠70只,体重250~300 g,随机分为正常组(10只),假手术组(10只)及 模型组(手术后1,7,14,21及28 d组,每组10只),模型组参照黄国钧等[6]的动物模型制作方法造模,行T10脊髓右侧半切术。大鼠麻醉后常规消毒铺巾,俯卧位固定大鼠,定位T10棘突。切开T9~T11皮肤,分离两侧棘突旁肌肉,暴露T9~T11棘突和椎板,固定T10椎板,小号持针器仔细摘除T10棘突、右侧椎板至右侧关节突,充分暴露手术视野,定位中线,将尖刀片刀背对着正中沟,刀锋向右向脊髓内垂直刺入切断右半侧脊髓,止血,青霉素冲洗切口,逐层缝合。假手术组只摘除棘突和椎板,正常组常规分笼饲养。
1.2.2 大鼠后肢神经功能评分 各组于相应时间点采用BBB法[7]行后肢运动功能评分,观察SCI后后肢功能恢复情况。BBB评分是根据动物髋、膝、踝、趾、前后肢协调运动等情况评定运动功能恢复情况,分22级,0~21分。采用双盲、双人独立观察记录,最后取平均值。
1.2.3 观察指标 各组于相应时间点灌注取材:大鼠麻醉后开胸,暴露心脏,经左心室插管,先后灌注0~9%生理盐水和4%多聚甲醛溶液各250 mL,取出以脊髓损伤区为中心长约3 cm完整脊髓组织。后固定24 h后行石蜡包埋,LEICA RM2016轮转切片机纵形连续切片,片厚调整为5 μm,按“隔五取二”原则贴片,分别行HE染色观察受损部位脊髓形态学改变,免疫组化染色观察受损部位脊髓GFAP和MBP阳性细胞表达,按照说明书进行操作。
1.3 统计学方法

2 结果
2.1 大鼠后肢神经功能评分(BBB法)
正常组大鼠后肢感觉运动功能无异常。假手术组:大鼠麻醉清醒后即可四处活动,术后2~3 d伤侧后肢功能基本恢复正常。模型组:大鼠麻醉清醒后即出现瘫痪症状,感觉功能明显异常,术后7 d伤侧后肢运动功能开始好转,神经功能逐渐恢复,术后14 d时恢复最明显。见表1。
2.2 受损部位脊髓组织学图片
正常脊髓切片中神经元结构完整,数量较多,胞核大而圆,核仁明显;模型组术后1 d损伤处可见弥漫性出血,细胞大量坏死;术后7 d出血明显减少,炎性细胞浸润;术后14 d时炎症反应减轻,出血基本吸收完全,可见有囊腔形成;21 d时囊腔数量增多,直径扩大;术后28 d损伤处脊髓完全被瘢痕组织替代。见图1。


组别BBB评分正常组21.0±0.00假手术组19.0±0.71术后1d组 0±0.00(1)(2) 7d组 3.4±0.55(1)(2) 14d组 7.2±0.84(1)(2) 21d组 11.2±0.84(1) 28d组 13.6±0.55(1)
(1)与正常组比较,P<0.05;(2)与术后28 d组比较,P<0.05
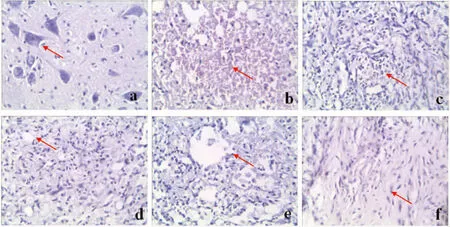
注:a为正常组,b为术后1 d组, c为术后7 d组, d为术后14 d组, e为术后21 d组,f为术后28 d组
2.3 GFAP阳性细胞
正常脊髓切片中星形胶质细胞数量较少,染呈棕黄色,突起细而长,形如蜘蛛;模型组术后第1 d,损伤周围星形胶质细胞开始增多。7 d时,星形胶质细胞胞体肥大,突起增多,染色增强;14 d后星形胶质细胞增生达到高峰,胞体肥大,突起增多增粗明显,染色更深;21~28 d,星形胶质细胞形态未见明显变化,GFAP阳性细胞见图2。SCI后不同时间点GFAP平均阳性细胞数量见表2。
2.4 MBP阳性细胞
正常脊髓切片可见髓鞘纵断面为连续或不连续的条索状,呈规整的网格结构。模型组术后1 d髓鞘破坏,脊髓结构疏松、紊乱,7 d时损伤区域内轴突间隙增宽,14 d时轴突间隙扩大,21~28 d时,髓鞘正常结构丧失,轴突间隙进一步扩大,空泡形成,MBP阳性细胞见图3。SCI后不同时间点MBP平均阳性细胞数量见表2。
3 讨论
星形胶质细胞是CNS中最为丰富的一类胶质细胞,它在调控神经递质、形成细胞外基质等方面有重要作用。GFAP是星形胶质细胞胞浆中长约8~10 nm的中间丝,是公认的星形胶质细胞的特征性标志物。一般情况下,星形胶质细胞的增生是其对神经细胞损害的反应,在急、慢性中枢神经系统损伤中,都能引起星形胶质细胞活化,表现为细胞肿胀、肥大、突起增多和延长,GFAP免疫组化染色表达增强,可能对损伤有保护作用[8]。但脊髓损伤后GFAP过高水平表达,将会促进胶质瘢痕的形成[9],影响神经冲动的传导和突触的构建[10-11]。

注:a为正常组,b为术后1 d组, c为术后7 d组, d为术后14 d组, e为术后21 d组,f为术后28 d组
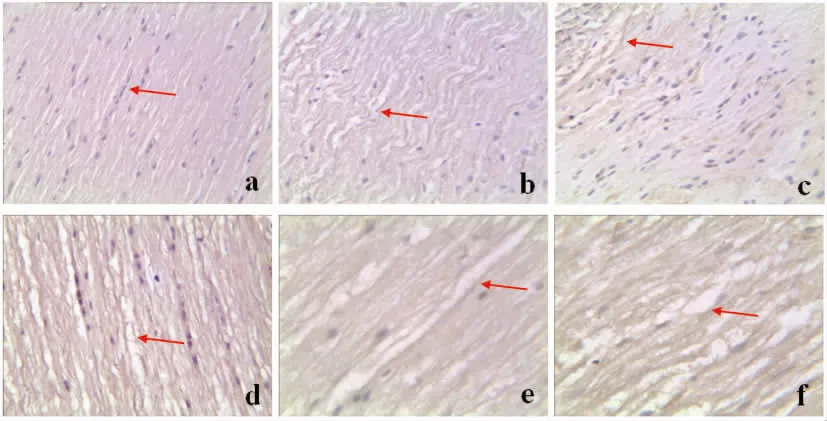
注:a为正常组,b为术后1 d组, c为术后7 d组, d为术后14 d组, e为术后21 d组,f为术后28 d组


组别GFAPMBP正常组14.4±0.5413.8±0.83假手术组14.4±0.5513.8±0.84术后1d组17.0±0.70(2)3.6±0.54(1)(2) 7d组21.6±1.14(1)(2)7.8±0.83(1)(2) 14d组34.4±1.14(1)16.8±0.83 21d组33.6±0.89(1)16.0±0.71 28d组33.2±0.83(1)15.6±0.55
(1)与正常组比较,P<0.05;(2)与术后28 d组比较,P<0.05
髓鞘是脑白质的重要成分,髓鞘的损伤可破坏信号传导,从而对CNS的整体功能造成严重影响。MBP是神经髓鞘特有的膜蛋白,位于髓鞘浆膜面,占髓鞘总蛋白的30%,由成熟少突胶质细胞合成分泌,与酸性脂质结合构成髓鞘的基本成份,形成稳定的膜状板层结构,起着绝缘和快速传导信号的作用,是维持神经元髓鞘结构和功能稳定的重要物质基础。因而,检测MBP可反映中枢神经系统实质性的损害,MBP是反映髓鞘脱失变化较特异敏感的指标[12]。在本实验中,SCI后,大鼠伤侧后肢BBB评分降至0分,随后逐渐好转,14d时恢复最为明显;相应的,早期GFAP表达开始上调,星形胶质细胞的数量增多,胞体增大,突触增多增粗;MBP在SCI后急剧下降,随后开始增加,至14 d时达高峰,提示脊髓损伤后刺激星形胶质细胞及少突胶质细胞反应性增生。这与孙文阁等[13]的研究结果相一致。
本实验通过建立大鼠SCI模型,对SCI后的神经功能恢复与神经胶质细胞反应性增生的变化规律进行了初步探讨,SCI后,大鼠伤侧后肢神经功能逐渐恢复,星形胶质细胞及少突胶质细胞特异性标志物的表达也相应的发生变化,研究表明,增生的神经胶质细胞早期还可分泌相关神经生长促进因子[14-15],建立损伤周围微环境等,为受损神经的轴突的修复再生提供机会;但在损伤晚期,因胶质细胞过度增生,产生胶质瘢痕及相关抑制分子[16],影响轴突和髓鞘的再生,故在损伤晚期神经功能恢复幅度减少。因此, SCI后,大鼠后肢神经功能的恢复可能与星形胶质细胞及少突胶质细胞反应性增生有关。
[1] 李俊丽,赵铎.脊髓损伤机制研究进展[J].中国实用神经疾病杂志, 2009(8):145-148.
[2] Schiffer D, Giordana MT, Meighei A, et al. Glial fibrillary acidic protein and vimentin the experimental glial reaction of the rat brain[J]. Brain Res, 1986 (1) :1102-1118.
[3] Wang D,Bordey A.The astrocyte odyssey[J].Prog Neurobiol, 2008(4):342-367.
[4] He ZG . Glial inhibition of CNS axon regeneration[J].Nat Rev Neurosci, 2006(7):617-627.
[5] 黄思琴,漆伟,孙善全,等. 电针对大鼠脊髓压迫性损伤后髓鞘再生的影响[J].中华物理医学与康复杂志, 2013(3):161-166.
[6] 黄国钧, 黄勤挽. 医药实验动物模型:制作与应用[M].化学工业出版社, 2007:78.
[7] Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J]. Neurotrauma, 1995(1):1-21.
[8] Nawashiro H, Messing A, Azzam N. Mice lacking GFAP are hypersensitive to traumatic cerebro-spinal injury[J].Neuroreport, 1998(8):1691-1696.
[9] Pekny M, Johansson CB, Eliasson C,et al.Abnormal reaction to central nervous system injury in mice lacking glial fibrillary acidic protein and vimentin[J].J cell Biol, 1999(3):503-514.
[10]Ridet J, Malhotra SK, Privat A, et al.Reactive astrocytes:cellular and molecular cues to biological function[J].Trends Neurosxi, 1997(8):570-577.
[11]Liesi P, KauppilaT. Induction of type lV collagen and other basement membrane associated proteins after spinal cord injury of the adult rat participate in formation of the glial scar[J].Exp Neurol, 2002(7),173:31-45.
[12]Yamazaki Y, Yada K, Morii S, et al.Diagnostic significance of serum neuro-specific endase and myelin basic protein assay in patients with acute head injury[J].SurgNeurol, 1995(3):267-269.
[13]孙文阁,李春鹏,张晔,等.脊髓半切损伤后髓鞘碱性蛋白及胶质纤维酸性蛋白的表达及意义[J].苏州大学学报:医学版, 2005(6):947-950.
[14]Cheng H, Wu JP. Neuroprotection of glialcenline-derived neurotrophic factor in damaged spinal cords following eontusive [J].Neurosci Res, 2002(3):397-401.
[15]Kawai H, Arata N. Three-dimensional distribution of astrocytes in zebra fish spinal cord[J].Glia, 2001(3):406-413.
[16]张世民.中枢神经轴突再生与修复[J].中国矫形外科杂志, 2001(7):692-694.
(2015-06-07收稿,2015-07-01修回)
中文编辑: 周 凌; 英文编辑: 刘 华
The Significance of Proliferation of Glial Cells Induced by Experimental Hemi-sectioned Spinal Cord Injury
ZOU Yun, YU Zijiang, LIN Jintang
(GuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
Objective: To explore the change rule of neurogliocyte reactive hyperplasia and its possible mechanism in damage repair after spinal cord injury (SCI). Methods: Seventy healthy adult male SD rats were selected and randomly divided into 3 groups: normal control group, sham group and SCI model groups (1 day after SCI, 7 day after SCI, 14 day after SCI, 21 day after SCI, 28 day after SCI, respectively, 10 rats per group). After the establishment of animal model of SCI, the functional recovery of the hind limb was evaluated by BBB score (The Basso, Beattie and Bresnahan locomotor rating scale) at 1 d,7 d,14 d, 21 d and 28 d. Then the rats were sacrificed to undergo HE staining and immunohistochemical staining. The morphological change of spinal cord, and GFAP and MBP positive cells after SCI were observed through optical microscope. Results: In BBB score evaluation, the rats of SCI model groups paralyzed after anesthetic awareness. The neurologic function of the SCI rats' hind limb began to recover gradually, with the recovery being most obvious at 14d. HE staining showed that 1d after SCI operation, in injured area diffusing hemorrhage, neuronal degeneration and necrosis could be observed. At 7 d after SCI operation, inflammatory cell infiltration could be observed. Capsule cavity formed at 14~21 d after SCI operation. At 28 d after SCI operation, spinal cord injury was replaced by cicatricial tissue. Immunohistochemistry staining showed that the expression of GFAP positive cells in SCI model groups increased compared with normal control group and sham group. The astrocyte in the SCI area proliferated and hypertrophied, with hyperplasia being most obvious at 14 d after SCI operation. The expression of MBP positive cells decreased obviously at 1 d after SCI operation. The myelin sheath in the SCI area was destroyed. At 7 d after SCI operation, the axon clearance began to widen, the expression of MBP positive cells began to increase. At 14 d after SCI operation, the axon clearance continued to widen. Conclusion: After SCI operation, the recovery of neurologic function of rats' hind limb may be related with reactive hyperplasia of astrocyte and oligodendrocyte.
spinal cord injury; microglia; glial fibrillary acidic protein; myelin basic protein; rats, Sprague-Dawley
国家自然科学基金项目(81060108)
时间:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2244.018.html
R322.81
A
1000-2707(2015)09-0905-05
**通信作者 E-mail:893767473@qq.com
