低灼残甜菜碱盐酸盐的合成工艺研究
2015-05-10卢福军王伟文胡波冯维春
卢福军,王伟文,胡波,冯维春
(1.青岛科技大学化工学院,山东 青岛 266042;2.山东省化工研究院,山东 济南 250014)
甜菜碱(betaine)是一种季胺型生物碱,拥有优异的生物活性,自1869年首次分离至今,一直是研究热点之一。但是甜菜碱的流动性严重限制了它的应用,为了克服这个缺点,甜菜碱盐酸盐应运而生[1]。在生物学功能方面,甜菜碱盐酸盐不仅和甜菜碱差别不大,而且它还具备价格低廉、不易吸湿等优点,逐渐成为了季胺型生物碱类化合物的研究和应用的重点。
目前,甜菜碱盐酸盐的制备方法可分为两大类:天然甜菜糖蜜提取法[1-11]和化学合成法[12-23]。前者采用电解法、裂解法、离子交换树脂法、色谱分离法等技术[10-11],通过处理制糖工业副产品甜菜糖蜜来得到甜菜碱盐酸盐,但是该方法收率低于80%,能耗很高,原料来源有限,限制了该技术的应用推广。化学合成法以氯乙酸和三甲胺为基本原料,根据碱的种类可以细分为钙法[12-15]和钠法[16-23]两类不同的工艺。现有文献报道的钙法工艺[12-15]基本上都采用“氯乙酸钙和三甲胺发生季铵化反应”的合成策略。首先,氯乙酸和氢氧化钙反应制备氯乙酸钙;然后,加入三甲胺发生季铵化反应;最后,酸化得到甜菜碱盐酸盐。该工艺虽然收率较为理想,但依然存在有水解副反应发生和产品灼残含量超标25倍这两大缺陷。这两方面问题严重制约了氯乙酸钙制备甜菜碱盐酸盐的产业化研究与发展,导致该合成策略仅停留在实验室小试阶段。
目前,生产企业均采用钠法工艺[16-24],但是该工艺的应用存在多方面的制约因素。一方面,氯乙酸钠的制备过程中不可避免地伴随发生氯乙酸的水解副反应[25],致使该工艺的收率普遍低于85%;其次,钠法工艺的生产周期偏长[10,18],导致设备的利用率和周转率偏低。最重要的是,钠法工艺的产品灼残含量在1.0%左右,其残留的氯化钠严重地影响了产品的品质,导致产品刺激性增加、营养物质易凝结;然而,现有的除盐技术一般采用离子交换法和醇溶法,前者操作繁琐、能耗高,后者需要耗费大量的有机醇溶剂,这些都不利于大规模的工业化生产[17-18]。
针对现有技术存在的不足,以三甲胺和氯乙酸为原料,通过酸碱反应生成氯乙酸三甲铵;然后,缓慢加入氢氧化钙,原位生成三甲胺,并进一步发生季铵化反应。该工艺充分利用甜菜碱盐酸盐和硫酸钙在盐酸体系中溶解度的差异,独创了18%盐酸梯度重结晶技术,有效降低产品灼残含量至0.1%以下。该工艺的产业化不仅可以带来显著的经济效益,而且有助于提高该产品的整体质量水平,有效地满足饲料、医药等行业的需求。
1 实验部分
1.1 试剂与仪器
三甲胺水溶液(33%)、氯乙酸、硫酸均为分析纯;氢氧化钙,化学纯。
Varian INOVA-600型核磁共振波谱仪;LC-10AT高压液相色谱仪。
1.2 实验方法
向氯乙酸(1.00 mol)的水溶液(200 mL水)中滴加30%三甲胺水溶液(1.05 mol),控制反应温度在30℃;滴加完毕,继续搅拌0.5 h;分批加入氢氧化钙(0.50 mol),控制反应温度低于30℃;加料完毕,在60℃下继续搅拌0.5 h,真空减压;加入50%的硫酸(0.49 mol);搅拌1 h后,升温至80℃,直接过滤,得到88.3 g二水合硫酸钙;滤液常压蒸馏脱除380 g水后,直接过滤得到153 g粗品,相应滤液可以直接套用回氯乙酸三甲铵盐的生产工序。粗品经18%盐酸提纯精制,可以得到灼残含量0.08%左右的高纯度白色晶体;熔程:226.5~227.5℃(文献值227~228 ℃分解);1H NMR(600 MHz,D2O)δ 3.12(s,9H),4.05(s,2H)。合成路线为:
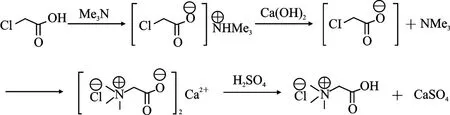
2 结果与讨论
2.1 合成工艺研究
结合甜菜碱盐酸盐的分子结构特点,剖析现有合成工艺的缺陷,发现钠法工艺的突破难度大,氯化钠在水中的溶解度(36 g/100 g,《无机盐工业手册》)约为甜菜碱盐酸盐(64 g/100 g)的1/2,在不借助大量有机溶剂萃取或离子交换等技术的情况下,实现高效脱盐成为了最核心的技术难题。相比较而言,硫酸钙在水中的溶解度小得多,大部分硫酸钙可以直接过滤除掉。故而,首先选择硫酸钙和甜菜碱盐酸盐的分离作为本课题的基本合成策略,进而确定了氯乙酸、三甲胺、氢氧化钙和硫酸作为本工艺的起始原料。
分析传统的钙法工艺,发现水解副反应主要存在于氯乙酸钙的制备过程中,氢氧化钙的强碱性是导致水解反应的首要因素,反应剧烈产生大量热量是次要因素。从水解副反应诱发的起因入手,反其道而行之,在较弱的碱性环境下,氯乙酸极有可能会避免发生水解副反应。由于三甲胺的碱性(pKb值为4.21,《胺类化合物的碱性强弱顺序》)比氢氧化钙(pKb值为 -2.37,《实用化学手册》)弱,可以实现氢氧化钙与三甲胺盐的置换反应,重新释放出三甲胺。
2.1.1 合成氯乙酸三甲胺的影响因素 该步骤以水作为反应媒介,采用氯乙酸和三甲胺反应生成氯乙酸三甲胺。分别考察了反应物料的投料方式、反应温度和反应物料配比等因素对合成的影响。
实验结果表明,当氯乙酸水溶液滴加到三甲胺水溶液的过程中,三甲胺大大过量,不仅会发生酸碱中和反应,而且生成的氯乙酸三甲胺还会继续与过量的三甲胺发生季铵化反应,导致三甲胺的摩尔消耗量至少超过氯乙酸2倍以上才能保证氯乙酸反应完全。合理的加料顺序应该是三甲胺水溶液加入到氯乙酸中,如此才能保证只发生简单的酸碱中和反应。
由于三甲胺碱性较弱,和氯乙酸的反应速度虽然快,但却相对温和。通过调节三甲胺的加料速度,可以控制反应的温度。当反应温度超过30℃,有明显的三甲胺逸出;当反应温度低于30℃,基本上没有三甲胺溢出,并且全程HPLC跟踪分析未检测到水解产物——羟基乙酸。
从理论角度分析,如果氯乙酸的摩尔用量大于三甲胺,酸化后的反应液中至少会存在甜菜碱盐酸盐和氯乙酸,这给产品的分离提纯增加了困难。所以,三甲胺的摩尔用量应该大于氯乙酸。考察三甲胺用量对收率的影响,结果见表1。

表1 三甲胺用量对收率的影响Table 1 The influence of the amount of trimethylamine on the yield
由表1可知,随着三甲胺用量的增加,反应收率逐渐增加,当三甲胺和氯乙酸摩尔比达到1.05∶1时,继续增加三甲胺用量,对产品收率基本无影响,反而徒增成本压力和环保压力。因此,在氯乙酸三甲胺的制备过程中,氯乙酸与三甲胺的摩尔数比为1∶1.05 时最佳。
2.1.2 季铵化反应的影响因素 氢氧化钙和氯乙酸三甲胺反应,释放三甲胺,并进一步发生季铵化反应。主要进行季铵化反应投料方式考察、氢氧化钙的用量考察、季铵化反应的温度考察。
直接将等当量的氢氧化钙一次性加入到上述氯乙酸三甲胺反应液中,反应剧烈,放热明显,反应温度瞬间从25℃升至46℃,并伴随着明显的三甲胺气体逸出,HPLC跟踪分析发现有少量的甜菜碱盐酸盐和羟基乙酸。通过实验证实,氢氧化钙应采取分批加料的方式,通过调整加料速度,控制反应温度。只有当反应温度不超过30℃时,才没有明显三甲胺的逸出。
当采用0.5 mol的氢氧化钙时,反应收率可以达到97.7%。进一步实验证实,即使采用更多的氢氧化钙,产品收率基本没有变化,但是硫酸钙的产量却变大了,相应增大了离心分离工序的操作压力。
通常而言,反应温度越高,则反应速度越快。所以,考察了温度因素对反应的影响,为了防止三甲胺的逸出,采用了憋压操作的方式,并结合HPLC进行跟踪分析,取样分析的时间间隔为15 min。实验结果显示,氢氧化钙加料完毕,30℃下继续反应4 h后氯乙酸才基本消失;40℃下需要继续反应3 h;50℃下需要继续反应1.5 h;60℃下则只需要继续反应0.5 h即可。实验证实,采取更高的反应温度(70,80℃),季铵化反应也基本上需要0.5 h。所以,当氢氧化钙加料完毕后,后续的季铵化反应的合适反应温度确定为60℃,反应时间为0.5 h。
2.2 精制工艺研究
如上述实验所示,直接浓缩酸化滤液,虽然可以高收率地得到甜菜碱盐酸盐粗品,但其灼残含量高达5%左右,远远高于国家质量标准要求。如何有效脱除硫酸钙,一直制约着钙法工艺的发展。
研究发现,在盐酸中硫酸钙的溶解度会变大,而甜菜碱盐酸盐的溶解度会变小,相反的溶解度变化趋势为分离甜菜碱盐酸盐和硫酸钙提供了科学依据见表2。
表2主要测定了不同盐酸浓度、不同温度下甜菜碱盐酸盐的溶解度;并进一步建立了纯化模型,进行了理论计算。例如,100 g灼残含量5%的甜菜碱盐酸盐粗品,其中含有95 g甜菜碱盐酸盐和5 g硫酸钙。在80℃下,需要40 g 18%稀盐酸才能完全溶解95 g甜菜碱盐酸盐,但此时只有0.82 g硫酸钙可以溶解,剩余的4.18 g硫酸钙可直接过滤除去;然后,将体系降温至25℃,只要补加70 g 18%稀盐酸就可以保证0.82 g硫酸钙完全溶解,此时总共有110 g 18%稀盐酸,仅能溶解13.2 g甜菜碱盐酸盐,其余81.8 g甜菜碱盐酸盐则可以直接过滤得到,理论上应该不含有硫酸钙。
采取同样的计算方式,发现35%浓盐酸也可以实现完全去除硫酸钙的理论目标。但考虑到实际操作时,35%浓盐酸的离心过滤操作环境十分恶劣,所以不采用浓盐酸重结晶纯化的方法。

表2 硫酸钙和甜菜碱盐酸盐在盐酸中的溶解度随浓度、温度变化Table 2 Calcium sulphate and betaine hydrochloride solubility change with the concentration of hydrochloric acid and the temperature change
最后,按照理论计算的过程进行实验:向100 g粗品中加入40 g 18%稀盐酸,加热到80℃,过滤不溶物;然后补加70 g 18%稀盐酸;搅拌30 min后,降温至25℃,过滤得到85 g甜菜碱盐酸盐,其灼残含量经测定为0.08%,产品含量99.5%。其滤液常压蒸馏浓缩,得到16.6 g固体和100 g馏分;该馏分经检测分析,确定为18%左右的盐酸水溶液,可以直接用于该精制纯化操作;固体残留物可以采用该纯化工艺反复提纯直至完全合格。
3 结论
(1)以氯乙酸、三甲胺、氢氧化钙和硫酸为基本原料,根据“强碱制备弱碱”的原理,利用三甲胺和氢氧化钙的碱性差别,保证反应体系的弱碱性,创新性地开发了“氯乙酸三甲胺盐-季铵化反应-硫酸酸化”水相合成工艺,解决了传统工艺氯乙酸易水解的关键技术难题,从而有效地提高了甜菜碱盐酸盐的收率。
(2)开发了独特的纯化工艺,首次测定了不同温度、不同浓度的盐酸体系中甜菜碱盐酸盐的溶解度,充分利用甜菜碱盐酸盐和硫酸钙在盐酸体系中溶解度的差异,独创了18%盐酸梯度重结晶技术,有效降低产品灼残含量至0.1%以下,优于国家质量标准要求,突破了现有工艺采用有机溶剂或离子交换树脂等纯化技术、产品灼残含量高于0.2%的技术瓶颈,填补了该领域的技术空白。
[1]晴空一燕.从成本角度考虑甜菜碱在家禽饲料上的应用[J].饲料广角,2013(2):27-29.
[2]柯铭清.中草药有效成分理化与药理特性(修订本)[M].长沙:湖南科学技术出版社,1979:198-243.
[3]廖顺平,谢海艳.甜菜碱研究新进展[J].中华疾病控制杂志,2010,14(9):903-905.
[4]Dasgup ta B.Chemical investigation of pluchea lanceolata I.Isolation of a new quaternauy base,pluchine[J].Experentia,1967,23(12):989-991.
[5]Kishida T,Arisuka T,Sayama K.Compositions containing betaine forinhibition ofblood sugarincrease:JP,08133970[P].1996-05-28.
[6]刘燕燕,曾新安,朱思明,等.甜菜碱的生理功能与药物活性[J].现代食品科技,2008,24(1):96-100.
[7]杨昆,王稼,谭亿,等.甜菜碱制备工艺的研究[J].化学研究与应用,2008,20(11):1532-1534.
[8]高允生,陈伟,陈美华,等.盐酸甜菜碱对缺氧小鼠的保护作用[J].中国药理学通报,2005,22(12):1525-1527.
[9]李昆太,李永亮,储炬,等.甜菜碱促进脱氮假单胞菌合成维生素 B12[J].中国医药工业杂志,2008,39(3):172-175.
[10]赵永祥,贾志奇,吉向飞,等.一种甜菜碱、甜菜碱盐酸盐的合成方法:CN,101323581[P].2008-12-17.
[11]房有树,吕景山,翟跃,等.提取盐酸甜菜碱工艺:CN,111796[P].1996-03-06.
[12]郝立勇,汪海,杜江山,等.盐酸甜菜碱制备工艺的改进[J].中国医药工业杂志,2002,33(9):428.
[13]许梓荣,夏枚生,胡彩虹.甜菜碱盐酸盐的合成方法:CN,1166625C[P].2004-09-15.
[14]陈林世.甜菜碱盐酸盐的环保制备方法:CN,101863785A[P].2010-10-20.
[15]陈林世.一种甜菜碱盐酸盐的制备方法:CN,102807499A[P].2012-08-27.
[16]夏士朋.甜菜碱盐酸盐合成工艺的改进[J].化学试剂,2004,26(6):378.
[17]曹俊山,郝秀利,王淑华,等.一种甜菜碱盐酸盐的制备方法:CN,102827011A[P].2012-12-19.
[18]吴强三,付光武,潘春刚.一种盐酸甜菜碱的制备方法:CN,102617374A[P].2012-08-01.
[19]高相民.甜菜碱盐酸盐的制备方法:CN,101255118[P].2008-09-03.
[20]赵学知.甜菜碱盐酸盐的制备方法:CN,101786960A[P].2010-07-28.
[21]谢新记,张苗,王明刚,等.一种合成三甲胺乙内酯(甜菜碱)盐酸盐的方法:CN,1065236C[P].2001-05-02.
[22]房照智,段俊秀.一种甜菜碱、甜菜碱盐酸盐的制备提取方法:CN,101863784B[P].2013-02-06.
[23]楼伟杰,谢创新.一种制备甜菜碱盐酸盐的方法:CN,102267918A[P].2011-12-07.
[24]江体乾.化工工艺手册[M].上海:上海科学技术出版社,1992:98.
[25]邰燕芳,吴景梅,董雄辎.氯乙酸水解合成羟基乙酸的合成条件改进[J].云南民族大学学报:自然科学版,2012,21(6):412-414.
[26]尹忠,赵晓东.硫酸钙在盐酸和氯化钠水溶液中的溶解度[J].油田化学,1994,11(4):345-347.
