短节段固定融合治疗退变性腰椎侧凸合并腰椎管狭窄症的临床分析
2015-05-10强喆宋跃明刘立岷杨曦胡星新陵廷贤
强喆 宋跃明 刘立岷 杨曦 胡星新 陵廷贤
退变性脊柱侧凸 ( degenerative scoliosis,DS )是指脊柱发育成熟后发生的冠状面 Cobb’s 角>10°的病变,其中退变性腰椎侧凸 ( degenerative lumbar scoliosis,DLS ) 主要是由于腰椎间盘和双侧的小关节不对称性退变引起[1]。随着病情的发展,出现黄韧带肥厚及部分椎体的旋转、滑脱和侧方移位等病理改变,从而压迫脊髓和神经根,引起腰腿痛及神经压迫症状[2]。DLS 多发于老年人,常伴有骨质疏松及其它慢性疾病,这明显增加了临床治疗的难度,而随着社会老龄化程度的加剧,此类患者正逐渐增多[3]。目前普遍认为手术治疗是非常有效的治疗方法,它在延缓或阻止畸形发展、重建脊柱平衡、减轻患者症状中起非常重要的作用,但是对于手术方式的选择、融合固定节段长短的选择等问题仍存在许多争议[4]。本研究回顾性分析 2010 年5月至 2013 年8月,我院行选择性减压、短节段固定融合术治疗的 26 例 DLS 合并腰椎管狭窄症患者,探讨其手术治疗策略及疗效。
资料与方法
一、一般资料
本组共 26 例,男 11 例,女 15 例;年龄 52~78 ( 平均 64.1 ) 岁,其中 60 岁以上 18 例,70 岁以上6例。病程 1~40 ( 平均 8.8 ) 年。术后随访 12~39 ( 平均 20 ) 个月。术前所有患者均有不同程度的腰痛或下肢疼痛,站立、行走及坐位时明显,长期使用止痛药及其它保守方式治疗。19 例 ( 73.1% ) 有间歇性跛行,22 例 ( 84.6% ) 有神经根刺激或感觉减退等神经受损症状,19 例 ( 73.1% ) 膝腱或跟腱反射改变,4 例 ( 15.4% ) 会阴部麻木;20 例 ( 76.9% ) 伴有腰椎滑脱或不稳。
术前全脊柱 X 线片示腰椎 Cobb’s 角 11°~26°( 平均 16.4° ),腰椎前凸角 12°~46° ( 平均 27.3° ),C7PL-CSVL 距离5~23 ( 平均 11.2 ) mm,C7PL 与 S1椎体后上缘距离3~25 ( 平均 11.7 ) mm,顶椎侧方移位 0~4 ( 平均 1.5 ) mm,腰椎 CT、MRI 用于评估椎管、侧隐窝及椎间盘退变的情况,CT 示顶椎旋转0°~1°,MRI 示均有不同程度的椎管狭窄。以Oswestry 功能障碍指数 ( ODI,45 分法 ) 评估患者疼痛和功能情况,术前 23~36 ( 平均 28.5 ) 分,其中“性生活”一项未统计。术后 ODI 评分改善率>75% 为优,~75% 为良,~49% 为可,<25% 为差。改善率=[ ( 术前 ODI 指数-术后 ODI 指数 ) / 术前 ODI 指数 ]×100%。
二、术前合并症
除常规检查外,视患者情况行相关检查,发现如下合并症:高血压8例,I 级5例,II 级2例,III 级1例;心律不齐2例;慢性支气管炎伴肺气肿2 例;糖尿病3例;多发腔隙性脑梗塞1例;骨质疏松7 例。高血压患者口服降压药物并监测血压,使血压处于 150 / 100 mm Hg (1mm Hg=0.133 kPa )以下;肺功能差的患者通过呼吸训练、应用相关药物等方法,使肺功能和血气分析结果达到适合手术的程度;糖尿病患者围手术期均皮下注射胰岛素,空腹血糖控制在7.0 mmol / L,餐后2h 血糖低于10.0 mmol / L。
三、统计学分析
应用 SPSS 20.0 统计软件进行分析,计量资料以±s表示,手术前后 Cobb’s 角、腰椎前凸角、冠状面躯干偏移、矢状面躯干偏移、ODI 评分的比较均采用配对t检验,P<0.05 为差异有统计学意义。
结 果
一、手术相关情况
手术时间 140~360 ( 平均 230.4 ) min,术中出血量 200~2000 ( 平均 673 ) ml,术后3例输血 300~600 ( 平均 433 ) ml。手术减压 1~3 ( 平均 1.5 ) 个节段,固定节段2~4 ( 平均3.3 ) 个。
二、疗效评价
术前 Cobb’s 角平均 ( 16.4±3.8 ) °,术后随访Cobb’s 角平均 (6.9±2.2 ) °,矫正率为 58%;腰椎前凸角由术前平均 ( 27.3±7.9 ) ° 矫正至末次随访平均 ( 33.5±5.9 ) °;冠状面失平衡术前平均 ( 11.2±4.5 ) mm,术后平均 (5.2±2.3 ) mm;矢状面失平衡术前平均 ( 11.7±6.0 ) mm,术后平均 (6.0±2.3 ) mm;末次随访与术前相比 ODI 明显下降,改善率为 83.1%,其中优 19 例,良6例,可1例。术后所有指标与术前相比,差异有统计学意义 (P<0.05 )( 图 1,表1)。
三、相关并发症
术后7 例 ( 26.9% ) 出现并发症:肺部感染3 例,尿路感染2例,输血后寒战高热1例,1 例同时合并有肺部感染和尿路感染。其中术前合并慢性支气管炎、肺气肿的患者都出现了肺部感染,所有并发症均给予对症支持处理后好转。1 例术后左下肢疼痛较术前明显,考虑为术中神经激惹或血肿刺激,给予激素、营养神经药等对症支持治疗,术后10 天患者无明显左下肢疼痛。所有病例无其它严重并发症或死亡,融合节段均获得骨性融合,末次随访时未发现内固定松动、断裂。was 15° and lumbar lordosis angle was 16°; c-d: The MRI revealed L4-5and L5-S1lumbar disc herniation and spinal canal stenosis; e-h: L4-5and L5-S1decompression and L4-S1fusion were performed, and Cobb’s angle was 8° and lumbar lordosis angle was 27° at1year after the operation. No severe degeneration or curve progression was observed in the adjacent segments
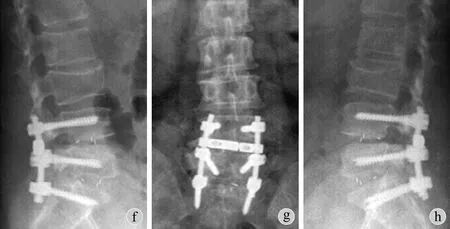
图1 患者,女,70 岁,因腰痛5年,加重伴右下肢疼痛、间歇性跛行1年入院 a~b:术前X 线片示 Cobb’s 角 15°,腰椎前凸角 16°;c~d:MRI 示 L4~5、L5~S1 椎间盘退变突出,椎管狭窄;e~h:予以 L4~5、L5~S1 减压,L4~S1 固定融合术,术后1年 X 线片示 Cobb’s 角 8°,腰椎前凸角 27°,相邻节段未见明显退变,侧凸未见明显进展Fig.1 A 70-year-old female was adopted because of backache for5years accompanied by right leg pain and intermittent claudication for1year a-b:The preoperative X-ray showed Cobb’s angle
表1影像学结果及 ODI 评分术前与末次随访比较 (±s)Tab.1 Comparison of radiographic parameters and ODI preoperatively and in the latest follow-up (±s)
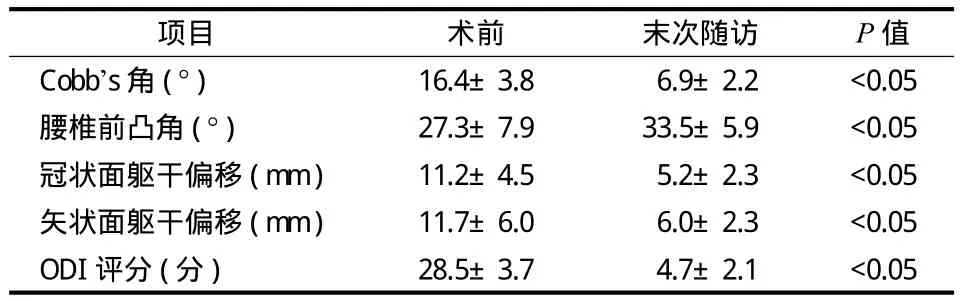
表1影像学结果及 ODI 评分术前与末次随访比较 (±s)Tab.1 Comparison of radiographic parameters and ODI preoperatively and in the latest follow-up (±s)
项目 术前 末次随访 P 值Cobb’s 角 ( ° ) 16.4±3.86.9±2.2 <0.05腰椎前凸角 ( ° ) 27.3±7.9 33.5±5.9 <0.05冠状面躯干偏移 ( mm ) 11.2±4.55.2±2.3 <0.05矢状面躯干偏移 ( mm ) 11.7±6.06.0±2.3 <0.05 ODI 评分 ( 分 ) 28.5±3.74.7±2.1 <0.05
讨 论
一、DLS 的特点
DLS 多见于老年患者,它不同于青少年特发性脊柱侧凸和发育性脊柱畸形[5]。其发病率文献报道不同,随年龄的增长而增加[6-7]。Shufflebarger 等[8]报道 50~60 岁成人 DLS 发生率为4.4%,60~70 岁发生率为 8.6%。目前认为,DLS 的发病原因与不对称的椎间盘退变、关节突关节退变、椎体压缩骨折、相邻节段不稳、骨质疏松等相关。患者常因腰背痛、间歇性跛行、神经功能障碍就诊。
二、治疗原则和融合固定范围
老年 DLS 患者各器官功能和机体代谢功能下降且合并慢性病多,病情往往较复杂,有些合并症严重,需要全面衡量患者对手术的耐受力。年龄、营养状态、心肺功能、血糖和血压水平等都会影响手术耐受力及预后[9]。本组 26 例中,术前有合并症者占 88.5%,成为影响手术效果的重要因素。Katz等[10]研究发现患有腰椎管狭窄症合并糖尿病、肺心病等基础疾病的老年人,手术效果往往不佳。因此术前需要从多方面进行风险评估,降低术后并发症的发生率。
因为 DS 涉及到脊柱稳定性、椎管狭窄及躯干平衡等多方面因素,所以其手术方式也呈现多样化。目前手术治疗的方式分为单纯减压、减压的同时行有限长、短节段内固定,如何选择手术方式尚无定论[11]。单纯减压目前很少应用,Liu 等[12]报道它适用于不伴有腰背痛、间歇性跛行、马尾综合征和腰椎不稳的神经根性痛患者。Cho 等[4]认为长节段固定融合适用于 Cobb’s 角较大同时伴有冠状面失平衡的患者。相比短节段固定融合,长节段固定融合需要更长的手术时间、出血量更多、住院天数显著延长并且会导致更多的并发症,如相邻节段椎间盘的退变、假关节、钉棒断裂等,并发症发生率为41%~62%[13-15]。Simmons[16]提出对于有轻度椎体旋转的患者,通过对狭窄节段减压、凹侧撑开等手段,同时行短节段融合可达到较好的效果。
通过对本组患者临床资料的分析,笔者认为短节段固定融合术适应证为:(1) 反复的腰腿痛,经保守治疗症状缓解不明显;(2) 疼痛定位明确,且相应节段有椎管狭窄或神经根压迫;(3) 脊柱不稳;(4) 冠、矢状面失平衡较小且无侧凸进展因素( 顶椎旋转≤I 度,腰椎侧凸≤30°,椎体侧方滑移≤5 mm )[17];(5) 术前评估无明显手术禁忌证。短节段固定融合明显减少了手术时间和出血量,术后患者可早日行功能锻炼,减少了并发症的发生。而在融合节段的选择方面,应跨过滑脱、不稳或后凸的节段,否则会加速相邻节段的退变,进而增加了二次手术的风险。在远端椎的选择方面,一般情况下固定融合至 L5可以缩短手术时间使手术风险下降;同时保留患者腰骶部的活动,减轻 S1和骶髂关节的应力,明显提高患者的生存质量;减少假关节的发生率,降低二次手术的风险。当患者合并有以下情况时,须固定融合至 S1:L5~S1节段滑脱、L5~S1椎管或椎间孔狭窄、L5~S1椎板切除史、L5~S1椎间盘明显退变、L5相对于 S1倾斜角>15°。
三、临床疗效
短节段固定融合在治疗 DLS 患者的术后临床症状、Cobb’s 角、腰椎前凸角、冠状面及矢状面躯干偏移均有较大的改善,未出现严重并发症。有学者提出对于手术效果而言,矢状面平衡的恢复起到的作用要大于冠状面平衡,尤其是腰椎前凸角的恢复[18-19]。所以,术中通过椎间融合器的位置和钛棒使腰椎前凸角得到良好的恢复。本组腰椎侧、前凸较术前均有明显矫正,术后相关并发症发生率低。本组 ODI 改善率 83.1%,与 Cobb’s 角 (r=0.157 )、前凸角 (r=0.159 )、冠状面平衡 (r=0.180 )、矢状面平衡 (r=0.092 ) 作多变量相关分析,发现与 ODI的改善无明显关联,提示本组病例中躯干平衡的纠正与疼痛的改善无明显关联,分析原因有两点:一是解除了狭窄节段的压迫从而减轻了疼痛;二是本组病例人数较少,可能造成统计学的差异。
本组术后3例发生肺部感染,2 例发生尿路感染,1 例同时合并有肺部感染和尿路感染,笔者认为术前须详细评估患者病情,尤其对合并慢性肺部疾病的患者,加强肺功能及咳痰训练,术后尽早拔除尿管下床锻炼,可以减少术后发生肺部感染和尿路感染的可能。对于合并骨质疏松的患者,术中适当进行加压矫形,避免用力过大,造成损伤;术后应早期积极给予补钙治疗,以防引起远期并发症。本组中只有3例术后输血,其中1例因术后输血出现寒战高热,体温最高达 40.6 ℃,笔者建议术中应用自体血回输,降低术中及术后输血量,减少因输血引起的相关并发症,从而提升手术的疗效。
总之,对于 Cobb’s 角<30° 且冠、矢状面失平衡较小的患者,通过体征和影像学检查准确定位引起症状的节段,进行相应节段的减压、短节段固定融合术可获得良好的疗效。本研究随访时间有限,术后患者长期疗效、侧凸的进展及相邻椎间盘退变等情况还需要进一步观察。
[1] Russo A, Bransford R, Wagner T, et al. Adult degenerative scoliosis insights, challenges, and treatment outlook. Curr Orthop Prac, 2008, 19(4):357-365.
[2] Tempel ZJ, Gandhoke GS, Bonfield CM, et al. Radiographic and clinical outcomes following combined lateral lumbar interbody fusion and posterior segmental stabilization in patients with adult degenerative scoliosis. Neurosurg Focus,2014, 36(5):E11.
[3] Di Silvestre M, Lolli F, Bakaloudis G. Degenerative lumbar scoliosis in elderly patients: dynamic stabilization without fusion versus posterior instrumented fusion. Spine J, 2014,14(1):1-10.
[4] Cho KJ, Suk SI, Park SR, et al. Short fusion versus long fusion for degenerative lumbar scoliosis. Eur Spine J, 2008,17(5):650-656.
[5] Aebi M. The adult scoliosis. Eur Spine J, 2005, 14(10):925-948.
[6] Caputo AM, Michael KW, Chapman TM Jr, et al. Clinical outcomes of extreme lateral interbody fusion in the treatment of adult degenerative scoliosis. Scientifi cWorldJournal, 2012,2012:680643.
[7] Seo JY, Ha KY, Hwang TH, et al. Risk of progression of degenerative lumbar scoliosis. J Neurosurg Spine, 2011,15(5):558-566.
[8] Shufflebarger H, Suk SI, Mardjetko S. Debate: determining the upper instrumented vertebra in the management of adult degenerative scoliosis: stopping at T10 versus L1. Spine, 2006,31(Suppl 19):S185-194.
[9] Brodke DS, Annis P, Lawrence BD, et al. Reoperation and revision rates of3surgical treatment methods for lumbar stenosis associated with degenerative scoliosis and spondylolisthesis. Spine, 2013, 38(26):2287-2294.
[10] Katz JN, Lipson SJ, Chang LC, et al. Seven-to 10-year outcome of decompressive surgery for degenerative lumbar spinal stenosis. Spine, 1996, 21(1):92-98.
[11] Cho KJ, Kim YT, Shin SH, et al. Surgical treatment of adult degenerative scoliosis. Asian Spine J, 2014, 8(3):371-381.
[12] Liu W, Chen XS, Jia LS, et al. The clinical features and surgical treatment of degenerative lumbar scoliosis: a review of 112 patients. Orthop Surg, 2009, 1(3):176-183.
[13] Benz RJ, Ibrahim ZG, Afshar P, et al. Predicting complications in elderly patients undergoing lumbar decompression. Clin Orthop Relat Res, 2001, (384):116-121.
[14] Cho KJ, Suk SI, Park SR, et al. Arthrodesis to L5 versus S1 in long instrumentation and fusion for degenerative lumbar scoliosis. Eur Spine J, 2009, 18(4):531-537.
[15] Cho KJ, Suk SI, Park SR, et al. Risk factors of sagittal decompensation after long posterior instrumentation and fusion for degenerative lumbar scoliosis. Spine, 2010, 35(17):1595-1601.
[16] Simmons ED. Surgical treatment of patients with lumbar spinal stenosis with associated scoliosis. Clin Orthop Relat Res, 2001,(384):45-53.
[17] Chin KR, Furey C, Bohlman HH. Risk of progression in de novo low-magnitude degenerative lumbar curves: natural history and literature review. Am J Orthop, 2009, 38(8):404-409.
[18] Oskouian RJ Jr, Shaffrey CI. Degenerative lumbar scoliosis.Neurosurg Clin N Am, 2006, 17(3):299-315.
[19] Glassman SD, Bridwell K, Dimar JR, et al. The impact of positive sagittal balance in adult spinal deformity. Spine, 2005,30(18):2024-2029.
