酶解扁杏仁粕制备抗氧化肽工艺
2015-05-08赵换霞张海生杨淑芳
赵换霞,张海生,杨淑芳
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
酶解扁杏仁粕制备抗氧化肽工艺
赵换霞,张海生*,杨淑芳
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
为优化酶解扁杏仁粕制备抗氧化肽的工艺条件,采用响应面分析法,研究了加酶、底物浓度、温度和pH对酶解扁杏仁粕的影响。以还原力为响应值,优化参数加酶量6725U/g,底物浓度3%、温度60℃和pH8.28。酶解液的还原力为0.743,与模型预测具有较好的拟合性。此工艺制备的扁杏仁抗氧化肽具有较强的体外抗氧化性,且其含有较高的抗氧化氨基酸。
杏仁粕,抗氧化肽,氨基酸
大扁杏仁是一种甜杏仁,富含蛋白质、脂肪、维生素、矿物质和膳食纤维,营养价值极高,其中蛋白质含量约26%左右[1-2],是一种具有很高经济利用价值的植物蛋白[3]。营养学研究发现,蛋白质经消化道酶作用后并不是完全以游离氨基酸的形式被吸收,而是主要以肽的形式被吸收[4]。生物活性肽是涉及生物体内各种细胞功能的生物活性物质,是具有氨基酸序列的多肽,并在肠道消化过程中充当新陈代谢潜在生理效应物[5]。近年来大量研究表明,蛋白质经合适的蛋白酶水解制成的多肽产品具有一定的抗氧化活性[6],国内外学者已从多种食物蛋白酶解液中分离出具有抗氧化活性的肽片段,包括大豆抗氧化肽[7-8]、花生抗氧化肽[9]、玉米抗氧化肽[10-11]。黄昆[12]以风味蛋白酶酶解脱脂山杏仁,制备了对DPPH·清除能力较强的杏仁抗氧化肽。而人类许多慢性疾病及衰老现象均和人体内的自由基水平失衡有关,过量的自由基对机体产生氧化性损伤,当这种损伤不能及时修复并且积累到一定程度会导致心脑血管疾病、糖尿病、高血压等疾病的发生[13-15],因此,对于抗氧化肽的开发具有重要意义。目前,对于大扁杏仁的研究主要集中在对杏仁油的研究,而榨油后蛋白质含量高达40%以上的杏仁粕,被用作动物饲料或者制作饮料,其利用价值低。
本实验就碱性蛋白酶和风味蛋白酶复合酶解扁杏仁粕制备抗氧化活性肽的最佳酶解条件进行了研究,并对所制得的扁杏仁抗氧化肽进行了全面的体外抗氧化评价,同时对扁杏仁抗氧化肽中的氨基酸进行了评价,从而为开发具有高附加值的扁杏仁抗氧化活性肽提供理论基础和实验依据,也有利于扁杏仁粕的资源深度开发利用。
1 材料与方法
1.1材料与仪器
扁杏仁陕西省榆林市榆阳区旺达扁杏仁加工厂提供;碱性蛋白酶BRITISH DRUG HOUSE公司(BDH);风味蛋白酶、BDH、DPPH Sigma公司;铁氰化钾天津盛奥、TCA天津天力、磷酸氢二钠天津天力、磷酸二氢钠天津天力、氯化铁天津盛奥、硫酸亚铁天津盛奥、水杨酸天津恒兴、无水乙醇天津富宇、双氧水天津富宇,抗坏血酸等都为分析纯,实验用水为去离子蒸馏水。
HH-S4A型电热恒温震荡水浴锅北京科伟永兴仪器有限公司;AL204型电子天平梅特勒-托利多仪器有限公司;LGJ-10C型冷冻干燥机北京四环科学仪器厂有限公司;PHSJ-3F型实验室pH计上海仪电科学仪器股份有限公司;低速台式大容量离心机上海安亭科学仪器厂;L3可见分光光度计:上海仪电分析仪器有限公司;氨基酸自动分析仪:日本HITACHI公司。
1.2实验方法
1.2.1扁杏仁短肽的制备将扁杏仁粉碎,在室温下用石油醚(沸程30~60℃)脱脂3次,置通风橱中24h以挥发有机溶剂,得脱脂扁杏仁粉,过60目筛。取脱脂扁杏仁粉若干,按比例加入蒸馏水,放入恒温震荡水浴锅中,待温度恒定后,调至适当的pH,按一定的酶底物比加入碱性蛋白酶和风味蛋白酶开始水解,水解一定时间后,终止反应,沸水浴灭酶15min。冷却后以4000r/min离心20min,取上清液过滤即得酶解液。
1.2.2扁杏仁抗氧化肽制备的响应面优化实验以固定酶解时间为2.5h,碱性蛋白酶和风味蛋白酶的酶活比为3∶2;基于单因素实验结果,以酶用量、底物浓度、温度和pH为自变量,以还原力为响应值,根据BOX-Benhnken设计原理,设计4因素3水平的响应面分析实验,实验因素水平及编码见表1。

表1 响应面实验因素水平

式中:A0为空白对照溶液的吸光度;A1为加入样品液后的吸光度;A2为不加水杨酸溶液酶解液的吸光值。
1.2.4还原力的测定将2mL的扁杏仁粕酶解液与2mL 0.2mol/L磷酸缓冲液(pH6.6)和2mL 1%铁氰化钾溶液混合均匀后在50℃反应20min,然后加入2mL 10%的TCA溶液,3000r/min离心10min。吸取2mL上清液于试管中,并加入2mL蒸馏水和0.4mL 0.1% FeCl3溶液,反应10min后在700nm处测定其吸光度[17]。吸光度值越大则样品的还原能力越强。
1.2.5DPPH自由基清除率的测定取2mL不同浓度的样品溶液于10mL试管中,加入2mL 0.1mmol/L DPPH无水乙醇溶液,混合均匀,于室温下避光反应30min后,在517nm测定其吸光度[18]。每个样品3组重复。
式中:Ai为DPPH溶液+样品溶液的吸光度;Ai0为无水乙醇+样品溶液的吸光度;A0为DPPH溶液+去离子水的吸光度。
1.2.6酶解产物氨基酸组成的分析称取0.05g冷冻干燥后的杏仁粕酶解物,用6mol/L盐酸于110℃水解24h,脱酸后,用水定容至5mL,氨基酸自动分析仪测定[19]。
1.3数据分析及处理
响应面实验设计与分析采用Design-expert(7.0)软件,实验数据采用Excel和SPSS数学分析软件进行分析及处理。
2 结果与讨论
2.1响应面设计结果分析
2.1.1模型的建立与显著性分析表2为响应面分析设计及实验结果。对表2结果进行二次多项式回归拟合,获得响应值(Y)与酶用量(X1)、底物浓度(X2)、温度(X3)和pH(X4)的二次回归方程,如下:
Y=+0.75+0.012X1+0.026X2+6.667×10-3X3+0.046X4+0.012X1X2-0.027X1X3-0.074X1X4+0.015X2X3-0.047X2X4-0.011X3X4-0.053X12-0.076X22-0.041X32-0.061X42
2.1.2响应面分析图1为根据多元回归模型做出的响应面图。由图1结合表3中各因素的p值可以看出,模型的一次项X4,交互项X1X4,二次项X12、X22、X32和X42对还原力的影响达到极显著水平(p<0.0001),一次项X2,交互项X2X4对还原力的影响达到了高度显著性水平(p<0.01);一次项X1,交互项X1X3对还原力的影响达到显著水平(p<0.05)。表明实验因素对响应值不是简单的线性关系,二次项和交互项对响应值也有很大的影响。比较响应面模型二次多项式方程中一次项的方差的大小,可以判断影响因素的主次顺序。各因素对还原力影响程度大小为X4>X2>X1>X3,即pH>底物浓度>加酶量>温度。

表2 响应面分析设计及实验结果

表3 还原力的方差分析表
2.1.3最优工艺条件的确定及验证对实验模型进行典型性分析,通过响应面软件分析,获得碱性蛋白酶和风味蛋白酶复合酶解扁杏仁粕制备杏仁抗氧化肽的最优条件为:酶用量6725.65U/g、底物浓度2.98%、温度60.54℃、pH8.28,还原能力理论值为0.759;为检验响应面方法的可行性,并综合考虑实际操作的便利性,将工艺参数修正为:酶用量6725U/g、底物浓度3%、温度60℃、pH8.28,经3次平行实验验证,得到还原力的平均值为0.743,与理论值相差2.22%。说明该模型与实际情况拟合较好,验证了所预测模型的正确性。因此,响应面法对碱性蛋白酶和风味蛋白酶复合酶解制备扁杏仁抗氧化肽工艺的条件的参数优化是可行的,得到的工艺条件具有实际应用价值。
2.2扁杏仁抗氧化肽体外活性测定
利用响应面软件分析得到最优酶解条件,制备扁杏仁抗氧化肽酶解液,将其冷冻干燥后,测定其对羟基自由基的清除率、DPPH·的清除率以及还原能力,并与同浓度的VC的抗氧化能力进行比较,结果如图2~图4所示。
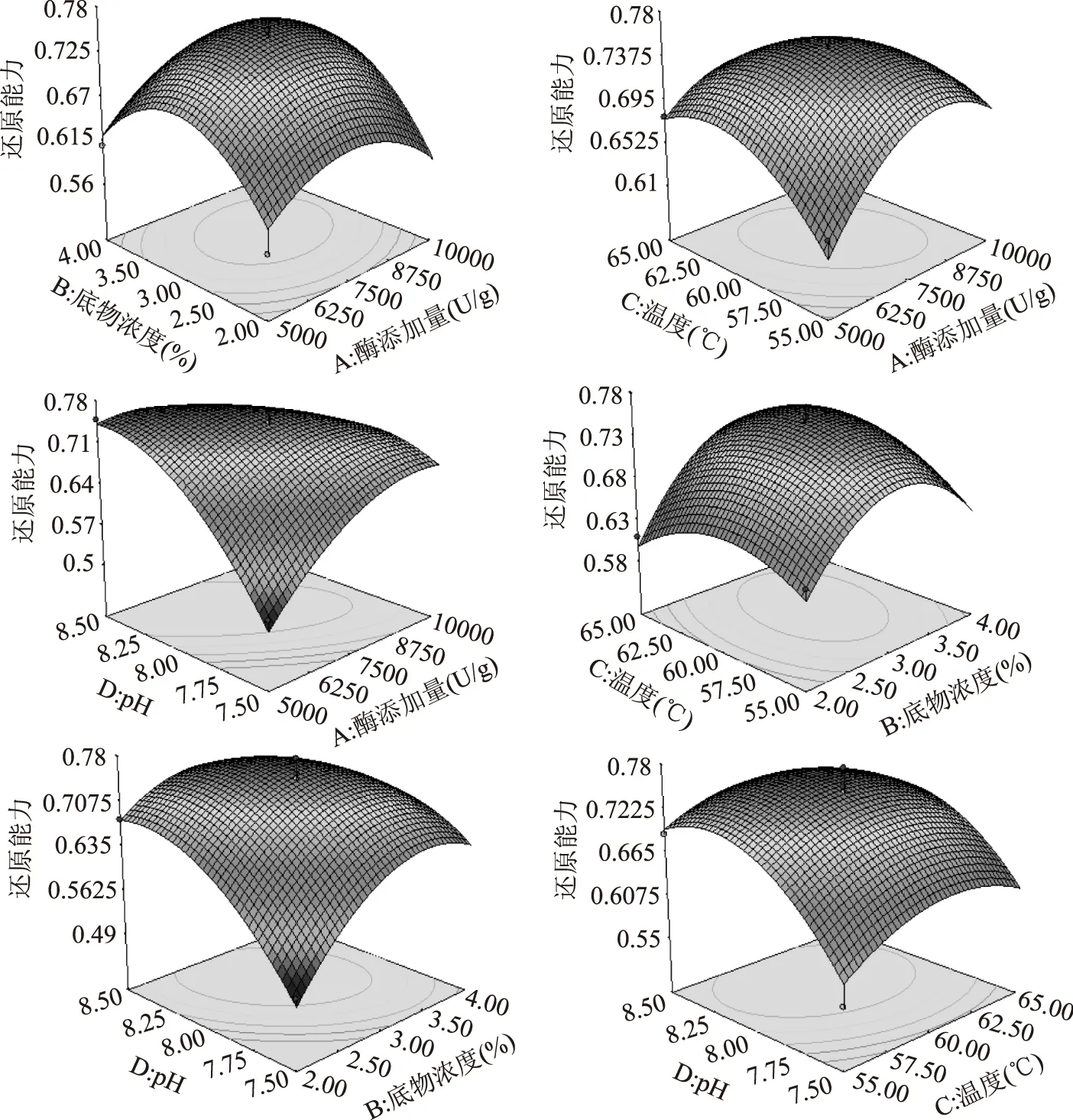
图1 还原力的响应面Fig.1 Response surface plots for reducing power

图2 不同质量浓度扁杏仁抗氧化肽对羟基自由基的清除能力Fig.2 The hydroxyl radical scavenging potential of apricot kernel anti-oxidation activity polypeptides at various concentrations

图3 不同质量浓度扁杏仁抗氧化肽的还原力Fig.3 The reducing power of apricot kernel anti-oxidation activity polypeptides at various concentrations

图4 不同质量浓度扁杏仁抗氧化肽对DPPH自由基的清除能力Fig.4 The DPPH free radical scavenging potential of apricot kernel anti-oxidation activity polypeptides at various concentrations
羟自由基是毒性最强的一种自由基,它会和机体细胞的糖、蛋白质、脂质和核苷酸等生物大分子发生氧化反应,从而对细胞和机体造成损伤[21-22]。由图2可以看出,随着扁杏仁抗氧化肽浓度的增加,羟基自由基的清除能力也随之增加,当浓度达到12mg/mL时,羟基自由基的清除率达到82.27%,接近于同浓度VC的能力,是同浓度VC能力的90.64%;抗氧化剂的总还原力与其抗氧化性之间存在联系,总还原力越强,抗氧化能力就越强[23],由图3可以看出,扁杏仁抗氧化肽的还原能力随着酶解产物浓度的增加而升高,酶解产物的浓度在12mg/mL的浓度下,其还原能力的吸光度值为1.36,是同浓度VC能力的95.67%。由图4可以看出,DPPH·的清除率同样随酶解产物浓度的升高而升高,在较低浓度下也具有良好的清除能力,当扁杏仁抗氧化肽的浓度为6mg/mL时,其清除率为57.58%。
2.3酶解产物氨基酸组成分析
由表4可知,杏仁抗氧化肽含有15种氨基酸,LiB等人在文献[24]中报道:蛋氨酸、酪氨酸、苯丙氨酸和组氨酸是四种有自由基清除效果的关键氨基酸。也有研究指出[25],半胱氨酸、组氨酸、色氨酸、赖氨酸、精氨酸、亮氨酸、缬氨酸,苯丙氨酸以及它们的衍生物具有抗氧化性。由表4可知,在扁杏仁抗氧化肽中,所有这些具有抗氧化活性的氨基酸占氨基酸总量的50.77%。此外,总疏水基氨基酸的含量高达39.45%,而具有抗氧化活性物质多与碱性氨基酸和疏水性氨基酸有关[26];同时,肽的抗氧化活性强弱与其氨基酸组成及序列等化学结构和分子量大小密切相关[27]。扁杏仁肽中具有抗氧化活性的氨基酸含量较高,这可能是扁杏仁肽具有抗氧化作用的原因之一。因此,氨基酸的组成表明利用此生产工艺制备扁杏仁肽具有良好的抗氧化能力。

表4 扁杏仁抗氧化肽中氨基酸的含量
注:*为疏水性氨基酸;n.d 表示没有测定。
3 结论
在单因素实验的基础上,采用响应面分析法优化得出扁杏仁抗氧化肽的最佳酶解工艺为:酶用量6725U/g、底物浓度3%、温度60℃、pH8.28,在该条件下制备的扁杏仁抗氧化活性的还原力为0.743。对扁杏仁抗氧化肽的羟基自由基的清除率、DPPH·的清除能力和还原力进行了全面的研究,并对其氨基酸组分进行了分析,结果显示,扁杏仁抗氧化肽具有较强的清除自由基的能力和还原能力,其抗氧化氨基酸含量较高,可能是一种具有潜在应用价值的抗氧化剂。
[1]中国医学科学院卫生研究所编著.食物成分表[M].北京:人民卫生出版社,1980.
[2]李新华,闫荣.辽西大扁杏杏仁蛋白的组成及碱法提取工艺的研究[J].食品科技,2009,34(5):132-135.
[3]宋曰钦,王建中,赵云霞,等.苦杏仁蛋白开发利用的前景[J].食品科学,2006,22(1):68-70.
[4]孙伟峰,周素梅,王强.酵母蛋白肽酶解制备工艺研究[J].食品工业科技,2009,5:29-32.
[5]单春乔,赵红岩,崔丽,等.生物活性肽生理作用及功能研究[J].粮食与油脂,2011(4):15-17.
[6]Mine Y,Shah ID I F.Nutraceutial proteins and peptides in health and disease[M].New York:CRC Press:2006.
[7]Chen Huamin,Koji Muramoto,Fumio Yamauchi.Structural analysis of anti-oxidative peptides from soybean β-conglycinin[J].Agric Food Chem,1995,43:574-578.
[8]Chen HM,Muramoto K,Yamau chi F,et al.Antioxidative Properties of histidine containing peptides designed from peptide fragments found in the digests of a soybean protein[J].J Agric Food Chem,1998,46:49-53.
[9]于丽娜,孙杰,刘少芳,等.花生抗氧化水解产物制备及其抗氧化活性研究[J].核农学报,2013,27(2):188-196.
[10]刁静静,曹龙奎.大孔吸附树脂吸附分离高活性玉米抗氧化肽[J].食品科学,2011,32(16):187-191.
[11]李秀霞,韩鲁佳.玉米抗氧化肽的制备及纯化[J].食品与发酵工业,2010,36(7):73-77.
[12]黄昆,顾欣,王文江,等.山杏仁多肽的制备及清除自由基能力研究[J].食品工业科技,2012,33(18):107-115.
[13]Valko Marian,Leibfritz Dieter,Moncol Jan,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & Cell Biology,2007,39(1):44-84.
[14]Xu Li,Li Hongmei,Huang Yi bing,et al.A study on anti-oxidative activity of soybean with Lino Leic acid peroxidation systems[M].Chem Res Chinese,2006,22(2):205-208.
[15]Sachidanandame K,Fagan S C,Ergul A.Oxidative stress and cardiovascular disease:antioxidants and unresolved issues[J]. Cardiovasc Drug Rev,2005,23:115-132.
[16]王晓坤.超声波辅助酶解制备花生抗氧化肽的研究[D].河南:河南工业大学,2012.
[17]王书云.玉米肽的精制及其抗氧化活性的研究[D].武汉:武汉工业学院,2010.
[18]Jamdar SN,Rajalakshmi V,Pednekar MD,et al.Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J].Food Chemistry,2010,121(1):178-184.
[19]Yan Mingyan,Li Bafang,Zhao Xue,et al.Characterization of acid-soluble collagen from the skin of walleye Pollock(Theragra chalcogramma)[J].Food Chem,2008,107(4):1581-1586.
[20]董周永,徐兆刚,周亚军,等.Protamex酶解马铃薯蛋白粉制备抗氧化肽工艺优化[J].农业工程,2013,3(6):75-78.
[21]Rollet-Labelle E,Grange MJ,Elbim C,et al.Hydroxyl radical as a potential intracellular mediator of polymor-phonuclear neutrophil apoptosis[J].Free Radical Biology and Medicine,1998,24:563-572.
[22]Stohs S J,Bagchi D.Oxidative mechanism in the toxicity of metal ions[J].Free Radical Biology and Medicine,995,18:321-336.
[23]綦蕾,王振宇.红松松仁抗氧化肽的制备及体外抗氧化活性评价[J].食品与发酵工业,2010,36(7):78-82.
[24]Li B,Chen F,Wang X,et al.Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-massspectrometry[J].Food Chem,2007,102:1135-1143.
[25]Pena-Ramos EA,Xiong YL.Antioxidant activity of soy protein hydrolysates in a lipodomal system[J].J. Food Sci,2002,67(8):2952-2956.
[26]代卉,施用晖,韩芳,等.小麦肽免疫活性及抗氧化作用的研究[J].天然产物研究与开发,2009,21:473-476.
[27]Chen H M,Muramoto K,Yamauchi F,et al.Antioxidant activity of designed peptides basedon the antioxidative peptide isolated from digests of a soybean protein[J].J Agric Food Chem,1996,44(9):2619-2623.
Technology for production of antioxidant peptides from apricot kernel meal by enzymolysis
ZHAO Huan-xia,ZHANG Hai-sheng*,YANG Shu-fang
(College of Food Engineering and Nutritional Science,Shannxi Normal University,Xi’an 710062,China)
In order to optimize enzymolysis conditions for production of antioxidant peptides from apricot kernel meal,the effect of operating conditions,such as enzyme dosage,substrate concentration,temperature and pH value,were analyzed by response surface methodology. Reducing power was chosen as the response value and optimum conditions were as follows:enzyme dosage 6725U/g,substrate concentration 3%,temperature 60℃ and pH8.28. Under such conditions,reducing power of enzymatic hydrolysates was 0.743,which was well matched with the predicted yield. Apricot kernel meal antioxidant peptide prepared with these enzymatic hydrolysis technological parameters presented strong antioxidant activity and it contained higher antioxidant amino acids.
apricot kernel meal;antioxidant peptide;amino acids
2014-07-10
赵换霞(1989-),女,在读硕士,研究方向:农产品加工及功能食品。
科技部农业科技成果转化资金项目(2011CB236000017)。
TS255.1
B
1002-0306(2015)07-0232-06
10.13386/j.issn1002-0306.2015.07.041
*通讯作者:张海生(1965-),博士,副教授,研究方向:动植物资源开发利用及功能食品研究。
