玻璃化冷冻胚胎与新鲜胚胎移植对子代小鼠生长发育的影响
2015-05-07周经委吴蓉花丁晓萌随刘才
周经委,吴蓉花,郭 里,孙 琴,丁晓萌,随刘才,陈 莉
0 引 言
自1978 年首例试管婴儿出生以来,试管婴儿技术经长期的发展,从第1 代试管婴儿到第3 代试管婴儿,辅助生殖技术(assisted reproductive technologies,ART)给许多不孕夫妇带来了希望。然而研究显示ART 子代有潜在的出生缺陷及较差的生存质量[1],由体外受精(in vitro fertilization,IVF)和胚胎移植所带来的问题越来越引起人们的关注。植入前的环境与胚胎的生长与代谢有关[2]。动物实验表明IVF 子代有患2 型糖尿病、肥胖、胰岛素抵抗以及冠心病的风险[3-4]。流行病学调查研究表明:ART 会引起子代的缺陷及相关疾病,包括出生缺陷、威廉氏症侯群综合征、甲状腺功能缺陷、心血管疾病等一系列并发症[5-7]。也有报道显示ART 对子代的相关功能无影响,冯玉芳等[8]发现IVF 对性成熟期子代小鼠的血清生化指标无影响。Beydoun 等[9]观察第1 代试管婴儿子代青春期无提前或退迟。近年来玻璃化冷冻技术在临床上得到广泛的应用,对于不孕患者行冷冻胚胎移植,避免了卵巢再次接受过度刺激,有报道称冷冻胚胎移植成功率高于新鲜胚胎移植[10]。相比传统的冷冻方法,玻璃化冷冻技术有较高的怀孕率和较理想的出生率[11-12]。然而,玻璃化冷冻胚胎会导致H19 和IGF2 的异常甲基化[13]。全胚玻璃化冷冻是胚胎在较高浓度的冷冻保护剂作用下快速降温,使胚胎内外的水分直接形成玻璃态,避免冰晶形成对胚胎的损伤。
为了进一步了解ART 以及胚胎冷冻是否会对子代生长发育和机体代谢产生影响,本研究比较了ART 和自然受孕小鼠子代的生长发育情况以及新胚和冻胚移植后子代的生长发育情况,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雌性SPF 级6 周龄昆明种小鼠20 只,健康SPF 级雌性8 周龄昆明种小鼠42只,健康SPF 级雄性10 周龄昆明种小鼠21 只,均购自第四军医大学实验动物中心。实验动物许可证编号:SCXK(苏)2011-0003。购买后的小鼠于南京军区南京总医院比较医学科适应性饲养1 周,饲养密度<6 只/盒,相对湿度40%~60%,温度20 ~24 ℃,以配方饲料饲养,自由采食和饮水,自动光控(12 h 明/12 h 暗)。本实验通过南京军区南京总医院动物伦理委员会审核批准。
1.1.2 药品与试剂 孕马血清(Pregnant mare serum gonadotropin,PMSG)、促性腺激素(Human menopausal gonadotropin,HCG)(宁波第二激素厂);水合氯醛(国药集团有限公司);玻璃化冷冻及解冻试剂(加藤公司,日本);Quinn's 系列胚胎体外操作液及培养液(Sigma 公司,美国)。
1.1.3 仪器与设备 电子天平(福州普利斯特有限公司);Minispec 小核磁分析仪(Bruker 公司,德国);培养箱(三洋公司,日本)。
1.2 方法
1.2.1 动物分组 10 周龄的雄鼠(5 只)与8 周龄的雌鼠(10 只)合笼后,次日清晨检查雌鼠阴栓,获得孕鼠4 只,产仔量分别为12、8、11、10 只(共41只),从中随机选择4、2、3、3 只共12 只仔鼠作为对照组。将10 周龄的雄鼠进行输精管结扎,结扎2 周后投入使用,结扎雄鼠(10 只)与发情期雌鼠(20只)合笼,次日清晨检查雌鼠阴栓,2.5 d 后进行胚胎移植,记为假孕雌鼠。选择性成熟期的雄鼠单笼饲养1 周以上为供精鼠。选择间情期的6 周龄雌鼠进行超促排卵,第1 天18:00 注射PMSG10 U/只,48 h后注射HCG10 U/只,第4 天上午取供精鼠附睾尾处的精子上游1 h,取超促排卵过的雌鼠卵与精子结合后培养,培养环境为:温度:37 ℃,CO2浓度:5%,饱和湿度。共获得囊胚62 枚。随机分为2 组,一组直接移植到假孕雌鼠子宫内,共获得4 只孕鼠,产仔量分别为7、7、6、7 只(共27 只),从中随机选择了2、3、2、2 只仔鼠共9 只仔鼠作为鲜胚移植组;另一组按玻璃化冷冻程序直接冻于液氮中,待移植日在常温下进行解冻,解冻后的囊胚于CO2培养箱培养2 h 左右,待胚胎完全扩张后进行移植,待分娩。共获得4 只孕鼠,产仔量分别为7、8、6、7 只(共28只),从中随机选择了3、4、2、3 只共12 只,仔鼠作为冻胚移植组。
1.2.2 体重测定 子代小鼠从出生开始每周固定日上午用电子天平记录体重变化,连续12 周。
1.2.3 体脂测定 子代小鼠生长到8 周(性成熟期),用小核磁分析仪检测脂肪与肌肉的分布情况。
1.3 统计学分析 使用SPSS 16.0 软件进行统计分析,定量资料以均数±标准差)表示。当数据符合正态分布时,进行单因素方差分析,组间两两比较视方差齐性检验(以0.1 作为检验水准进行Levene 检验):当方差齐同时,选择LSD 检验;当方差不齐时,选择Tamhane'sT2 检验。当不符合正态分布时,将数据进行Lg 转换之后,符合正态的进行单因素方差分析,如不符合,采用非参数检验,以P≤0.05 为差异有统计学意义。
2 结 果
2.1 冻胚移植组与新胚移植组移植的囊胚 新胚移植组胚胎与冻胚移植组复苏后胚胎在高倍显微镜下的形态无明显差异。
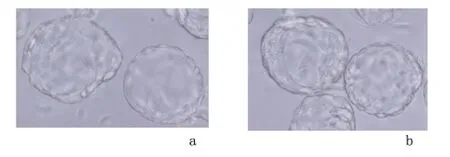
图1 冷冻胚胎移植组和新鲜胚胎移植的囊胚形态(×1000)Figure 1 Morphology of the vitrified versus fresh embryos(×1000)
2.2 子代小鼠体重的变化 冻胚移植组体重均高于同时期对照组(P <0.01)。鲜胚移植组小鼠在0周、2 ~6 周体重均高于对照组(P <0.05)。7 ~12周较对照组体重差异无统计学意义(P >0.05)。冻胚移植组较鲜胚移植组体重增加更为明显。见表1。
表1 各组子代小鼠体重的变化,g)Table 1 Body weight of the mouse offspring in different groups at different postnatal weeks,g)

表1 各组子代小鼠体重的变化,g)Table 1 Body weight of the mouse offspring in different groups at different postnatal weeks,g)
与对照组比较,*P <0.05,**P <0.01
出生时间 体重(周)对照组(n=12) 冻胚移植组(n=12) 鲜胚移植组(n=9)0 2.07±0.10 2.44±0.25** 2.46±0.32**1 6.16±0.31 9.58±1.05** 7.38±1.19 2 9.20±0.61 16.16±1.42** 14.38±2.36**3 16.88±0.67 23.49±1.71** 22.77±3.13**4 26.61±0.73 35.38±3.17** 33.58±3.29*5 30.55±1.55 40.93±3.80** 37.10±4.63*6 32.46±1.54 44.75±3.42** 38.73±3.57*7 34.69±2.60 48.13±4.60** 41.67±3.95 8 36.15±1.01 50.50±4.96** 42.93±4.40 9 37.75±2.29 52.99±4.14** 45.50±3.95 10 39.40±2.99 53.36±4.35** 47.39±4.42 11 39.94±3.46 56.22±4.02** 47.83±4.78 12 40.38±3.56 57.71±4.37**49.59±4.91
2.3 子代小鼠体脂含量的变化 用核磁分析仪扫描小鼠体脂的分布,结果发现冻胚移植组脂肪及肌肉的含量显著性高于对照组,差异有统计学意义(P <0.01);鲜胚移植组较对照组脂肪及肌肉的分布差异无统计学意义(P >0.05);鲜胚移植组脂肪分布明显低于冻胚移植组,差异有统计学意义(P <0.05),而肌肉的分布在组间差异无统计学意义(P >0.05)。见表2。
表2 8 周龄子代小鼠体脂和肌肉分布比较,g)Table 2 Contents of body fat and muscle of the mouse offspring in different groups at 8 postnatal weeks,g)

表2 8 周龄子代小鼠体脂和肌肉分布比较,g)Table 2 Contents of body fat and muscle of the mouse offspring in different groups at 8 postnatal weeks,g)
与对应对照组比较,*P <0.01;与冻胚移植组比较,#P <0.05
组别 体脂分布(g) 肌肉分布(g)对照组2.80±0.48 27.50±1.79冻胚移植组 9.32±4.34* 33.77±4.22*鲜胚移植组 5.24±2.56#31.25±3.78
3 讨 论
研究表明父母遗传或胚胎培养环境、父母的配子接受显微治疗会增加ART 儿童的出生缺陷[14]。动物实验表明IVF 子代胚胎期的重量高于自然生产的子代[15],有研究显示IVF 儿童的代谢综合征、胰岛素抵抗以及慢性炎症的患病率并未增加[6]。IVF 子代多为多胞胎和早产,且他们很少接受母乳喂养,故导致此类研究较为复杂。
本研究发现IVF 冻胚移植的子代小鼠体重出现了较明显的升高,而鲜胚移植组对小鼠子代的影响在出生6 周后得到修正,可能与子代的“追赶式生长”有关,而冻胚移植组未出现这种生长趋势,我们发现玻璃化冷冻移植组的体重变化比鲜胚移植组更加显著,这种变化是否与玻璃化冷冻技术有关本身有关仍需进一步研究。对4 ~14 岁的IVF 和自然生产的子代研究表明,他们的脂肪分布无差异[2]。Donjacour 等[16]用双能X 线扫描不同培养基的IVF 子代全身脂肪分布发现,随着年龄的增长,IVF 子代的脂肪含量逐渐升高。Scherrer 等[18]通过对体外培养获得的12 月龄的子代小鼠研究发现,ART 小鼠的肥胖率高于自然生产的子代[19]。ART 会导致儿童血管功能损害,IVF 过程同一些子代的并发症如低出生体重、2 型糖尿病、肥胖、胰岛素抵抗、Beckwith-Wiedemann 和Angelman 综合征相关[20-22]。
早期的生长状况与成年期疾病的发生相关[23]。体脂指标的变化可能会产生胰岛素[24],在第2 代试管婴儿的子代在青春期出现了身体脂肪分布的改变[25]。本实验发现IVF 冻胚子代的体脂含量高于对照组和鲜胚移植组,而鲜胚移植组同对照组并未出现差异,结果表明玻璃化冷冻技术对子代的影响要早于新鲜移植周期的子代,但本研究样本量较少,尚需大样本量进一步验证。鲜胚移植组和冻胚移植组产仔量均低于对照组,而产仔量的多少与子代的体重相关,体重与体脂的分布是密不可分的,在本实验中实验组体重的变化是与IVF 本身相关还是同产仔量相关,尚需更深入地研究。
本研究比较IVF 2 种移植方式,研究其从出生到成年期体重的变化,发现冻胚移植技术对子代的干扰较大,为了探讨其变化的原因,我们选择了性成熟期体脂的分布变化,发现脂肪组织是引起体重变化的主要原因,但本研究持续时间较短,一些指标可能要到中老年期才能表现出来,今后需要长期的监测代谢相关指标的变化,且产仔量可能对实验结果产生一定的影响。玻璃化冷冻技术作为一项在临床应用非常成熟的技术,其对子代的影响值得重视,本研究发现玻璃化冷冻技术对子代生长发育影响要大于鲜胚移植,但本实验并不能完全模拟人体环境,到底是亲本本身的因素还是体外操作干扰子代的生长发育还值得商榷。
[1] 黄晓卉,江胜芳,张昌军,等.IVF-ET 助孕后的妊娠及分娩结局分析[J].中国妇产科临床杂志,2010,11(4):265-267.
[2] Feuer S,Rinaudo P.Preimplantation stress and development[J].Birth Defects Res C Embryo Today,2012,96(4):299-314.
[3] Steel AJ,Sutcliffe A.Long-term health implications for children conceived by IVF/ICSI[J].Hum Fertil,2009,12(1):21-27.
[4] Sjoblom C,Roberts CT,Wikland M,et al.Granulocyte-macrophage colony-stimulating factor alleviates adverse consequences of embryo culture on fetal growth trajectory and placental morphogenesis[J].Endocrinology,2005,146(5):2142-2153.
[5] Hansen M,Bower C,Milne E,et al.Assisted reproductive technologies and the risk of birth defects--a systematic review[J].Hum Reprod,2005,20(2):328-338.
[6] Sakka SD,Loutradis D,Kanaka-Gantenbein C,et al.Absence of insulin resistance and low-grade inflammation despite early metabolic syndrome manifestations in children born after in vitro fertilization[J].Fertil Steril,2010,94(5):1693-1699.
[7] Ceelen M,van Weissenbruch MM,Vermeiden JP,et al.Cardiometabolic differences in children born after in vitro fertilization:follow-up study[J].J Clin Endocr Metab,2008,93(5):1682-1688.
[8] 冯玉芳,陶凌云,邵伟娟,等.体外受精对小鼠早期生长发育的影响及性成熟期血清生化指标的分析[J].实验动物与比较医学,2008(2):118-120.
[9] Beydoun HA,Sicignano N,Beydoun MA,et al.Pubertal development of the first cohort of young adults conceived by in vitro fertilization in the United States[J].Fertil Steril,2011,95(2):528-533.
[10] 孙正怡,何方方,郁 琦,等.冷冻环玻璃化法与程序冷冻法对人囊胚冷冻复苏效果的比较[J].生殖医学杂志,2006,15(3):161-164.
[11] AbdelHafez FF,Desai N,Abou-Setta AM,et al.Slow freezing,vitrification and ultra-rapid freezing of human embryos:a systematic review and meta-analysis[J].Reprod Biomed Online,2010,20(2):209-222.
[12] Simopoulou M,Asimakopoulos B,Bakas P,et al.Oocyte and embryo vitrification in the IVF laboratory:a comprehensive review[J].Folia Medica,2014,56(3):161-169.
[13] Wang Z,Xu L,He F.Embryo vitrification affects the methylation of the H19/Igf2 differentially methylated domain and the expression of H19 and Igf2[J].Fertil Steril,2010,93(8):2729-2933.
[14] Davies MJ,Moore VM,Willson KJ,et al.Reproductive technologies and the risk of birth defects[J].N Engl J Med,2012,366(19):1803-1813.
[15] Sjoblom C,Roberts CT,Wikland M,et al.Granulocyte-macrophage colony-stimulating factor alleviates adverse consequences of embryo culture on fetal growth trajectory and placental morphogenesis[J].Endocrinology,2005,146(5):2142-2153.
[16] Donjacour A,Liu X,Lin W,et al.In vitro fertilization affects growth and glucose metabolism in a sex-specific manner in an outbred mouse model[J].Biol Reprod,2014,90(4):113-134.
[17] Kellie L,Tamashiro K,Wakayama T,et al.Cloned mice have an obese phenotype not transmitted to their offspring[J].Nat Med,2002,8(3):262-267.
[18] Scherrer U,Rimoldi SF,Rexhaj E,et al.Systemic and pulmonary vascular dysfunction in children conceived by assisted reproductive technologies[J].Circulation,2012,125(15):1890-1896.
[19] Chen M,Norman RJ,Heilbronn LK,et al.Does in vitro fertilisation increase type 2 diabetes and cardiovascular risk?[J]Curr Diabetes Rev,2011,7(6):426-432.
[20] Chen M,Wu L,Zhao J,et al.Altered glucose metabolism in mouse and humans conceived by IVF[J].Diabetes,2014,63(13):3189-3198.
[21] Wang LY,Le F,Wang N,et al.Alteration of fatty acid metabolism in the liver,adipose tissue,and testis of male mice conceived through assisted reproductive technologies:fatty acid metabolism in ART mice[J].Lipids Health Dis,2013,12(1):1186-1202.
[22] Scott KA,Yamazaki Y,Yamamoto M,et al.Glucose parameters are altered in mouse offspring produced by assisted reproductive technologies and somatic cell nuclear transfer[J].Biol Reprod,2010,83(2):220-227.
[23] 于瑞杰,王 锋,汪俊军.生命早期生长状况对成人期餐后代谢反应及相关疾病的影响[J].医学研究生学报,2014,27(6):639-642.
[24] 王 强,杭 涛,徐 云,等.代谢综合征患者心外膜脂肪体积对胰岛素抵抗及冠心病的影响[J].医学研究生学报,2014,27(4):390-393.
[25] Belva F,Painter R,Bonduelle M,et al.Are ICSI adolescents at risk for increased adiposity?[J]Hum Reprod,2012,27(1):257-264.
