α-硫辛酸在小鼠创伤性脑损伤中抗神经细胞凋亡的作用
2015-05-07韦武亭王汉东
韦武亭,王汉东,吴 永,丁 惠,丁 可,李 桃
0 引 言
创伤性颅脑损伤(traumatic brain injury,TBI)是一种常见的中枢神经系统损伤性疾病,具有较高的发生率、致残率、病死率[1-2]。虽然近年来关于TBI 的研究都取得较大的进展,但关于TBI 的神经保护药物的研究尚未取得突破性进展。α-硫辛酸在自然界广泛分布,属于B 族维生素化合物,是一种天然的强抗氧化剂[3]。硫辛酸是线粒体内丙酮酸脱氢酶、α-酮戊二酸脱氢酶的关键辅基,能够改善和促进氧化磷酸化和提高线粒体的功能,能够清除自由基,螯合金属离子,再生内源性抗氧化剂,减少细胞的凋亡[4-5]。本研究通过小鼠TBI 模型探讨α-硫辛酸是否对线粒体具有保护作用,从而减少脑损伤后神经细胞的凋亡,也为今后TBI 的研究和临床治疗提供相关实验数据和新思路。
1 材料与方法
1.1 实验材料 健康雄性ICR 小鼠,6 周龄,72 只,28 ~30 g,由南京军区南京总医院比较医学科提供,动物质量合格证号:SCXK(军)2012-0014。将小鼠置于安静、温暖舒适的环境中(温度:25 ℃,湿度:50%),自由饮食饮水。α-硫辛酸购自于美国Sigma公司,尼氏染色液购于碧云天生物技术有限公司,TUNEL 细胞凋亡检测试剂盒购自美国罗氏(Roche)公司,细胞色素c(Cytochrome c)和Bcl-2 相关X 蛋白(Bcl-2 Associated X Protein,Bax)抗体购自美国Abcan 公司。COX IV 抗体和Caspase-3 抗体购自美国Cell Signaling Technology 公司。
1.2 实验分组及给药 α-硫辛酸溶于溶剂(含二甲基亚砜的玉米油)中,72 只小鼠按照随机数字表法随机分为4 组:假手术+溶剂组,假手术+α-硫辛酸组,外伤+溶剂组,外伤+α-硫辛酸组,每组18只。假手术+α-硫辛酸组与外伤+α-硫辛酸组给予α-硫辛酸(100 mg/kg),假手术+溶剂组和外伤+溶剂组在同一时间给予相等剂量的溶剂。所有小鼠于模型制作后30 min 灌胃给药,24 h 后重复给1 次,48 h后取标本。
1.3 TBI 模型 小鼠苯巴比妥(50 mg/kg)腹腔注射麻醉后固定于立体定向仪上,采用自由落体法制备闭合性小鼠脑损伤模型[6]:备皮消毒后将小鼠头皮沿中线位置切开约1 cm,撞击点定位于冠状缝后3 mm 和矢状缝左侧3 mm 的交叉点。假手术组仅切开头皮,外伤组使用200 g 重物自2.5 cm 高处自由落体垂直撞击于定位点上。
1.4 脑水肿检测 TBI 后48 h,经左侧心室灌注40 mL 等渗盐水(4 ℃)后迅速断头取脑,去除脑干和小脑后,即可获得左侧皮层组织。每个样品立即测定湿重,然后在80 ℃烘箱中放置72 h,获得干重。公式如下:
脑含水量=[(湿重-干重)/湿重]×100%[7]
1.5 Western blot 检测 致伤48 h 后,经左侧心室灌注40 mL 等渗盐水(4 ℃)后迅速断头取脑,取伤灶周围3 mm 范围脑组织。根据组织线粒体分离试剂盒(#c3606;上海碧云天生物技术有限公司)说明书提取。将新鲜的组织样品在冰浴上进行匀浆,在1000×g,4 ℃离心5 min。取上清在3500×g,4 ℃离心10 min,所得沉淀即为分离所得的线粒体,此次上清液在12 000×g,4 ℃离心10 min,取上清液即为去除线粒体的细胞质蛋白。
用10%的SDS-PAGE 胶,恒压110 V 电泳分离所提取的蛋白,使用恒流200 mA 50 min 将蛋白转到PVDF 膜上,将带有目标蛋白的膜裁好并加入5%脱脂牛奶封闭1 h,然后根据抗体说明书孵育一抗和内参过夜,第2 天用TBST 漂洗10 min×3 次,用辣根过氧化物酶(HRP)标记的二抗孵育2 h,再用TBST漂洗10 min×3 次,接着在暗房中发光液显影后用X射线胶片(Fuji Hyperfilm,Tokyo,Japan)曝光。蛋白水平用UN-SCAN-IT 软件(Silk Scientific Inc.,Orem,UT,USA)处理分析。
1.6 免疫组化染色 通过免疫组化评估Caspase-3的表达。脑组织标本均经福尔马林固定24 h 后,石蜡包埋。切片厚度为5μm,常规脱蜡、脱水,用枸橼酸缓冲液修复抗原,正常山羊血清封闭1 h,然后孵育兔单克隆Caspase-3 抗体,浓度为1∶300,4 ℃过夜,第2 天用PBS 漂洗10 min×3 次后,用辣根过氧化物酶(HRP)标记的羊抗兔二抗孵育1 h,浓度为1∶500。再用PBS 漂洗10 min×3 次,用苏木精、二氨基联苯胺显色,封固。在光学显微镜下观察伤灶皮层周围区域染色结果,在400 倍镜随机选取6 个视野对Caspase-3阳性细胞进行计数,以平均100 个细胞中Caspase-3阳性细胞数作为阳性率进行统计分析。
1.7 尼氏染色 脑组织切片厚度为5 μm,染色操作过程按尼氏染色液说明书进行。在光学显微镜下观察伤灶皮层周围区染色结果,在400 倍镜下随机选取6 个视野对存活的神经元细胞进行计数,以平均100个细胞中神经元细胞存活数作为神经元存活率。
1.8 TUNEL 染色 脑组织切片厚度为5 μm,染色操作过程按TUNEL 细胞凋亡检测试剂盒说明书进行。在光学显微镜下观察伤灶皮层周围区染色结果,在400 倍镜下随机选取6 个视野对阳性细胞进行计数,以平均100 个细胞中阳性细胞数作为凋亡指数。
1.9 统计学分析 采用SPSS 16.0 软件进行统计分析,所有数据以均数±标准差()表示,多组间均数比较采用单因素方差分析,以P≤0.05 为差异具有统计学意义。
2 结 果
假手术组中均无小鼠死亡,外伤+溶剂组小鼠死亡3 只,外伤+硫辛酸组小鼠死亡1 只。
2.1 α-硫辛酸对小鼠外伤后脑水肿的影响 外伤+溶剂组脑组织含水量[(81.71±0.66)%]高于外伤+α-硫辛酸组[(79.89±0.55)%],差异有统计学意义(P <0.01);亦高于假手术+溶剂组[(79.05±0.67)%]、假 手 术 + α-硫 辛 酸 组[(78.65±0.37)%],差异有统计学意义(P <0.01)。而假手术+溶剂组与假手术+α-硫辛酸组间差异无统计学意义(P ﹥0.05)。
2.2 α-硫辛酸对小鼠外伤后线粒体与去线粒体细胞质中Cytochrome c 和Bax 的变化水平的影响线粒体中外伤+溶剂组Cytochrome c 表达较假手术+溶剂组和假手术+α-硫辛酸组明显降低,而Bax 的表达则明显增加(P <0.01);外伤+α-硫辛酸组中Cytochrome c 表达较外伤+溶剂组明显增加,而Bax表达则明显减少(P <0.05)。在去线粒体细胞质中,外伤+溶剂组Cytochrome c 表达较假手术+溶剂组和假手术+α-硫辛酸组明显增加,而Bax 的表达则明显减少(P <0.01);外伤+α-硫辛酸组中Cytochrome c 表达较外伤+溶剂组明显减少,而Bax表达则明显增加(P <0.05)。假手术+溶剂组与假手术+α-硫辛酸组之间Cytochrome c 和Bax 的蛋白表达差异无统计学意义(P >0.05)。见图1,表1。

图1 Western blot 检测α-硫辛酸对小鼠外伤后线粒体与去线粒体细胞质中Cytochrome c 和Bax 的变化水平的影响Figure 1 Effects of alpha lipoic acid on the levels of cytochrome c and Bax in mitochondria and cytosol after traumatic brain injury in mice
表1 Western blot 检测α-硫辛酸对小鼠外伤后线粒体与去线粒体细胞质中Cytochrome c 和Bax 的变化水平的影响Table 1 Effects of alpha lipoic acid on the levels of cytochrome c and Bax in mitochondria and cytosol after traumatic brain injury in mice

表1 Western blot 检测α-硫辛酸对小鼠外伤后线粒体与去线粒体细胞质中Cytochrome c 和Bax 的变化水平的影响Table 1 Effects of alpha lipoic acid on the levels of cytochrome c and Bax in mitochondria and cytosol after traumatic brain injury in mice
与外伤+溶剂组比较,*P <0.05,**P <0.01
组别 n Cytochrome线c粒体BaxCytochr去om线e c粒 体细胞质Bax假手术+溶剂组 5 0.95±0.31**0.97±0.22** 0.96±0.17**1.01±0.13**假手术+α-硫辛酸组 5 0.98±0.24**0.91±0.26** 0.92±0.25**0.96±0.19**外伤+溶剂组 5 0.44±0.78 2.11±0.33 1.71±0.20 0.43±0.14外伤+α-硫辛酸组 5 0.82±0.23* 1.26±0.36* 1.20±0.22* 0.77±0.17*
2.3 Caspase-3 的免疫组化检测 外伤+溶剂组Caspase-3 阳性细胞的表达[(58.40±7.31)%]高于外伤+α-硫辛酸组[(47.42±7.74)%],差异有统计学意义(P <0.05);亦高于假手术+溶剂组[(10.25 ±2.19)%]和假手术+α-硫辛酸组[(10.23±1.21)%],差异有统计学意义(P <0.01)。假手术+溶剂组和假手术+α-硫辛酸组之间Caspase-3 的表达差异无统计学意义(P >0.05)。见图2。

图2 免疫组化法检测Caspase-3 的表达(×400)Figure 2 Caspase-3 expression detected by immunohistochemistry(×400)
2.4 α-硫辛酸对小鼠外伤后神经元细胞存活的影响外伤+溶剂组神经元存活率[(44.45±10.56)%]低于外伤+α-硫辛酸组[(57.46±11.01)%],差异有统计学意义(P <0.05);亦明显低于假手术+溶剂组[(92.91±2.46)%]、假手术+α-硫辛酸组[(91.50±2.62)%],差异有统计学意义(P <0.01)。假手术+溶剂组和假手术+α-硫辛酸组之间神经元的存活率差异无统计学意义。见图3。
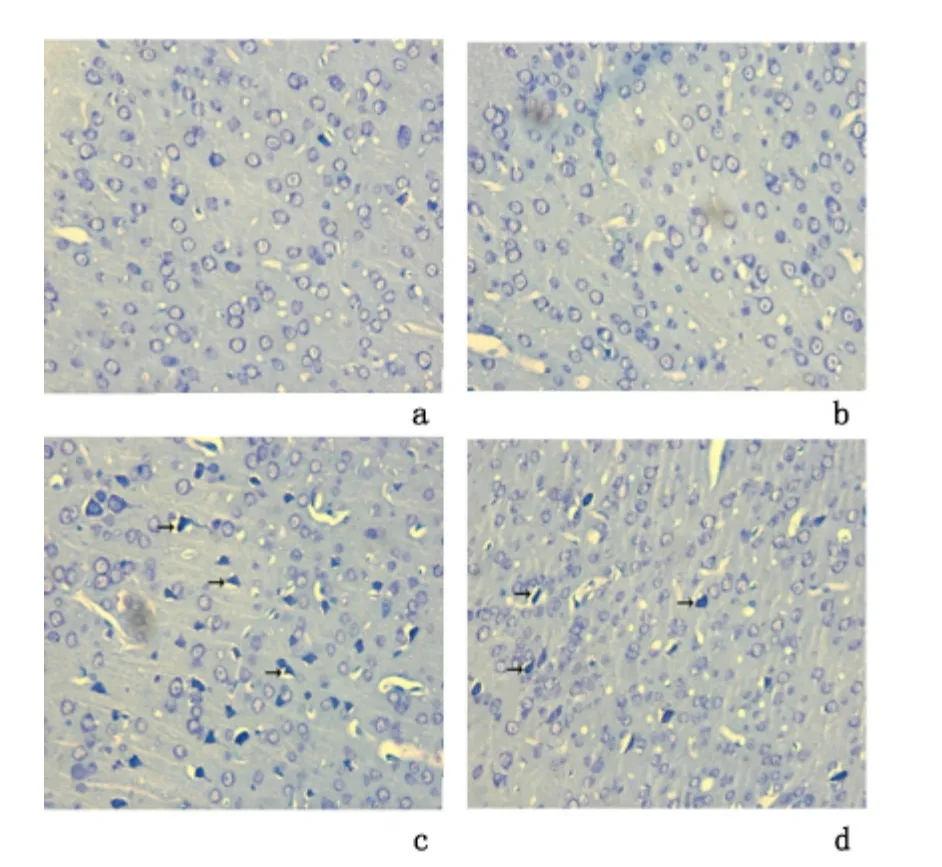
图3 尼氏染色检测神经元存活情况(×400)Figure 3 Neuron survival detected by Nissl staining(×400)
2.5 TUNEL 检测α-硫辛酸对外伤后神经细胞凋亡的影响 外伤+溶剂组小鼠神经细胞凋亡指数[(59.63±8.61)%]高于外伤+α-硫辛酸组[(44.86±7.32)%],差异有统计学意义(P <0.05);亦明显高于假手术+溶剂组[(11.46±3.15)%]和假手术+α-硫辛酸组[(9.11±3.14)%],差异有统计学意义(P <0.01)。假手术+溶剂组与假手术+α-硫辛酸组之间细胞凋亡指数差异无统计学意义(P >0.05)。见图4。

图4 TUNEL 检测神经细胞凋亡情况(×400)Figure 4 Apoptosis of neural cells detected by TUNEL(×400)
3 讨 论
TBI 引起的脑损伤可分为原发性脑损伤和继发性脑损伤,原发性脑损伤是由外力的直接作用造成的,可以直接导致神经细胞的死亡,是一种不可逆的损伤过程。而继发性脑损伤是在原发性损伤基础上的进一步发展,是一个潜在的可逆的过程。大量的实验研究表明,神经细胞凋亡的发生与线粒体损伤、活性氧及钙超载等有着密切联系[8-10],可见继发性脑损伤可通过多条细胞凋亡信号途径引起神经细胞的凋亡,而且这个过程可能存在许多可调控的靶点。因此通过对迟发性神经细胞凋亡相关通路进行干预,现已成为研究治疗TBI 的靶点。
线粒体是细胞的能量工厂,其功能是把有机化合物氧化产生的能量转化为ATP。线粒体调节膜电位并控制细胞程序性死亡,当受到不良刺激,线粒体内膜与外膜接触位点处生成通透性转变孔道,会使线粒体内膜通透性提高,引起线粒体跨膜电位的耗散,从而导致细胞凋亡[11]。线粒体膜通透性增加也能使诱导凋亡因子(apoptosis-inducing factor,AIF)等分子释放进入细胞基质,破坏细胞结构。Bax 属于bcl-2 家族,具有孔形成能力[12],并能诱导Cytochrome c 从线粒体释放入细胞质,在dATP 存在时与凋亡蛋白酶激活因子结合并激活Caspase-9,后者再激活Caspase-3 而导致细胞凋亡的发生。AIF 通过促进线粒体释放Cytochrome c 而增强凋亡信号,并可快速激活核酸内切酶。结合相关文献及本实验结果显示,TBI 后线粒体Bax 表达增加,细胞质内减少,可提示外伤后Bax 在线粒体上可能形成了孔道;而线粒体Cytochrome c 表达减少,细胞质中增多,也可提示外伤Cytochrome c 从线粒体释放到细胞质。而且通过检测Caspse-3 的表达和神经元的存活率也恰好证明前面所述。
α-硫辛酸是一种很强的抗氧化剂,既有水溶性又有脂溶性,且具有显著的亲电性和与自由基反应的能力。目前有研究表明α-硫辛酸对心、脑、肾的缺血再灌注损伤[13-16]、糖尿病及其神经并发症[17]、中枢神经系统退行性疾病[18]等均有较强的保护作用。本研究结果显示,在小鼠创伤性脑损伤模型中给予α-硫辛酸治疗后,小鼠脑水肿明显改善,同时线粒体Bax 的表达下降,释放到细胞质的Cytochrome c 明显减少,在免疫组化染色可见Caspase-3阳性细胞的表达量降低,且神经元存活率明显增高。可见α-硫辛酸对外伤后引起的脑神经细胞起到保护作用,其可能机制为α-硫辛酸通过抑制线粒体凋亡途径而起抗凋亡作用。这为我们今后研究TBI 的治疗提供依据,同时α-硫辛酸在TBI 的治疗效果还有待进一步的研究。
[1] Toklu HZ,Hahan T,Biber N,et al.The protective effect of alpha lipoic acid against traumatic brain injury in rats[J].Free Radic Res,2009,43:658-667.
[2] 李建民,赵雅宁,马荣丽,等.重型弥漫性颅脑损伤大鼠海马区Homer1a 表达与神经细胞丢失的关系[J].医学研究生学报,2014,27(8):797-801.
[3] Ghibu S,Richard C,Delemasure S,et al.An endogenous dithiol with antioxidant properties:alpha-lipoic acid,potential uses in caridovascular diseases[J].Ann Cardiol Angeiol (Paris),2008,57(3):161-165.
[4] Yang Y,Wang W,Liu Y,et al.Alpha-lipoic acid inhibits high glucose-induced apoptosis in HIT-T15 cells[J].Dev Growth Differ,2012,54:557-565.
[5] Abdin A,Sarhan N.Intervention of mitochondrial dysfunctionoxidative-dependent apoptosis as a possible neuroprotective mechanism of α-lipoic acid against rotenone-induced Parkinsonism and L-dopa toxicity[J].Neurosci Res,2011,71(4):387-395.
[6] Flierl MA,Stahel PF,Beauchamp KM,et al.Mouse closed head injury model induced by a weight-drop device[J].Nat Protoc,2009,4(9):1328-1337.
[7] Xu J,Wang H,Ding K,et al.Luteolin provides neuroprotection in models of traumatic brain injury via the Nrf2-ARE parthway[J].Free Radic Bio Med,2014,71:186-195.
[8] Yang W,Shi L,Chen L,et al.Protective effects of perindopril on d-galactose and aluminum trichloride induced neurotoxicity via the apoptosis of mitochondria-mediated intrinsic pathway in the hippocampus of mice[J].Brain Res Bull,2014,109:46-53.
[9] 卜 婧,张永亮,李灵芝,等.蕨麻正丁醇部位对大鼠海马神经元缺氧致钙超载的抑制作用[J].医学研究生学报,2014,27(2):133-137.
[10] 刘 阳,王李瑶,张庆华,等.活化Caspase 9 在牛磺酸保护神经细胞中的保护作用[J].医学研究生学报,2014,27(8):793-796.
[11] Galluzzi L,Morselli E,Kepp O,et al.Targeting post-mitochondrial effectors of apoptosis for neuroprotection[J].Biochim Biophys Acta,2009,1787(5):402-413.
[12] Annis MG,Soucie EL,Dlugosz PJ,et al.Bax forms multispanning monomers that oligomerize to permeabilize membranes during apoptosis[J].EMBO J,2005,24(2):2096-2103.
[13] Deng C,Sun Z,Tong G,et al.α-lipoic acid reduces infarct size and preserves cardiac function in rat myocardial ischemia/reperfusion injury through activation of PI3K/Akt/Nrf2 pathway[J].PLoS One,2013,8(3):e58371.
[14] Fu B,Zhang J,Zhang X,et al.Alpha-lipoic acid upregulates SIRT1-dependent PGC-1alpha expression and protects mouse brain against focal ischemia[J].Neuroscience,2014,281C:251-257.
[15] Hardas SS,Sultana R,Clark AM,et al.Oxidative modification of lipoic acid by HNE in Alzheimer disease brain[J].Redox Biol,2013,1:80-85.
[16] Cimolai MC,Vanasco V,Marchini T,et al.Alpha-Lipoic acid protects kidney from oxidative stress and mitochondrial dysfunction associated to inflammatory conditions[J].Food Funct,2014,5(12):3143-3150.
[17] Gomes MB,Negrato CA.Alpha-lipoic acid as a pleiotropic compound with potential therapeutic use in diabetes and other chronic diseases[J].Diabetol Metab Syndr,2014,6(1):80.
[18] Hardas SS,Sultana R,Clark AM,et al.Oxidative modification of lipoic acid by HNE in Alzheimer disease brain[J].Redox Biol,2013,1:80-85.
