圣女樱桃番茄再生体系的研究
2015-05-06赵新涛等
赵新涛等


摘要: 以圣女樱桃番茄为试材,通过对其子叶和下胚轴的离体培养,研究不同培养基和激素浓度及配比对愈伤组织诱导、不定芽分化及生根诱导的影响,以筛选最佳再生体系,并研究VC对番茄组培过程中褐化现象的影响。结果表明:诱导圣女樱桃番茄愈伤组织的最适培养基为MS+(0.2~0.4)mg/L IAA+2.0 mg/L 6-BA,不定芽分化的最适培养基为MS+0.1 mg/L IAA+(1.0~3.0)mg/L 6-BA,诱导生根的最适培养基为1/2MS+0.1 mg/L NAA;子叶为最佳外植体,其不定芽的分化速度、分化率及生长情况均优于下胚轴;在愈伤组织诱导培养基中添加10 mg/L VC,能有效抑制褐化的发生。
关键词:圣女樱桃番茄;子叶;下胚轴;再生体系;VC;褐化
中图分类号:S641.204+.3文献标识号:A文章编号:1001-4942(2015)03-0013-05
Study on Regeneration System of Lycopersicon esculentum Mill.
Zhao Xintao, Su Feng*, Du Yanling
(Chemical Engineering College, Qingdao University of Science and Technology, Qingdao 266042, China)
AbstractThe effects of different culture medium, hormone concentration and ratio on callus induction, adventitious bud differentiation and root induction of Lycopersicon esculentum Mill. were studied by culturing cotyledon and hypocotyl in vitro. Vc was added in culture medium to control browning phenomenon. The results showed that the optimum medium and hormone ratio for callus induction was MS+(0.2~0.4) mg/L IAA+2.0 mg/L 6-BA; the optimum medium and hormone ratio for adventitious bud differentiation was MS+0.1 mg/L IAA+(1.0~3.0) mg/L 6-BA; the optimum medium and hormone ratio for root induction was 1/2MS+0.1 mg/L NAA. Cotyledon was the best explant, which showed higher differentiation speed and rate, and better bud growth condition than hypocotyl. The browning phenomenon could be controlled through adding 10 mg/L Vc in callus induction medium.
Key wordsLycopersicon esculentum Mill.;Cotyledon; Hypocotyl;Regeneration system;VC;Browning
圣女樱桃番茄(Lycopersicon esculentum Mill.),又称圣女果,茄科番茄属[1]。圣女果中含有谷胱甘肽和番茄红素,可促进人体生长发育,增加抵抗力,而且维生素含量是普通番茄的1.7倍,尤其是维生素PP含量居果蔬之首,被联合国粮农组织列为优先推广的“四大水果”之一。近年来,组织培养技术已广泛应用于番茄育苗生产、杂交、品种改良以及基因工程等研究工作。激素在植物再生体系建立过程中的作用不容忽视,在未添加激素的培养基中很难分化出不定芽或不定芽的分化率很低[2,3]。赵燕等[4]对杂交番茄早丰(07-13)的研究发现,诱导番茄愈伤组织形成和芽分化的最佳培养基分别为MS+0.3 mg/L IAA+2.0 mg/L 6-BA和MS+0.1 mg/L IAA+2.0 mg/L 6-BA。仇燕等[5]对砧木1号番茄的研究发现,诱导子叶外植体愈伤组织和不定芽的最适培养基为MS+0.2 mg/L IAA +1.0 mg/L 6-BA;诱导下胚轴外植体愈伤组织和不定芽的最适培养基为MS+0.5 mg/L IAA +1.0 mg/L 6-BA。宗宪春等[6]对潘那利番茄生根条件的研究表明,0.1 mg/L IAA最利于生根。许飞云等[7]对黑珍珠番茄的研究表明,当NAA浓度为0.05~0.08 mg/L时最利于生根。因此,不同品种番茄再生植株的获得,对激素浓度、配比和培养条件等的要求也各不相同,需要进行针对性的试验,才能明确某一品种的激素要求,从而获得质量好、生长快的再生植株[8~10]。
褐化现象是植物组培过程中常见的不良反应,严重影响外植体的脱分化和再分化。愈伤组织褐变的机理是细胞受胁迫或其他不利条件影响而死亡,或细胞发生自然死亡时,其伤口分泌的酚类物质在多酚氧化酶作用下氧化为醌类物质造成的[11]。多项研究表明,在培养基中加入吸附剂活性炭或抗氧化剂VC,可有效遏制褐变的产生[12~14]。但活性炭在吸附有害物质的同时也吸收了培养基中的营养,对愈伤组织的生长造成影响[15]。
本试验以圣女樱桃番茄为试材,以子叶和下胚轴为外植体,以筛选出最佳外植体类型;向培养基中添加不同浓度及配比的吲哚乙酸(indole-3-aceticacid,IAA)、6-苄基氨基嘌呤(6-enzyladenind,6-BA)和2-(1-萘基)乙酸(1-naphthylacetic acid,NAA),以筛选出愈伤组织诱导、不定芽分化及生根诱导的最适培养基;向培养基中添加不同浓度的抗氧化剂VC,以筛选出抑制褐化的最适VC添加量,以期为番茄大家族再生体系的研究提供参考和依据。endprint
1材料与方法
1.1试验材料
1.1.1试验品种圣女樱桃番茄,种子产于山东省德州市华信种业。
1.1.2培养基种子萌发培养基:1/2MS培养基(在MS培养基的基础上,大量元素减半,其它成分不变)。
愈伤组织诱导及不定芽分化培养基:以MS为基本培养基,添加不同浓度的IAA(0.1、0.2、0.3、0.4、0.5 mg/L)、6-BA(0.1、0.2、0.3、0.4、0.5 mg/L)。
生根培养基:以MS、1/2MS为基本培养基,分别添加不同浓度的单一激素IAA(0.1、0.2、0.3、0.4、0.5 mg/L)、NAA(0、0.05、0.1、0.3、0.5 mg/L)。
以上培养基均含3%蔗糖,添加0.7%琼脂,调整pH值为 5.8~6.2。
1.2试验方法
1.2.1无菌苗的获得选取籽粒饱满、大小一致的种子,清水浸泡6 h。待种子完全吸涨后,用75%的乙醇消毒30~60 s,无菌水冲洗3次;NaClO消毒15 min,无菌水冲洗4~5次,无菌滤纸吸干,接种于1/2MS培养基中暗培养,至大多数种子发芽露白,将其放置于温度为26~28℃、光周期为16 h/d、光照强度1 800 lx的培养箱中培养,6~8 d获得无菌苗。
1.2.2愈伤组织的诱导及不定芽的分化取生长6~8 d的无菌苗,分别以子叶和下胚轴为外植体,将子叶切成约0.5 cm×0.5 cm的小块,叶背向下平铺接种于愈伤组织诱导培养基中;将下胚轴切成1 cm左右小段,接种于上述培养基中。每个培养皿接种10个外植体,先进行暗培养,以诱导愈伤组织的发生;然后进行光照培养,诱导生成不定芽,每隔10 d左右继代一次,观察并记录试验结果[16~18]。
1.2.3生根诱导当不定芽长至2~4 cm左右时,自芽基部切下,接种于生根培养基中诱导生根。统计并记录根发生的时间及生长状况。
1.2.4VC对褐化现象的抑制作用以筛选出的最佳愈伤组织诱导培养基进行培养,在次代培养时添加不同浓度 VC(0、10、30、50 mg/L)。观察褐化发生的情况,筛选出VC的最佳添加量。
1.3数据统计
发芽率(%)=(发芽种子数/接种种子数)×100
愈伤组织诱导率(%)=(诱导出愈伤组织的外植体数/接种外植体数)×100
不定芽的诱导率(%)=(分化出不定芽的外植体数/接种外植体数)×100
用Microsoft Excel进行数据处理与分析。
2结果与分析
2.1外植体的筛选
以子叶和下胚轴为外植体时圣女樱桃番茄愈伤组织的发生时间不同,子叶接种8 d时切口处开始卷起膨大,出现大量绿色胚状体,愈伤组织开始形成(图1 A1);下胚轴切段接种6 d时肿胀,两端形成肉眼可见的愈伤组织(图1 B1)。经过2~3周的培养,两种外植体均形成大块的愈伤组织(图1 A2、B2)。虽然以下胚轴为外植体的愈伤组织发生时间较早,但以子叶为外植体所形成的愈伤组织饱满,且在愈伤发展过程中伴有不定芽的分化。
在不定芽的诱导过程中,同种激素条件下,子叶外植体的愈伤组织分化出不定芽的时间较短,且出芽率明显高于下胚轴,形成的不定芽生长健壮且生长速度快。综合比较,子叶为圣女樱桃番茄组织培养的最佳外植体。
A1:子叶愈伤组织开始形成;A2:已成型的子叶愈伤组织;
B1:下胚轴愈伤组织开始形成;B2:已成型的下胚轴愈伤组织
2.2激素浓度及配比对愈伤组织诱导的影响
从表1可以看出,试验采用的25种培养基均可诱导番茄子叶和下胚轴形成愈伤组织,且出愈率较高,说明圣女樱桃番茄的子叶和下胚轴均具有较强的脱分化能力,且对IAA和6-BA的浓度及配比要求不严格。比较可得,MS+(0.2~0.4)mg/L IAA+2 mg/L 6-BA培养基诱导的愈伤组织体积较大,结构致密,生长速度快,适宜愈伤组织诱导。
2.3激素浓度及配比对不定芽诱导的影响
在原培养基上继续培养,愈伤组织可分化出不定芽,两周后,长成有茎叶的苗(图2)。20 d后,统计不定芽的分化情况。
由表1可以看出,不同浓度及配比的IAA、6-BA对不定芽的形成存在明显差异:当IAA浓度为0.1 mg/L、6-BA浓度为1.0~3.0 mg/L时,子叶和下胚轴来源的愈伤组织形成的不定芽诱导率较高,均达80%以上,且诱导时间最短,生长较快。随着IAA和6-BA浓度的升高,虽然产生不定芽的时间和诱导率无显著变化,但芽体生长缓慢,畸形芽比例升高。因此,适宜愈伤组织分化不定芽的培养基为MS+0.1 mg/L IAA+(1~3)mg/L 6-BA,在该培养基中不定芽健壮、数目较多且长,生长迅速。
2.4激素浓度及配比对不定芽生根诱导的影响
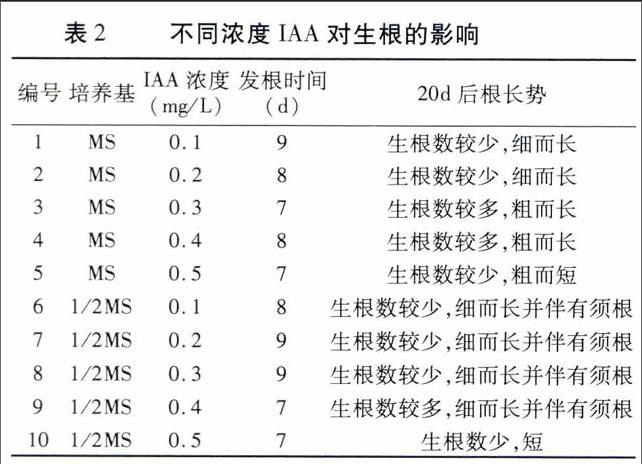
当不定芽长至2~4 cm时,将其切下放入生根培养基中培养(表2、3)。
由表2可以看出,当IAA浓度为0.1~0.4 mg/L时,随着IAA浓度的增加,根的数量增加,根系也变得粗壮;当IAA浓度大于0.4 mg/L时,根的数量反而减少,而且长度也变短,这一现象在MS或1/2MS培养基中表现相同。因此, MS+0.3 mg/L IAA或1/2MS+0.3 mg/L IAA培养基的生根效果最好(如图3A、B)。
由表3可以看出,在未添加激素的MS或1/2MS 培养基上时,不定芽在较短时间内开始生根,说明不定芽的生长过程中会产生促进生根的激素,这与王傲雪等[19]的研究结果一致;但生根细而长,长势较弱,说明该培养环境不适合圣女樱桃番茄生根。当在MS或1/2MS培养基中添加NAA后,随着NAA浓度的增加,生根数量先增加后减少,NAA浓度为0.10 mg/L时,生根数最多,根系粗而长并伴有须根;继续增加NAA浓度,根虽变得更加粗壮,但长度变短且生根数量减少(图3C、D)。NAA浓度相同时,1/2MS培养基上不定芽的根生长相对较好。因此,1/2MS+0.10 mg/L NAA培养基为最佳生根诱导培养基。endprint
2.5VC浓度对抑制愈伤组织褐化的影响
本试验以MS+0.3 mg/L IAA +2.0 mg/L 6-BA为培养基,添加不同浓度VC进行愈伤组织的褐化抑制试验。结果(表4)显示,当VC浓度为0~10 mg/L时,愈伤组织的褐化率从60%下降至10%,有效抑制了褐化现象的发生;当VC浓度增大至10~50 mg/L时,褐化率由10%增至30%。分析原因可能是过量的VC对愈伤组织产生一定的干扰和毒害作用[11]:首先VC为酸性,大量的酸性物质加入培养基中,破坏了愈伤组织生长环境中的酸碱平衡,使愈伤组织的生长受到影响,再次出现褐化;其次,VC虽为抗氧化剂,但过多外源性抗氧化剂的加入,也会破坏愈伤组织生长发育所需要的内环境,打乱愈伤组织原有的代谢节律,从而造成愈伤组织发育不良。
3结论与讨论
不同外植体诱导愈伤组织和不定芽分化的能力不同。本试验中,以子叶为外植体的愈伤组织诱导不定芽的效率明显高于以下胚轴为外植体的愈伤组织,且不定芽的分化系数高,芽体生长快,畸形芽率低[10, 21, 22]。因此,子叶为圣女樱桃番茄组培的最佳外植体。
IAA和6-BA是植物愈伤组织和不定芽形成的常用激素。本试验以圣女樱桃番茄的子叶为外植体,愈伤组织诱导率都达到100%;以下胚轴为外植体时略低,但均在89%以上。在MS+(0.2~0.4)mg/L IAA+2.0 mg/L 6-BA上,愈伤组织的体积较大,结构致密,生长速度快,为最适愈伤组织诱导培养基,这与孙靖棣[20]、范锡麟[21]等的研究结果相似。不同激素浓度对不定芽分化的影响差别显著。IAA浓度为0.1 mg/L时,正常不定芽发生率较高,随着IAA浓度增大正常芽率降低;6-BA浓度增加到3.0 mg/L以上时,刚萌发的芽不能正常生长,导致正常芽率下降。在MS+0.1 mg/L IAA+(1.0~3.0)mg/L 6-BA上不定芽的诱导效果最好,为最适不定芽诱导培养基。圣女樱桃番茄的不定芽不适合在无激素的MS或1/2MS培养基中生根,最佳生根的培养基为1/2MS+0.1 mg/L NAA。
添加抗氧化剂是抑制褐化现象发生的有效方法之一,本试验结果表明,当VC浓度为10 mg/L时,能明显抑制褐化的发生。
参考文献:
[1]
Abu-El-Heba G A, Hussein G M, Abdalla N A. A rapid and efficient tomato regeneration and transformation system [J]. Agriculture and Forestry Research, 2008, 58(1/2):103-110.
[2]Li L, Deng X W. It runs in the family: regulation of brassinosteroid signaling by the BZR1-BES1 class of transcription factors [J]. Trends in Plant Science, 2005, 10(6):266-268.
[3]Gendron J M, Wang Z Y. Multiple mechanisms modulate brassinosteroid signaling [J]. Current Opinion in Plant Biology, 2007, 10(5):436-441.
[4]赵燕, 刘清波, 杜元正, 等. 番茄植株再生体系的建立 [J]. 北方园艺, 2010(23):129-132.
[5]仇燕, 刘红霄, 杨松烨. 番茄高效再生体系的建立 [J]. 河北科技大学学报, 2012,33(1):83-88.
[6]宗宪春, 许向阳, 张贺, 等. 潘那利番茄叶片组织培养及植株再生研究 [J]. 东北农业大学学报, 2011,42(4):62-65.
[7]许飞云, 张赵男, 侯雨辰, 等. ‘黑珍珠番茄植株再生体系的研究 [J]. 中国农学通报, 2013, 29(10):144-149.
[8]何秀霞, 陆一鸣, 白杰英, 等. 番茄组织培养体系的建立及其影响因素的研究 [J]. 内蒙古民族大学学报:自然科学版, 2003, 18(1):30-33.
[9]王金杰, 王志英, 徐香玲. 影响番茄离体培养再生的主要因素探讨 [J]. 东北农业大学学报, 2009, 40(11):28-32.
[10]银利辉, 侯雷平, 王婷婷, 等. 番茄子叶再生相关因素的优化研究 [J]. 北方园艺, 2013(8):93-96.
[11]潘娟, 李先源, 李名杨. 植物组织培养过程中常见问题及解决方法 [J]. 安徽农业科学, 2009,37(6):2392-2394.
[12]陈强, 刘琰, 毕晓华. 番茄愈伤组织诱导和VC控制外植体褐变 [J]. 科技信息(学术研究), 2008(22):84-85.
[13]乔永旭. 番茄再生体系的建立 [J]. 北方园艺, 2010(17):174-176.
[14]崔雪艳, 董敬超. 红树莓海尔特兹初代培养中防止外植体褐化的研究 [J]. 现代农业科技, 2011(22):123-124.
[15]徐耀华, 杨春华, 刘晓波, 等. 扁穗牛鞭草组织培养中褐化控制技术初探 [J]. 草业科学, 2013, 30(2):212-217.
[16]曲雪艳, 周庆红. 樱桃番茄的组织培养与离体快繁技术研究 [J]. 江西农业大学学报, 2006,28(6):962-964.
[17]孙同虎, 孙秀玲, 薄鹏飞, 等. 番茄高效离体再生体系的建立 [J]. 安徽农业科学, 2006,34(24):6486-6487.
[18]Ibrahim I O, Memet V K, Ozgen E. Relation between explant age, total phenols and regeneration response in tissue cultured cotton (Gossypium hirsutum L.) [J]. African Journal of Biotechnology, 2007, 6(1): 3-8.
[19]王傲雪, 赵越, 陈秀玲, 等. 不同激素组合对番茄芽分化率的影响 [J]. 东北农业大学学报, 2013, 44(7):85-90.
[20]孙靖棣, 未晓巍, 蔡蕊, 等. 激素配比对不同基因型番茄再生体系的调控 [J]. 北方园艺, 2012(5):115-118.
[21]范锡麟, 王少岭, 肖应辉, 等. 番茄突变体jai1-1高效筛选——再生体系的建立 [J]. 作物研究, 2013, 27(3):224-228.
[22]李桂兰, 乔亚科, 武宝悦, 等. 番茄子叶离体培养中激素的优化 [J]. 河北农业大学学报, 2009,32(5):27-30.endprint
