桑青枯雷尔氏菌gsp G和gsp K基因的获取与生物信息学分析
2015-05-06禚苏孔卫青
禚苏++孔卫青

摘要: gsp G和gsp K参与青枯雷尔氏菌Ⅱ型分泌系统周质复合体的形成。本研究以桑青枯雷尔氏菌MR111为材料,利用PCR扩增和DNA测序技术成功获得其gsp G和gsp K基因438 bp和843 bp的序列,在线BLAST分析两个基因编码蛋白与其它青枯雷尔氏菌同源区域的相似性在90%以上。在线CDD分析两个蛋白除分别含有典型的T2SG和T2SK以及N端主要由亮氨酸和丙氨酸组成的分泌型信号肽外,gsp G还含Ⅳ型分泌系统的“Ⅳ_pilin_GFxxxE”结构,而在gsp K中则出现了重复的“GIQSTE”序列,该序列在雷尔氏菌属中高度保守。
关键词:桑树;青枯雷尔氏菌;Ⅱ型分泌系统;gsp基因
中图分类号:S432.4+2文献标识号:A文章编号:1001-4942(2015)03-0009-04
Acquisition and Bioinformatics Analysis of gsp G and gsp K Genes
of Ralstonia solanacearum from Mulberry
Zhuo Su, Kong Weiqing*
(College of Agriculture and Life Sciences, Ankang University/Key Sericultural Laboratory of Shaanxi, Ankang 725099, China)
Abstractgsp G and gsp K genes are involved in the formation of periplasmic complex of Ralstonia solanacearum type Ⅱ secretion system. The sequences of gsp G and gsp K genes of Ralstonia solanacearum strain MR111 with 438 bp and 843 bp in length respectively were obtained from mulberry by PCR amplication and DNA sequencing technology. By online BLAST analysis, the similarity of the 2 genes with the homologous genes from other R. solanacearum species were both over 90%. There were typical functional structure of T2SG and T2SK, and secretory signal peptide composed mainly by leucine and alanine in the N-end in the 2 genes, respectively. A type Ⅳ secretion system “Ⅳ_pilin_GFxxxE” structure was found in gsp G, and a repeat sequence “GIQSTE” was found in gsp K. This repeat sequence was highly conserved in R. solanacearum.
Key wordsMulberry; Ralstonia solanacearum; Type Ⅱ secretion system; gsp gene
植物病原细菌通过泌出毒性因子和各种酶类与寄主植物蛋白进行互作完成其侵染过程,并使寄主植物产生病斑、枯萎等病症[1]。目前病原细菌主要存在4种类型的分泌系统,Ⅰ型分泌系统主要分泌蛋白酶、毒素、脂肪酶等[2];Ⅲ型分泌系统通过干扰抑制植物防御反应、调节寄主细胞的生理过程,帮助其对寄主的侵染,这两种分泌系统均是直接将底物蛋白从细胞质分泌到胞外[3];Ⅳ型分泌系统被认为是接触依赖性系统,类似一个大的菌毛结构,横跨内外膜,使蛋白和大分子输出、靶定寄主细胞[4];Ⅱ型分泌系统则主要分泌淀粉酶、蛋白酶、纤维素酶以及细胞毒素等,降解植物细胞壁并产生大量的胞外多糖,使植株导管阻塞,植物体内水分的运输受到阻碍,或引起过高的静水力学压力,导致导管破裂,最终引起植株萎蔫[5]。
青枯雷尔氏菌(Ralstonia solanacearum)能单独存活于土壤并在其中繁殖,可以从次生根的根冠部位直接侵入植物,致病性、致病机理复杂[6]。由该菌引起的植物青枯病可危害大姜等多种植物,是一种危害严重的土传性细菌维管束病害[7]。青枯雷尔氏菌Ⅱ型分泌系统的中心由分泌途径转膜蛋白(general secretory pathway transmembrane protein,gsp)基因簇共12个蛋白gsp C~N组成,呈“致病岛”的形式排列在基因组上[8]。其中很多蛋白和Ⅳ型分泌系统的菌毛合成中的蛋白有明显的序列相似性,尤其gsp G、H、I、J和K 5个蛋白与菌毛蛋白有高相似性,被称为“类菌毛亚基”,这5个蛋白还可能在周质中形成复合体,与细菌的外膜孔直接接触,将蛋白泌出胞外[9]。本试验以桑青枯雷尔氏菌为研究对象,对其gsp G和gsp K基因及其特征进行分析研究,为细菌Ⅱ型分泌系统的结构和泌出机制的研究奠定基础。
1材料与方法
1.1试验材料
供试菌株:桑青枯雷尔氏菌MR111,由本实验室保存。
1.2基因组DNA的提取和gsp基因的扩增
桑青枯雷尔氏菌的培养在26℃下进行,使用TTC固体培养基对保存菌株进行活化,SPA液体培养基对挑取的单菌落过夜振荡培养[10]。后离心收集菌体,按细菌基因组DNA提取试剂盒(天根生化科技北京有限公司产品)说明提取培养的桑青枯雷尔氏菌的基因组DNA,并以此为模板,使用设计的基因扩增引物进行PCR扩增。引物序列分别为:gsp G的引物序列为GF:5′-ATGATGCAAGGCCAAC-3′;GR:5′- CATTGTCCCAGTTGCC-3′;gsp K的引物序列分别为KF:5′-CGGGGCTCTGACATGA-3′;KR:5′-CCGAGGGGTATTGTGCC-3′。PCR反应程序为:94℃预变性5 min;94℃变性30 s,55℃退火45 s,72℃延伸1 min,30个循环;72℃终延伸10 min。PCR扩增产物进行1.2%琼脂糖凝胶电泳和回收纯化,送上海生工武汉测序部进行测序。endprint
1.3gsp G和gsp K基因序列的生物信息学分析
NCBI在线BLAST对MR111的gsp G和gsp K基因编码蛋白序列进行比对;在线CDD预测基因编码蛋白的结构域;Target P1.1预测蛋白信号肽类型[11];NPS (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_compo.html)分析信号肽氨基酸组成。下载相关序列,Clustal X1.83软件进行蛋白多序列比对[12],BoxShade3.21(http://www.ch.embnet.org/software/BOX_form.html)对比对的序列文件进行描影和印刷。
2结果与分析
2.1gsp G和gsp K基因的获取
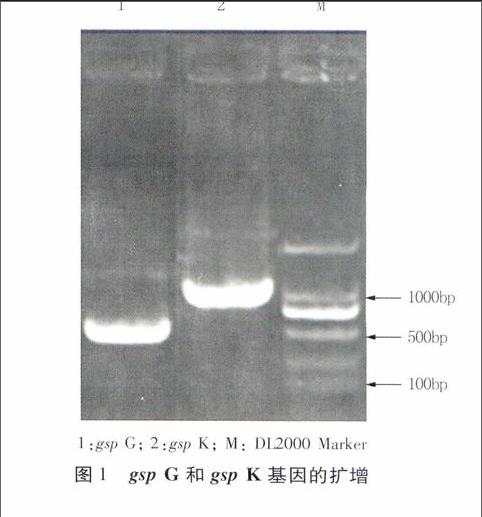
以提取的桑青枯雷尔氏菌MR111的基因组DNA为模板,2个引物对GF、GR和KF、KR分别进行PCR扩增gsp G和gsp K基因,1.2%琼脂糖凝胶电泳检测PCR扩增产物,结果分别在约500 bp和1 000 bp下方获得单一扩增条带(图1)。回收两条序列进行测序,结果获得gsp G基因自起始密码子下游34 bp的长438 bp的序列,和gsp K基因位于25~867 bp间843 bp的序列(GenBank登录号分别为KM115546、KM115547)。
2.2gsp G和gsp K基因编码蛋白的多序列比对与结构分析
NCBI在线BLASTP比对分析,gsp G基因编码蛋白的保守性较高,与其他来源青枯雷尔氏菌的同源区域的相似性在98%以上,与皮氏罗尔斯顿氏菌(Ralstonia pickettii)和雷尔氏菌(Ralstonia sp.)的相似性在95%以上,与伯克氏菌(Cupriavidus sp.)和伯克霍尔氏菌(Burkholderia sp.)的相似性也在90%左右。相比之下,gsp K蛋白的保守性稍差,其与其他来源青枯雷尔氏菌同源区域的相似性在90%以上,与皮氏罗尔斯顿氏菌和雷尔氏菌的相似性在80%左右,与伯克氏菌的相似性在70%以下,与伯克霍尔氏菌的相似性小于60%。获得的gsp G蛋白N末端含有N末端切割/甲基化域“Ⅳ_pilin_GFxxxE”结构,这与其它细菌中的研究一致[13],而对gsp K蛋白的比对发现,173~178氨基酸处含有一“GIQSTE”结构,该结构在雷尔氏菌属中普遍存在,但在本研究的MR111菌种中发现有2个重复(图2),是否对其功能有影响还需进一步的研究证明。
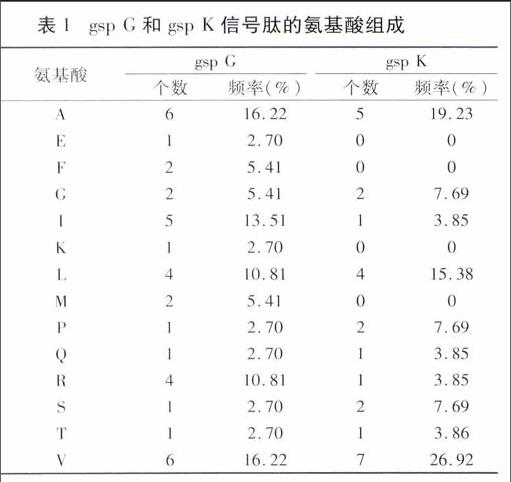
NCBI在线CDD预测基因编码蛋白结构域,结果见图3。gsp G编码蛋白含典型的、具有高度保守性的T2SG(pfam08334)结构,属于T2SG超家族成员;gsp K编码蛋白含T2SK(pfam03934)结构。同时经Target P1.1预测,gsp G和gsp K蛋白均含分泌型信号肽,切割位点分别位于37和26位氨基酸。NPS分析信号肽氨基酸组成(表1),结果显示2个信号肽均以疏水氨基酸缬氨酸(V)和丙氨酸(A)最多。
3讨论
Ⅰ型分泌系统广泛存在于人类、动物和植物的革兰氏阴性病原细菌中,是革兰氏阴性细菌的常规代谢途径,参与寄主植物防御反应的激活[5]。Ⅱ型分泌系统中基因的突变会造成许多蛋白如降解植物细胞壁不同成分的蛋白分泌的缺乏,也可使细菌的毒性减弱或丧失[8,14]。青枯雷尔氏菌是世界范围内重要的植物病原细菌,该菌通过Ⅱ型分泌系统分泌多种胞外毒性蛋白,降解植物细胞壁,并产生大量胞外多糖造成植物维管束阻塞,使寄主植物萎蔫,是研究植物病原细菌致病机制的一种模式菌[15]。本研究获得了桑青枯雷尔氏菌MR111的T2S的gsp G和gsp K基因,其编码蛋白均含有Ⅱ型分泌系统蛋白的功能结构域。除此之外,gsp G蛋白还含有Ⅳ型分泌系统N末端切割/甲基化域“Ⅳ_pilin_GFxxxE”结构,该结构又被称为菌毛蛋白的甲基化位点,首先在Ⅳ型分泌系统中发现,主要存在于细菌的丝状表面蛋白或菌毛的N末端,在疏水性苯丙氨酸或蛋氨酸发生甲基化后,形成成熟的亲水前导肽,其中的谷氨酸(E)是该结构必须的[13]。这也验证了Ⅱ型和Ⅳ型分泌系统存在结构上的一致性[16]。本研究发现gsp K蛋白的“GIQSTE”序列在雷尔氏菌属中非常保守,而在非雷尔氏菌属中存在较大差异,且在桑青枯雷尔氏菌MR111中发现了“GIQSTE”的重复序列,这在gsp K的同源基因研究中未见报道,其形成原因和是否具有功能变化有待进一步研究。
氨基酸组成是决定蛋白功能的重要指标。分析gsp G和gsp K两个基因编码蛋白的信号肽序列的氨基酸组成,分别有37和26个氨基酸,非极性氨基酸中以V、A和L最多,gsp G带正电荷的氨基酸以R最多,gsp K不带电荷的极性氨基酸以S最多。这与黄俊丽等[18]根据青枯雷尔氏菌基因组分析的分泌型信号肽的氨基酸组成中,分泌型信号肽的长度在15~55个氨基酸,非极性氨基酸中,残基W出现频率最低,A和L出现频率最高,带正电荷氨基酸R出现频率最高,不带电荷的极性氨基酸中,S出现频率最高等情况相似。BLAST在线分析和多序列比对显示,gsp G和gsp K与青枯雷尔氏菌同源区域的一致性最高,与皮氏罗尔斯顿氏菌和雷尔氏菌属的相似性次之,与伯克氏菌和伯克霍尔氏菌相似性最低,这与Bouley等[19]的研究认为T2S具有细菌种的专一性相一致。
参考文献:
[1] Bogdanove A J. Protein-protein interactions in pathogen recognition by plants[J]. Plant Mol. Biol., 2002, 50(6): 981-989.
[2]Koster M, Bitter W, Tommassen J. Protein secretion mechanisms in Gram-negative bacteria[J]. Int. J. Med. Microbiol., 2000, 290(4/5): 325-331.endprint
[3]Jin Q, Thilmony R, Zwiesler-Vollick J, et al. Type Ⅲ protein secretion in Pseudomonas syringae[J]. Microbes Infect., 2003, 5(4): 301-310.
[4]Backert S, Meyer T F. Type IV secretion systems and their effectors in bacterial pathogenesis[J]. Curr. Opin. Microbiol., 2006, 9(2):207-217.
[5]Sandkvist M. Type II secretion and pathogenesis[J]. Infect. Immun., 2001, 69(6): 3523-3535.
[6]Hayward A C. Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum[J]. Annual Review of Phytopathology, 1991, 29(1): 65-87.
[7]严金平, 泽桑梓, 张火云, 等. 姜细菌性青枯病病原菌及其防治研究进展[J]. 河南农业科学, 2004, 33(9): 63-65.
[8]Genin S, Boucher C. Ralstonia solanacearum: secrets of a major pathogen unveiled by analysis of its genome[J]. Mol. Plant Pathol., 2002, 3(3): 111-118.
[9]Douet V, Loiseau L, Barras F, et al. Systematic analysis by the yeast two-hybrid of protein interaction between components of the type II secretory machinery of Erwinia chrysanthemi[J]. Res. Microbiol., 2004, 155(2): 71-75.
[10]吕志强, 王汉荣, 周勤, 等. 浙江省桑树青枯病菌生理小种及生化型的测定[J]. 浙江农业学报, 2007, 19(4): 306-309.
[11]Emanuelsson O, Nielsen H, Brunak S, et al. Predicting subcellular localization of proteins based on their N-terminal amino acid sequence[J]. J. Mol. Biol., 2000, 300(4): 1005-1016.
[12]Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res., 1997, 25(24): 4876-4882.
[13]Peabody C R, Chung Y J, Yen M R, et al. Type II protein secretion and its relationship to bacterial type IV pili and archaeal flagella[J]. Microbiology, 2003, 149(11): 3051-3072.
[14]Genin S, Boucher C. Lessons learned from the genome analysis of Ralstonia solanacearum[J]. Annu. Rev. Phytopathol., 2004, 42(1): 107-134.
[15]刘波, 林营志, 朱育菁, 等. 青枯雷尔氏菌多态性研究[M]. 福州:福建科学技术出版社, 2005.
[16]Tosi T, Estrozi L F, Job V, et al. Structural similarity of secretins from type II and type III secretion systems[J]. Structure, 2014, 22(9): 1348-1355.
[17]刘雅婷, 李成云, 李永忠, 等. 应用计算机手段分析植物病原细菌Ralstonia solanacearum的蛋白质序列[J]. 云南农业大学学报, 2007, 22(4): 485-490.
[18]黄俊丽, 吴金钟, 肖崇刚, 等. 植物病原细菌Ralstonia solanacearum GMll000中分泌蛋白信号肽分析[J].遗传, 2007, 29(11): 1409-1416.
[19]Bouley J, Condemine G, Shevchik V E. The PDZ domain of OutC and the N-terminal region of OutD determine the secretion specificity of the type II out pathway of Erwinia chrysanthemi[J]. J. Mol. Biol., 2001, 308(2): 205-219.endprint
