鱼糜制品热凝胶形成机理研究进展
2015-05-05励建荣余永名仪淑敏马兴胜李学鹏邵俊花李婷婷夏文水
励建荣,余永名,仪淑敏,*,马兴胜,李学鹏,邵俊花,李婷婷,夏文水
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.江南大学食品学院,江苏无锡 214122;3.大连民族学院生命科学学院,辽宁大连 116600)
鱼糜制品热凝胶形成机理研究进展
励建荣1,2,*,余永名1,仪淑敏1,*,马兴胜1,李学鹏1,邵俊花1,李婷婷3,夏文水2
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.江南大学食品学院,江苏无锡 214122;3.大连民族学院生命科学学院,辽宁大连 116600)
凝胶特性是鱼糜制品的重要功能特性之一,是形成鱼糜制品独特的质构和感官的决定性因素。热凝胶是鱼糜凝胶化的主要途径之一,简单易行,被广泛采用。鱼糜热凝胶机理与鱼种、生长环境和热凝胶过程中的条件等有着密切的关系。本文从鱼糜的主要成分肌球蛋白和肌动球蛋白、化学作用力及外源添加物等角度对现已有的鱼糜热凝胶形成的主要作用机制进行归类综述,以期为鱼糜制品的研究与开发提供参考。
鱼糜制品,肌原纤维蛋白,化学作用力,热凝胶
鱼糜制品是以鱼肉为主要原料,制作成糊状,再经成形、蒸煮后制成的一种水产食品,市场上常见的鱼糜制品包括鱼丸、模拟蟹肉、鱼糕和鱼肉香肠等。
鱼糜制品的凝胶特性是硬度、伸缩性以及粘性的综合体现,主要取决于鱼糜中蛋白质胶凝的情况。鱼糜凝胶过程是鱼糜制品生产的关键工艺,决定鱼糜制品品质的优劣,只有经过充分凝胶的鱼糜制品才有较好的弹性和良好的口感。热凝胶的条件存在差异,会引起热凝胶特性好坏不一,对热凝胶的形成过程产生一定影响,因此探讨鱼糜凝胶机理对于鱼糜制品的生产和品质控制有极其重要的意义。本文旨在对现有的鱼糜制品热凝胶机理的研究作一个综述,为鱼种的选择,鱼糜制品凝胶过程中条件的控制,添加物的选择等改善凝胶性能的措施的选择提供参考,加深对鱼糜蛋白凝胶行为的认识,也为进一步对凝胶机理的研究提供切入点。
1 鱼肉蛋白的组成
鱼肉肌肉蛋白根据对溶剂的溶解性不同可分为盐溶性蛋白、水溶性蛋白和不溶性蛋白[1]。盐溶性蛋白是形成鱼糜凝胶网络的主要蛋白,肌原纤维蛋白是一类具有重要生物学功能特性的盐溶性结构蛋白群,主要包括肌球蛋白、肌动蛋白、原肌球蛋白、肌钙蛋白等。大量研究表明肌球蛋白是影响鱼糜制品凝胶性能的关键蛋白。
肌球蛋白占肌原纤维总蛋白的60%。在电子显微镜下观察其分子为形如“Y”型的长形不对称结构,由两条相同的长肽链组成α-螺旋尾部和两对短肽链组成两个球状头部[2-3],长约160 nm,分子量约480 kDa,长肽链和短肽链分别称重链(H链)和轻链(L链)。肌球蛋白头部具有ATPase结合位点和肌动蛋白结合位点,而肌球蛋白的溶解性和纤丝形成能力取决于螺旋尾部[4]。在一定条件下,胰凝乳蛋白酶能把肌球蛋白切成重酶解肌球蛋白(HMM)和轻酶解肌球蛋白(LMM)两部分,HMM包括肌球蛋白的头部和螺旋尾部的一部分,HMM又进一步分为肌球蛋白的头部(S-1区)和肌球蛋白尾部与头部相连的一部分(S-2区)。LMM是肌球蛋白大部分螺旋尾部,具有使肌球蛋白在生理条件下形成丝状的能力,它的结构在很大程度上决定了鱼肌肉蛋白质的凝胶形成特性。
2 热诱导凝胶的机理
食品蛋白凝胶形成包括变性和聚集,蛋白变性展开后蛋白质与蛋白质之间相互作用,聚集形成三维网状的空间结构。热诱导鱼糜形成凝胶的过程主要包括凝胶化、凝胶劣化和鱼糕化3个阶段。肌原纤维蛋白是参加凝胶形成的主要蛋白[5],而且鱼糜制品的弹性主要来自肌原纤维蛋白中的肌球蛋自和肌动球蛋白,在热的作用下蛋白的部分头部、连接处和尾部等部分展开,形成溶胶,并由溶胶向凝胶的转变,发生不可逆聚集,形成一定的网状结构[6-7],并且通过二硫键、氢键、疏水相互作用和离子键等化学作用力来维持[8]。
在凝胶化过程中除了不同蛋白质的参与外,蛋白质之间的各种作用力也起到了关键的作用。
2.1 蛋白质作用
2.1.1 肌球蛋白的作用 早年我国相关学者对凝胶形成的过程持两种观点[9-10],一种是:经加热后肌球蛋白和肌动蛋白溶出,相互缠绕重新合成肌动球蛋白,且网络结构随之形成,并将游离水锁于网络结构,凝胶化完成。另一种是:鱼糜中的肌球蛋白和肌动球蛋白游离并呈分离状态,当加热到43 ℃后,游离的肌球蛋白间发生聚集反应,在55 ℃左右时,游离肌球蛋白分子尾部与肌动球蛋白中肌球蛋白分子尾部间形成架桥,60~70 ℃时,网络结构形成,凝胶化完成。国外学者Sharp和Offer[11]认为肌球蛋白分子凝胶形成的基本机制为肌球蛋白分子的头-头凝集、头-尾凝集和尾-尾凝集。
对于肌球蛋白对鱼糜凝胶的作用机理,相关学者主要是从肌球蛋白、LMM和HMM结构的改变和聚集进行了研究,表现出来的性能和结构的改变呈一定相关性。
Reed 等研究罗非鱼肌球蛋白的热物理特性时发现肌球蛋白、LMM和HMM 在40 ℃发生聚集[12]。Ding的研究发现肌球蛋白在40~45 ℃表现出热稳定性和聚集能力,肌球蛋白充分变性和聚集后能形成良好的凝胶[13]。
Tomoyuki等测得明太鱼肌球蛋白和LMM中α-折叠含量随着温度的上升而下降,HMM中α-折叠含量变化较小,表明肌球蛋白分子在热诱导的情况下α-折叠含量的下降主要是由于其LMM区域的α-折叠含量的下降,而LMM不能单独聚集,但在40 ℃下10分钟后它能与肌球蛋白形成沉淀,而HMM则不能;结果表明肌球蛋白之间形成凝胶是LMM之间的交联[14]。鳕鱼和鲱鱼鱼糜热凝胶发生加热的开始阶段,先是位于S-2区的肌球蛋白头部与部分螺旋形尾部相连的部分肽链解离,并与相邻排列的其他肌球蛋白S-2区相互连接;随着温度的上升,发生相互链接的肌球蛋白凝集体通过LMM螺旋形尾部的结构进一步凝集成较大的蛋白聚集体,最终形成三维网络结构,从而达到凝胶的目的[15]。Sano等[16]发现凝胶形成开始时LMM部分肽链首先发生解螺旋,然后与相邻的其他肌球蛋白LMM部分发生交联形成调节肌球蛋白分子,调节肌球蛋白分子再与相邻的其他肌球蛋白头部和尾部的螺旋结构相互凝集形成更大的蛋白质颗粒,最后进一步形成凝胶网络结构。
Foegeding等[17]发现肌球蛋白由30 ℃加热到70 ℃,使其超螺旋α-螺旋尾部肽链发生持续的解离变性。解离后的肌球蛋白相互之间按一定顺序重新排列,连接形成一定的网络结构,逐渐扩大成较大的三维网络结构。结果表明,最后形成的凝胶强度与肌球蛋白超螺旋α-螺旋尾部的变性程度呈一定的正相关性。
2.1.2 肌动球蛋白的作用 在热诱导凝胶过程中,与肌球蛋白凝胶形成中α-螺旋的解离、二硫键和疏水相互作用的形成一样,肌动球蛋白中也同样存在着[18]。
鱼种的不同,肌动球蛋白凝胶发生的温度范围不一致,来源于鳡鱼和草鱼中的肌动球蛋白在10~45 ℃之间的热凝胶特性存在显著的不同[19],鳡鱼中的肌动球蛋白的热稳定性比肌球蛋白更高[13]。有研究表明当溶液中的肌动球蛋白和肌球蛋白质量比为1∶15时,蛋白质体系的凝胶形成能力最强,此时体系中肌动球蛋白复合体占总蛋白体积分数的14%左右,其余为游离状态的肌球蛋白;当两者比例增加时,凝胶形成能力下降。如果肌球蛋白变性,肌动蛋白对其凝胶的影响将会降低。如果在加热处理条件之前在蛋白质混合体系中加入蛋白质解离剂,将不会产生影响[20]。
2.2 化学作用力
2.2.1 二硫键 在高温加热条件下(蒸煮温度大于40 ℃),二硫键被认为是对蛋白质凝胶形成最主要的共价键。分子间的二硫键的形成是O2条件下通过相邻肽链上两个半胱氨酸分子之间的氧化,是巯基基团的反应:
通过添加氧化剂鱼糜凝胶强度得到加强,如:在凝胶形成的时候加入巯基乙醇[20]能加速巯基基团的氧化。如果分子间基团起主导作用的分别是半胱氨酸或游离的巯基基团和添加的半胱氨酸和胱氨酸,能够促进分子内二硫键向分子间二硫键轨迹移动。如果加入还原物质能阻碍二硫键的生成,如二硫苏糖醇,这对最终的凝胶特性会产生影响[21]。尽管共价键的形成通常被认为是不可逆的,加热能影响蛋白质内部的硫醇等基团的暴露[22],加热过程中形成的二硫键是鱼肉肌原纤维蛋白热诱导凝胶形成的主要化学键,当共价键一旦形成,很难被破坏,如果蛋白分子内含有大量的胱氨酸或活性巯基,添加半胱氨酸或胱氨酸后,可促进分子内二硫键向分子间二硫键的转化。
二硫键的生成可能发生在鱼糜凝胶形成的不同阶段,在不同的温度范围内也有可能形成,且对鱼糜凝胶特性产生一定的影响,可能鱼种有关,如箭齿鲽鱼、鲤鱼、白鲢鱼和明太鱼二硫键形成分别在20~30、30~50、70~80和80 ℃以上的凝胶化过程中形成[23-26],但二硫键对鱼糜制品凝胶的形成产生的影响是公认的。
2.2.2 氢键 氢键是弱偶极键,主要通过大量的数目起作用而不是单个键的强度。氢键在鱼糜制品冷却和老化过程起稳定结合水、增加凝胶强度作用。加热期间,肽骨架中的羰基和酰胺基之间用于维持蛋白质空间结构的大量氢键被破坏,使得多肽链更易于发生广泛的水合作用,减少水分子的移动性。裸露的多肽链的水合作用就成为影响蛋白质与蛋白质聚集凝胶保水性的重要因素。
冷却促进了蛋白间更多氢键的形成,导致凝胶强度增大。氨基酸中的氢键也能稳定单个蛋白质分子在水中的二级结构。天然的和部分变性蛋白质的α-螺旋和β-折叠结构在加热和冷却过程中通过形成氢键得到稳定,当鱼糜中蛋白质分子在高温加热条件下发生变性时,氢键发生断裂,蛋白质结构中的α-螺旋结构解旋,而当温度下降之后,将重新形成氢键,有助于稳定蛋白质构象[27]。有研究发现阿拉斯加鳕鱼鱼糜凝胶中水分和蛋白结构改变时发现凝胶形成后蛋白质二级结构发生的改变主要是α-螺旋向β-折叠转变,并通过氢键重新排列,最后形成致密的三维网状结构[28]。
2.2.3 疏水相互作用 与氢键相反,疏水相互作用依赖于加热,可以通过加热被增强,温度至少要接近60 ℃。当蛋白质表面暴露于水中,蛋白质分散和溶解,其热力学反应表明分子间和分子内部疏水相互作用的形成。折叠的蛋白质链内部疏水氨基酸的密度很大。相反地,折叠蛋白质表面的氨基酸有极大地亲水性。因此,折叠的蛋白质在水中能获得热力学上的动态平衡。
热作用下蛋白质舒展,疏水中心暴露于水中,水分子靠近疏水基团变成定向的氢键包合物。这种定向有序的结构能减少水分子的流动性。因此,系统的自由度降低,熵降低。使暴露于水中的最小化,创造一个热动力学上的稳定系统,蛋白质疏水部分与其他疏水部分紧密结合。相邻蛋白质的疏水部分的结合能减少系统熵值,导致蛋白质之间通过疏水相互作用更有效的结合和蛋白质之间的聚集以及凝胶网络的形成[29]。
有研究表明热凝胶过程中,肌球蛋白尾部变性时被包埋的疏水基团暴露出来,产生疏水相互作用并减少自由能,从而使肌球蛋白的尾部发生聚集形成凝胶,表明疏水性参与了凝胶形成[30]。肌球蛋白高的表面疏水性与其高度聚集和储藏模量有关,说明凝胶的形成有分子内部的疏水相互作用参与。蛋白质受热后,包埋的非极性多肽暴露出来增强了附近多肽非极性片段的疏水相互作用,进一步说明疏水相互作用会影响凝胶的形成过程[31]。
2.2.4 离子键 离子键是蛋白质带异种电荷位置之间的吸引力,影响蛋白质分子间以及蛋白质分子与溶剂之间的相互作用[32]。在鱼糜的正常pH下,肽链上的谷氨酸和天冬氨酸的羧基带负点,而赖氨酸和精氨酸的NH2+基团带正电,这些基团间将形成离子吸引力,称之为盐桥。在水中肌原纤维蛋白相互之间连接形成的聚集不能溶解,肌球蛋白的粗丝中离子(静电)相互作用被认为是最重要的作用力;盐的添加会干扰静电相互作用,导致粗丝的分解和肌球蛋白或肌动球蛋白的分散。

从鱼糜形成凝胶,盐(通常为氯化钠)必须被添加以便破坏离子键和帮助蛋白质的分解;蛋白质的解离对于热凝胶的弹性结构的形成是必需的。在蛋白质的表面,盐离子选择性地结合暴露的带相反电荷的基团。水能溶解蛋白质是因为肌球蛋白分子间的离子键断开,它们与水的吸引力增加。然而,盐的添加必须伴随着充足的研磨和粉碎以便增加蛋白质的溶解和分散。
pH和离子强度可以影响蛋白质中氨基酸残基的解离状态和电荷分布,改变蛋白分子之间的静电相互作用,从而对蛋白凝胶形成产生影响[33-34]。离子键多与无机盐共同作用于鱼糜凝胶,通过离子键加强蛋白质之间的交联,从而增强凝胶强度[35-36]。如鱼糜的正常pH下肌原纤维蛋白净电荷呈负电性,带正二价的钙离子在相邻的蛋白质之间结合负电基团能够形成离子键,有助于增加鱼糜凝胶的强度。
蛋白质体系在等电点(pI)时净电荷为零。当体系pH接近pI时,静电斥力几乎为零,在这种条件下蛋白质分子会相互聚集形成网状凝胶结构。当体系pH远离pI时,因蛋白质中存在较高的净负电荷而使静电斥力占主导,从而蛋白质分子不会发生分子聚集。当体系的pH处于pI和极端pH之间时,静电斥力和疏水相互作用能达到平衡,蛋白分子会再发生聚集形成凝胶网络。因此在水产品实际生产加工过程中,要获得凝胶弹性较好的鱼糜凝胶,pH需要偏离pI,使体系的pH处于pI和极端pH的中间,将pH控制在6.0~8.0之间[37]。
3 添加物的作用
3.1 增稠剂和多酚类
膳食纤维、淀粉、明胶、琼脂等大分子增稠剂,由于这些物质本身可以形成较强的凝胶体,在鱼糜凝胶化过程中依添加量不同对凝胶起到不同的加强作用。
通过动态流变性分析添加6%膳食纤维的阿拉斯加鳕鱼鱼糜凝胶特性有较大程度的提高,膳食纤维主要通过固定水份,再利用化学作用力将蛋白质连接后起到改善凝胶的目的[38]。淀粉作为一种被广泛使用在食品工业中的植物多糖,是鱼糜和鱼糜制品加工中常用的填充剂,起到改善鱼糜制品的凝胶特性及降低成本的目的。
多酚类物质可以用作凝胶增强剂以提高鱼糜的凝胶特性,它与蛋白质交联形成稳定的网络结构,如海藻中的植物多酚、茶多酚等[39-40]。
3.2 无机盐类
无机盐类也是一类常用于鱼糜制品中的添加剂,如在擂溃过程中必须添加食盐,以NaCl破坏离子键,促进蛋白质均匀分散,以便重新组合形成凝胶,Na+和Cl-可选择性地与蛋白质表面的电荷相结合,肌原纤维蛋白分子间的离子键遭到破坏,蛋白质对水的亲和力增加,蛋白质溶解度增大,从而有利于良好凝胶的形成。除此之外,叶蕾蕾等人同时研究了多种金属离子对鲢鱼鱼糜的凝胶特性的影响,在适当范围内都能不同程度地提高其凝胶特性[41],多数离子是通过盐桥的方式起作用[33]。而钙离子在鱼肉蛋白凝胶过程中能激活谷氨酰胺转氨酶,然后催化谷氨酸残基中的γ-羧基酰胺基团与其他氨基酸残基发生交联作用,通过共价键形成更牢固的网状结构[42]。
3.3 非肌肉蛋白类
非肌肉蛋白类在鱼糜中应用十分广泛,使用较多的有面筋蛋白、蛋清蛋白、乳清浓缩蛋白、大豆分离蛋白和一些动物血浆蛋白等。不同非肌肉蛋白影响鱼糜凝胶作用的机理是不同的,动物血浆蛋白主要是通过抑制蛋白酶的活性来改善鱼糜的凝胶特性[43],而蛋清蛋白[45]、乳清浓缩蛋白[45]和大豆分离蛋白[46]则是通过自身的凝胶作用来提高鱼糜的凝胶特性的。
3.4 酶的交联
谷氨酰胺转氨酶(TGase)是一种催化酰基转移反应的转移酶,根据酰基受体不同,可以催化以下三种类型的反应,如图1所示[47-48]。
(1)催化蛋白质以及肽键中谷酰胺残基的γ-羧酰胺基和伯胺之间的酰氨基转移反应。
(2)当蛋白质中赖氨酸残基的ε-氨基作为酰基受体时,形成蛋白质分子内或分子间的于ε-(γ-谷氨酰胺)赖氨酸共价交联键,使蛋白质分子发生交联。
(3)当不存在伯胺时,水会成为酰基受体,其结果是谷氨酰胺残基脱去氨基生成谷氨酸残基。
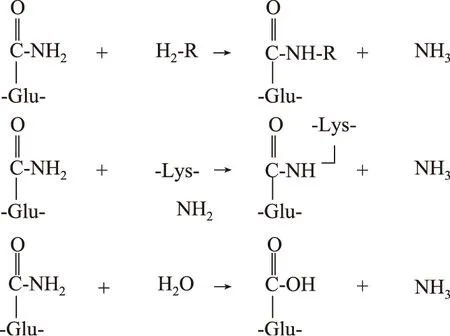
图1 谷氨酰胺转氨酶催化反应Fig.1 Transglutaminase-catalysed reactions
大量研究表明添加有谷氨酰胺转氨酶的鱼糜经热凝胶处理后,明显比不添加TGase的鱼糜凝胶要好[49],其凝胶强度随着添加量的增加而逐渐增加,蛋白分子间共价交联程度逐渐增加,其凝胶微观结构更加致密[50-53],这可能主要与形成了ε-(γ-谷氨酰胺)赖氨酸的交联结构相关[54]。
3.5 其他物质
李婷婷等[55]研究发现添加大蒜提取物的鱼丸凝胶特性高于对照组,随着贮藏期的延长凝胶性能下降较对照组缓慢,可能是因为大蒜提取物中的抗氧化物质对肌原纤维蛋白起到保护作用。朱佳琳等[56]通过添加含有丝氨酸蛋白酶抑制剂(SPI)的食源性物料鱼籽可以起到改善凝胶特性的目的,主要是因为SPI抑制丝氨酸蛋白酶的活性,减少了鱼糜的凝胶裂化。
4 结论与展望
总结相关学者多年的研究成果,鱼糜热凝胶形成机理主要由于鱼糜肌球蛋白构象的改变形成三维空间网络结构,在一定的条件下肌动球蛋白也起到增强凝胶特性的作用,在蛋白质构象的变化过程二硫键和疏水相互作用起到主要作用,疏水相互作用是肌球蛋白蛋白质交联的主要原因,蛋白质分子内部的巯基通过加热作用暴露进而促进二硫键的形成和交换,网络结构也因此而得到加强。冷却可使氢键形成,有助于稳定蛋白质构象,起到增强凝胶特性的作用;离子键在一定条件下起到作用,如特定pH和与无机盐的共同作用。除此之外,外源添加物的添加主要起到协同的作用。
由于研究鱼类的多样性,现阶段各种机理可能仅对某一种或一类鱼适宜,各机理都有待进一步发展和完善。深入对凝胶形成机理的研究,对高质量鱼糜制品的生产可起到促进作用。对鱼糜制品凝胶特性的研究需要材料科学、酶学、生物化学、食品分析、食品工艺等专业的协同配合,使其具有更好的经济性与实用性,再加上良好的可操作性,才能实现理论与实际的结合,最终在生产应用中得到推广[57]。
[1]王锡昌,汪之和. 鱼糜制品加工技术[M]. 北京:中国轻工业出版社,1997:17-22.
[2]Hodge T,Jamie M,Cope T V. A myosin family tree[J]. Journal of Cell Science,2000,113(19):3353-3354.
[3]舒适,刘爱校,刘国琴,等. 肌球蛋白研究进展[J]. 生命的化学,1999,19(2):65-68.
[4]Sano T,Noguchi S F,Matsumoto J J,et al. Thermal gelation characteristics of myosin subfragments[J]. Journal of Food Science,1990,55(1):55-58.
[5]Zhang L,Xue Y,Xu J,et al. Effects of high-temperature treatment(≥100℃)on Alaska Pollock(Theragra chalcogramma)surimi gels[J]. Journal of Food Engineering,2013,115(1):115-120.
[6]Yongsawatdigul J,Park J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chemistry,2003,83(3):409-416.
[7]Sun X D,Holley R A. Factors influencing gel formation by myofibrillar proteins in muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety,2011,10(1):33-51.
[8]Ko W C,Yu C C,Hsu K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. LWT-Food Science and Technology,2007,40(8):1316-1320.
[9]高建峰. 鱼糜制品的加工理论及方法[J]. 食品科技,1994(4):22-23.
[10]王靖国. 鱼糜制品及其加工技术[J]. 食品工业,1993(1):14-15.
[11]Sharp A,Offer G. The mechanism of formation of gels from myosin molecules[J]. Journal of the Science of Food and Agriculture,1992,58(1):63-73.
[12]Reed Z H,Park J W. Thermophysical Characterization of tilapia myosin and its subfragments[J]. Journal of Food Science,2011,76(7):1050-1055.
[13]Ding Y,Liu R,Rong J,et al. Heat-induced denaturation and aggregation of actomyosin and myosin from yellowcheek carp during setting[J]. Food Chemistry,2014,149(1):237-243.
[14]Tomoyuki H,Takao O,Kiyoyoshi N. Heat-induced structural changes and aggregation of walleye pollack myosin in the light meromyosin region[J]. Fisheries Science,2002,68(5):1145-1150.
[15]Chan J K,Gill T A,Paulson A T. Thermal aggregation of myosin subfragments from cod and herring[J]. Journal of Food Science,1993,58(5):1057-1061.
[16]Sano T,Noguchi S F,Matsumoto J J,et al. Thermal gelation characteristics of myosin subfragments[J]. Journal of Food Science,1990,55(1):55-58.
[17]Foegeding E A,Dayton W R,Allen C E. Interaction of myosin fibrinogen to form protein gels[J]. Journal of Food Science,1986,51(1):280-285.
[18]Hemung B O,Yongsawatdigul J. Ca2+affects physicochemical and conformational changes of threadfin bream myosin and actin in a setting model[J]. Journal of Food Science,2005,70(8):455-460.
[19]Ding Y,Liu R,Rong J, et al. Rheological behavior of heat-induced actomyosin gels from yellowcheek carp and grass carp[J]. European Food Research and Technology,2012,235(2):245-251.
[20]Yasui T,Yazawa Y,Takahashi K, et al. Thermostability of light meromyosin[J]. Agricultural and Biological Chemistry,1971,35(8):1236-1240.
[21]Smith D M. Factors influencing texture formation in comminuted meats[J]. Proceedings-Annual Reciprocal Meat Conference of the American Meat Science Association,1998,41(1):48-52.
[22]Zhu Z,Lanier T C,Farkas B E,et al. Transglutaminase and high pressure effects on heat-induced gelation of Alaska pollock(Theragra chalcogramma)surimi[J]. Journal of Food Engineering,2014,131(1):154-160.
[23]Visessanguan W,Ogawa M,Nakai S,et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural and Food Chemistry,2000,48(4):1016-1023.
[24]Sano T,Ohno T,Otsuka-Fuchino H,et al. Carp natural actomyosin:Thermal denaturation mechanism[J]. Journal of Food Science,1994,59(5):1002-1008.
[25]Liu R,Zhao S M,Xie B J,et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids,2011,25(5):898-906.
[26]Hossain M I,Itoh Y,Morioka K,et al. Contribution of the polymerization of protein by disulfide bonding to increased gel strength of walleye pollack surimi gel with preheating time[J]. Fisheries Science,2001,67(4):710-717.
[27]李杰. 草鱼鱼糜凝胶及其机理的研究[D]. 上海:上海海洋大学,2011.
[28]Sánchez-González I,Carmona P,Moreno P,et al. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman spectroscopy[J]. Food Chemistry,2008,106(1):56-64.
[29]陈舜胜,王锡昌,周丽萍,等. 冰藏鲢的鲜度变化对其鱼糜凝胶作用的影响[J]. 上海水产大学学报,2000,9(1):45-50.
[30]Benjakul S,Visessanguan W,Srivilai C. Porcine plasma protein as proteinase inhibitor in bigeye snapper(Priacanthus tayenus)muscle and surimi[J]. Journal of the Science of Food and Agrieclture,2001,10(81):1039-1046.
[31]Relkin P. Reversibility of heat-induced conformational changes and surface exposed hydrophobic clusters ofβ-lactoglobulin:their role in heat-induced sol-gel state transition[J]. International Journal of Biological Macromolecules,1998,22(1):59-66.
[32]Phillips L G. Structure-function properties of food proteins[M]. USA:Academic Press,2013:1-271.
[33]Totosaus A,Montejano J G,Salazar J A,et al. A review of physical and chemical protein induction[J]. International Journal of Food Science and Technology,2002,37(6):589-601.
[34]董秋颖,杨玉玲,许婷. 从质构学角度研究肌原纤维蛋白凝胶形成的作用力[J]. 食品发酵与工业,2009,35(5):45-49.
[35]Arfat Y A,Benjakul S. Gel strengthening effect of zinc salts in surimi from yellow stripe trevally[J]. Food Bioscience,2013,3(1):1-9.
[36]Arfat Y A,Benjakul S. Effect of zinc sulphate on gelling properties of phosphorylated protein isolate from yellow stripe trevally[J]. Food Chemistry,2013,141(3):2848-2857.
[37]刘海梅. 鲢鱼糜凝胶及形成机理的研究[D]. 武汉:华中农业大学,2007.
[38]Debusca A,Tahergorabi R,Beamer S K,et al. Physicochemical properties of surimi gels fortified with dietary fiber[J]. Food Chemistry,2014,148(1):70-76.
[39]Shitole S S,Balange A K,Gangan S S. Use of seaweed(Sargassum tenerrimum)extract as gel enhancer for lesser sardine(Sardinella brachiosoma)surimi[J]. International Aquatic Research,2014,6(1):1-11.
[40]吕卫金,赵进,汪金林,等. 茶多酚延缓冷藏大黄鱼肌原纤维蛋白变性降解机理研究[J]. 中国食品学报,2014,14(1):60-67.
[41]叶蕾蕾,吴晨曦,刘茹,等. 阳离子种类和添加量对鲢鱼糜凝胶力学特性的影响[J]. 食品安全质量检测学报,2014,5(8):2319-2326.
[42]李艳青,孔保华,夏秀芳. 鱼糜凝胶形成机理及提高鱼糜凝胶特性的添加物研究新进展[J]. 食品科技,2012,37(7):140-144.
[43]雷雨,夏文水,姜启兴,等. 猪血浆蛋白对鲢鱼鱼糜品质的影响[J]. 食品工业科技,2014,35(14):103-106.
[45]Rawdkuen S,Benjakul S. Whey protein concentrate:Autolysis inhibition and effects on the gel properties of surimi prepared from tropical fish[J]. Food Chemistry,2008,106(3):1077-1084.
[46]Ali J. A comparative study on effect of egg white,soy protein isolate and potato starch on functional properties of Common Carp(Cyprinus carpio)surimi gel[J]. Food Processing & Technology,2012,3(11):1-6.
[47]Zhu Y,Rinzema A,Tramper J,et al. Microbial transglutaminase-a review of its production and application in food processing[J]. Applied Microbiology and Biotechnology,1995,44(3-4):277-282.
[48]Motoki M,Seguro K. Transglutaminase and its use for food processing[J]. Trends in Food Science & Technology,1998,9(5):204-210.
[49]Duangmal K,Taluengphol A. Effect of protein additives,sodium ascorbate,and microbial transglutaminase on the texture and colour of red tilapia surimi gel[J]. International Journal of Food Science & Technology,2010,45(1):48-55.
[50]Wang Y,Liu A,Ye R,et al. Transglutaminase-induced crosslinking of gelatin-calcium carbonate composite films[J]. Food Chemistry,2015,166(1):414-422.
[51]Chanarat S,Benjakul S,Xiong Y. Nonprotein Nitrogenous Compounds and Gelling Property of Whitecheek Shark(Carcharhinus Dussumieri)Mince as Affected by Washing and Microbial Transglutaminase[J]. Journal of Texture Studies,2014,45(4):307-316.
[52]Herranz B,Tovar C A,Borderias A J,et al. Effect of high-pressure and/or microbial transglutaminase on physicochemical,rheological and microstructural properties of flying fish surimi[J].Innovative Food Science and Emerging Technologies,2013,20(1):24-33.
[53]Moreno H M,Cardoso C,Solas M T,et al. Improvement of cold and thermally induced gelation of giant squid(Dosidicus gigas)surimi[J]. Journal of Aquatic Food Product Technology,2009,18(4):312-330.
[54]Kaewudom P,Benjakuln S,Kijroongrojana K. Properties of surimi gel as influenced by fish gelatin and microbial transglutaminase[J]. Food Bioscience,2013,1(1):39-47.
[55]李婷婷,张旭光,励建荣,等. 大蒜提取物对冷藏蔬菜鱼丸品质的影响[J]. 食品科学,2012,33(16):280-285.
[56]朱佳琳,黄建联,范大明,等. 食源性蛋白酶抑制物的筛选及对白鲢鱼糜凝胶特性的影响[J]. 食品工业科技,2014,35(19):79-83.
[57]励建荣,陆海霞,傅玉颖,等. 鱼糜制品凝胶特性研究进展[J]. 食品工业科技,2008,29(11):291-295.
Research of progress in thermal gelation mechanisms of surimi products
LI Jian-rong1,2,*,YU Yong-ming1,YI Shu-min1,*,MA Xing-sheng1,LI Xue-peng1,SHAO Jun-hua1,LI Ting-ting3,XIA Wen-shui2
(1.College of Food Science and Technology,Bohai University;Food Safety Key Lab of Liaoning Province;National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products;Jinzhou121013,China;2.College of Food,Jiangnan University,Wuxi214122,China;3.College of Life Science,Dalian Nationality of University,Dalian116600,China)
The gel properties is one of the important features of surimi products,which could affect it’s texture,emulsion and sensory characteristics. Heat-induced gel is one of the main ways of surimi gel,widely used and simple. Mechanism of heat-induced gel is closely related to the species,growth environment and conditions of thermal gel process. In order to provide references for the research and development of surimi products,the existing several major theoretical mechanisms of thermal gel formation are classified from the perspective of myosin and actomyosin,chemical forces and exogenous additivesin this paper.
surimi products;myofibril;chemical force;thermal gel
2015-02-09
励建荣(1964-),男,博士,教授,主要从事水产品贮藏加工及安全控制方面的研究,E-mail:lijr6491@163.com。
*通讯作者:仪淑敏(1980-),女,博士,副教授,主要从事水产品贮藏加工及质量安全控制方面的研究,E-mail:yishumin@163.com。
国家自然基金(31301418,31301569);“十二五”国家科技支撑计划课题(2012BAD29B06)。
TS254.1
A
1002-0306(2015)23-0380-06
10.13386/j.issn1002-0306.2015.23.071
