反油酸和反异油酸对人脐静脉内皮细胞炎症反应的影响
2015-05-05文晓东刘本欣邓泽元范亚苇
文晓东,刘本欣,邓泽元,范亚苇,李 静
(南昌大学食品科学与技术国家重点实验室,江西南昌 330057)
反油酸和反异油酸对人脐静脉内皮细胞炎症反应的影响
文晓东,刘本欣,邓泽元,范亚苇,李 静*
(南昌大学食品科学与技术国家重点实验室,江西南昌 330057)
比较反油酸(9t18∶1)和反异油酸(11t18∶1)对内皮细胞炎症反应的影响。用不同浓度的反油酸(9t18∶1)和反异油酸(11t18∶1)作用人脐静脉内皮细胞(HUVEC),观察其对细胞存活率、细胞形态学、氧化酶活(SOD、MDA)、LDH渗出率、一氧化氮量和NOS活力的影响。结果表明9t18∶1和11t18∶1均能降低细胞存活率,在100 μmol/L时,9t18∶1对内皮细胞存活率的抑制作用显著强于11t18∶1;两种反式脂肪酸均导致内皮细胞形态发生变化,细胞由正常的梭形变为圆形,而且边缘呈粗糙状态;9t18∶1和11t18∶1均能够造成内皮细胞LDH渗出率和胞内MDA含量的显著升高,但11t18∶1组明显低于同浓度9t18∶1组;两种反式脂肪酸均能够降低HUVEC 细胞NO分泌量和NOS、SOD活力,且11t18∶1的降低作用低于同浓度9t18∶1组。此外,9t18∶1和11t18∶1均可提高ICAM、VCAM、IL-6 mRNA表达量,且前者显著高于后者。总的来说,这两种反式脂肪酸对内皮细胞都有一定致炎症作用,但9t18∶1强于11t18∶1。
反油酸,反异油酸,内皮细胞损伤
血管疾病在中国成为导致死亡的首要诱因,研究表明通过膳食调节特别是膳食脂肪调节可以降低血管疾病的发病率。流行病学和临床研究发现,反式脂肪酸(Trans fatty acids,TFAs)的摄入与血管疾病的发病率呈正相关性,TFA能改变人体的血脂组成、干扰人体正常的脂质代谢,并且TFA能够刺激系统炎症反应从而诱导内皮细胞的损伤和凋亡[1],TFA能增加内皮功能障碍过程中的循环生物标记物[2],同时降低动脉扩张依赖物一氧化氮的分泌[3],进一步促进心血管疾病的发生。
反式脂肪酸是一类含有一个或多个非共轭反式双键的脂肪酸,主要分为工业反式脂肪酸(Industrial trans fatty acids,I-TFA,主要的反式异构体是9t18∶1)和反刍动物反式脂肪酸(Ruminant trans fatty acids,R-TFA,主要的反式异构体是11t18∶1)[4]。流行病学和临床研究表明R-TFA和I-TFA对健康的影响存在差异,R-TFA与血管疾病呈正相关或者无相关性,而I-TFA则与血管疾病呈负相关[5-7]。但是它们对血管内皮细胞功能影响的差异研究甚少。因此,本课题拟通过血管内皮细胞功能研究了解R-TFA(11t18∶1)和I-TFA(9t18∶1)对血管内皮细胞炎症反应的差异,通过检测内皮细胞存活率,形态变化,乳酸脱氢酶(LDH)溶出率,一氧化氮合酶(NOS)活力,一氧化氮(NO)分泌量、超氧化物歧化酶(SOD)酶活,丙二醛(MDA)含量,细胞炎症因子ICAM-1、VCAM-1、IL-6的变化,探讨两种TFA对内皮细胞功能影响的差异,完善对TFA安全性的认识,对调整我国居民膳食结构,提高健康水平具有重要意义。
1 材料与方法
1.1 材料与仪器
人脐静脉内皮细胞株 南昌大学高等研究院;反油酸、反异油酸标品 美国Sigma公司;新生牛血清 杭州四季青生物工程材料有限公司;DMEM完全培养基 美国Gbico 公司;谷氨酰胺、青霉素链霉素混合液、胰蛋白酶、噻唑兰(MTT) 北京Solarbio公司;磷酸缓冲盐(PBS)粉剂(pH7.2~7.4) 北京中杉金桥生物技术有限公司;鬼笔环肽-FITC染液、DAPI染液、免疫染色洗涤液、免疫染色通透液、抗荧光猝灭封片液、免疫染色固定液 碧云天生物技术研究所;一氧化氮(NO)测定试剂盒、一氧化氮合酶(NOS)测定试剂盒、乳酸脱氢酶(LDH)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒 南京建成生物工程研究所;荧光定量PCR试剂盒 Takara公司;RNAiso Takara公司。
CPST 200型CO2恒湿恒温培养箱 长沙长锦科技有限公司;BHC-1300IIA/B3型生物安全柜 苏州安泰空气技术有限公司;37XC(XDS-1A)倒置显微镜 上海蔡康光学仪器公司;BD-86L低温冰箱 香港力康公司;Neofuge 15R台式高速冷冻离心机 力康发展有限公司;Multiskan MK3型酶标仪 赛默飞世尔(上海仪器有限公司;激光共聚焦显微镜 卡尔蔡司公司;DSX-280 B不锈钢手提式灭菌器 上海申安医疗器械厂;JY-86-2-50L-80 ℃冰箱 香港力康公司;温度梯度PCR仪 芬兰Thermo公司;7900HT实时荧光定量PCR仪 美国ABI公司。
1.2 实验方法
1.2.1 HUVEC的培养 细胞铺满后,弃去原来培养液,用PBS缓冲液5 mL分两次洗涤细胞,加入1 mL胰蛋白酶(含EDTA)消化液于培养箱中消化1 min,取出后加入5 mL10% FBS培养液,用吸管将细胞轻轻吹下制成单细胞悬液,分装于新的培养瓶中,置于5% CO2,37 ℃恒温恒湿培养箱中培养。隔天换液,隔2 d传一代。
1.2.2 MTT法测定9t18∶1和11t18∶1对内皮细胞活力的影响 两种反式脂肪酸分别用0.5 mL 0.1 mol/L的氢氧化钠在60 ℃水浴促溶,用PBS缓冲液稀释至1000 μmol/L,过膜-20 ℃保存。取生长至对数生长期的细胞,胰蛋白酶消化后以 1×105/mL 接种于 96 孔细胞培养板,置于培养箱培养。培养24 h待细胞完全贴壁后吸去培养液,每组加含5%血清的 DMEM培养液 180 μL和各浓度9t18∶1和11t18∶1 20 μL,9t18∶1和11t18∶1最终浓度分别为 5、25、50、100 μmol/L;设置阴性对照组和PBS溶剂对照组每组5个复孔。继续培养24 h后吸弃培养液,每孔用150 μL PBS清洗换180 μL新培养液并加 20 μL MTT。37 ℃避光孵育4 h,小心吸弃上清液,每孔加 150 μL 二甲基亚砜(DMSO),微量振荡器上振荡10 min使蓝紫色结晶充分溶解,用酶标仪490 nm测定OD值。计算TFA对细胞活力的影响。
细胞存活率(%)=(OD实验组-OD对照组)/OD对照组×100
1.2.3 鬼笔环肽-FITC和DAPI双染观察9t18∶1和11t18∶1作用细胞形态学的变化 经100 μmol/L9t18∶1和11t18∶1作用24 h后,内皮细胞消化稀释成1×105/mL单细胞悬液,取200 μL平铺至盖玻片上,置于六孔板中于培养箱中培养6 h,至细胞完全贴壁伸展。鬼笔环肽-FITC染液按1∶200比例稀释后4 ℃避光保存。用PBS洗一次六孔板中细胞,4%多聚甲醛室温固定细胞10 min,PBS洗细胞30 s,再用细胞通透液室温作用5 min。PBS洗一次细胞,每孔加200 μL鬼笔环肽-FITC,室温避光作用30 min。PBS洗细胞3次,每孔加200 μL DAPI染色1 min。PBS冲洗盖玻片2次,室温避光晾干,反扣至滴有一滴抗荧光猝灭封片液的载玻片上,指甲油固封四角。置于4 ℃,避光,激光共聚焦显微镜观察结果。
1.2.4 细胞NO分泌量和NOS活力的测定 取对数生长期细胞,消化吹散制成单细胞悬液,稀释至细胞浓度为1×105/mL,接种于6孔板,每孔2 mL,每个浓度设3个复孔。将6孔板置于37℃、5% CO2恒温恒湿培养箱中培养24 h,待细胞完全贴壁后,分别加入反油酸和反异油酸(终浓度分别为25、50、100 μmol/L)并作用24 h,取上层培养液采用比色法测定NO 分泌量,具体操作参考试剂盒说明书。PBS清洗2次,用细胞刮刮下细胞,离心收集细胞,每孔加入细胞裂解液300 μL裂解30 min,离心取上清,采用比色法测定总的NOS活性。具体操作参考试剂盒说明书。
1.2.5 细胞LDH渗出率的测定 取对数生长期细胞,消化吹散制成单细胞悬液,稀释至细胞浓度为1×105/mL,接种于6 孔板,每孔2 mL,每个浓度设3个复孔。将6孔板置于37 ℃、5% CO2恒温恒湿培养箱中培养24 h,待细胞完全贴壁后,分别加入反油酸和反异油酸,使其终浓度为25、50、100 μmol/L并继续培养24 h后,取上清液测定细胞外LDH含量。每孔PBS清洗2次,用细胞刮刮下细胞,离心收集细胞,每孔加入细胞裂解液300 μL裂解30 min,离心取上清,采用比色法测定细胞内LDH含量,具体操作步骤参考试剂盒说明书。
LDH渗出率(%)=细胞外LDH含量/(细胞内LDH含量+细胞外LDH含量)×100
1.2.6 细胞SOD酶、MDA含量的测定 取对数生长期细胞,消化吹散制成单细胞悬液,稀释至细胞浓度为1×105/mL,接种于6 孔板,每孔2 mL,每个浓度设3个复孔。将6孔板置于37 ℃、5% CO2恒温恒湿培养箱中培养24 h,待细胞完全贴壁后,分别加入反油酸和反异油酸,使其终浓度为25、50、100 μmol/L作用24 h,移除培养液,每孔用PBS 清洗 2 次,用细胞刮刮下细胞,离心收集细胞,每孔加入细胞裂解液300 μL 4 ℃裂解30 min,离心取上清,按照试剂盒说明测定SOD活力和MDA含量。

表1 反转录cDNA反应体系

表2 引物序列

表3 荧光定量PCR反应体系
1.2.7 细胞炎症因子的测定 总RNA的提取:细胞接种于直径为5 cm平皿,待贴壁后分别加入反油酸和反异油酸(终浓度为25、50、100 μmol/L)并作用24 h。处理结束后,用冷的PBS清一次,加入1 mL RNAiso裂解细胞5 min,吹打后移入1.5 mL离心管(DEPC水处理)中,再加入200 μL氯仿,剧烈震荡15 s,室温放置5 min;12000 r/min 4 ℃离心15 min,此时管内液体分三层,上层为RNA溶液,中层为DNA白色絮状沉淀,下层为蛋白质溶液,轻轻吸取上清转移到新的离心管中。加入500 μL异丙醇混匀,静止30 min,12000 r/min 4 ℃离心10 min,出现白色RNA沉淀。吸取上清液,加入1 mL 75%乙醇(DEPC水配置),8000 r/min离心5 min,除去上清液,超净台内室温晾干,加入50 μL DEPC水溶解后放入-80 ℃冰箱保存。紫外分光光度法检测RNA纯度,样品在260 nm和280 nm出吸光度比值要求在1.8~2.0之间。
1.2.8 数据统计 所有实验数据用SPSS13.0统计软件进行单因素方差分析,p<0.05 表示有显著性差异。
钩藤根腐病可用3亿CFU/克哈茨木霉菌20~50倍,或10亿个/克枯草芽孢杆菌800~1 000倍,或1%申嗪霉素悬浮剂800~1 000倍,或8%井冈霉素A水剂100~125倍灌根或喷淋。
2 结果与讨论
2.1 9t18∶1和11t18∶1对内皮细胞存活力影响对比
如图1所示,与培养液对照组和溶剂对照组(PBS)相比,11t18∶1组和9t18∶1组对内皮细胞活力的抑制作用随浓度的升高而增强。其中5 μmol/L和25 μmol/L的两种TFA对细胞活力的影响相对较小且两种TFA之间没有显著性差异(p<0.05)。两种TFA在50~100 μmol/L剂量范围内对HUVEC增殖具有明显的抑制作用。100 μmol/L 9t18∶1在100 μmol/L的对HUVEC细胞存活率的抑制作用显著强于100 μmol/L 11t18∶1(p<0.05)。
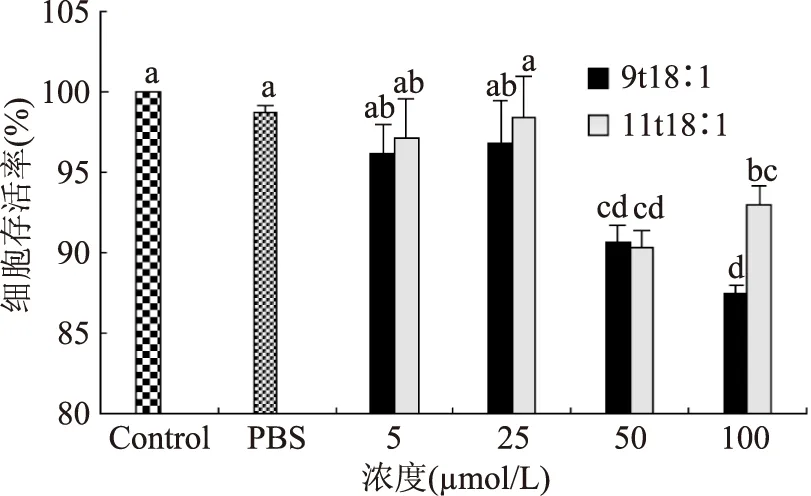
图1 9t18∶1和11t18∶1对HUVEC细胞存活率的影响Fig.1 Effects of 9t18∶1 and 11t18∶1 on survival rates of HUVEC cells注:标注不同字母表示有显著性差异(p<0.05),图3~图6同。
2.2 9t18∶1和11t18∶1对内皮细胞形态影响对比
从上述MTT实验中得出,100 μmol/L的9t18∶1和11t18∶1作用内皮细胞时,内皮细胞存活率有明显的下降,且两者之间具有显著性差异,因此选用100 μmol/L浓度来观察两种反式脂肪酸对内皮细胞形态的影响。

图2 9t18∶1和11t18∶1对细胞形态学的影响Fig.2 Effects of 9t18∶1 and 11t18∶1 on HUVEC morphology
如图2所示,正常的内皮细胞呈梭状,细胞形态规则,细胞核呈椭圆形且轮廓清晰。100 μmol/L 9t18∶1和11t18∶1作用24 h后细胞形态均有明显的变化,细胞由正常的梭形变为圆形,而且边缘呈粗糙状态。细胞质分布散乱,细胞核破损严重。该结果提示两种反式脂肪酸作用后内皮细胞严重变形,细胞功能损伤明显。
如图3所示,9t18∶1和11t18∶1作用细胞后,LDH有渗出现象且LDH渗出率与浓度呈正相关关系。9t18∶1在100 μmol/LLDH渗出率最高,相比于25、50 μmol/L具有显著性差异。11t18∶1 100 μmol/L和25 μmol/L组间具有显著性差异。相同浓度9t18∶1和11t18∶1组间均有显著性差异,11t18∶1作用细胞后的LDH渗出率明显低于同浓度9t18∶1。

图3 9t18∶1和11t18∶1对HUVEC LDH渗出率的影响Fig.3 Effects of 9t18∶1 and 11t18∶1 on LDH leakage
2.4 9t18∶1和11t18∶1对内皮细胞NOS活力、NO分泌量的影响
由图4 可知,随着反式脂肪酸浓度的升高,细胞NOS活力降低且与浓度呈正相关关系。11t18∶1各浓度组间没有明显差异,而9t18∶1在100 μmol/L比25 μmol/L的NOS活力低,且有显著性差异。9t18∶1组NOS酶活性较11t18∶1组低。可见9t18∶1对NOS抑制作用较11t18∶1强。与对照组相比,9t18∶1和11t18∶1作用后内皮细胞NO分泌量均明显下降(p<0.05)。随着两种反式脂肪酸浓度的升高,内皮细胞NO分泌量下降。相同浓度的9t18∶1组NO分泌量比11t18∶1组低。
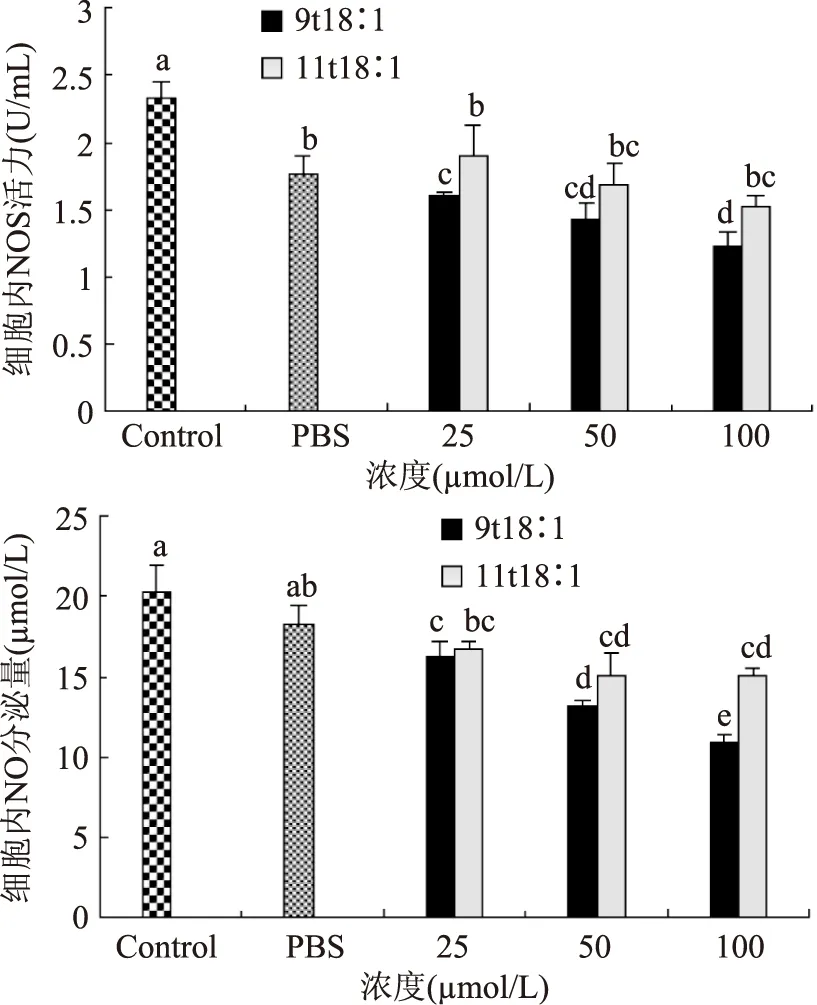
图4 9t18∶1和11t18∶1对内皮细胞NOS活力和NO分泌量的影响Fig.4 Effects of 9t18∶1 and 11t18∶1 on NOS activity and NO secretion
2.5 9t18∶1和11t18∶1对内皮细胞SOD酶活、MDA含量的影响
超氧化物歧化酶(SOD)和丙二醛(MDA)都是评价细胞内氧化水平的重要指标。由图5可知9t18∶1和11t18∶1作用后,细胞SOD活力有显著下降的趋势,在50、100 μmol/L时9t18∶1组SOD明显低于11t18∶1组且有显著性差异。9t18∶1对内皮细胞损伤强于11t18∶1。9t18∶1和11t18∶1作用后,细胞MDA含量均有上升,但9t18∶1组比11t18∶1组上升更为明显(50、100 μmol/L)。可见9t18∶1和11t18∶1均会造成细胞内氧化应激水平失衡,且9t18∶1比11t18∶1更为明显。
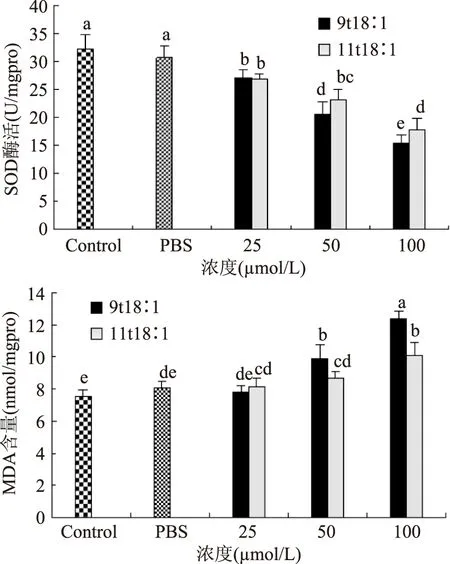
图5 9t18∶1和11t18∶1对内皮细胞SOD酶活和MDA含量的影响Fig.5 Effects of 9t18∶1 and 11t18∶1 on SOD activity and MDA contents
2.6 9t18∶1和11t18∶1对ICAM-1、VCAM-1、IL-6(白细胞介素6)mRNA表达量的影响
ICAM-1、VCAM-1和IL-6都是评价细胞内炎症反应的重要指标,其mRNA表达量的变化反映了细胞内炎症反应的激烈程度。由图6可以看出,9t18∶1和11t18∶1作用内皮细胞后细胞内ICAM-1 VCAM-1 IL-6mRNA表达量都有明显提高,特别是100 μmol/L时。同浓度组间对比9t18∶1高于11t18∶1,且在50、100 μmol/L时有显著性差异。

图6 9t18∶1和11t18∶1对HUVEC内皮细胞ICAM-1、VCAM-1、IL-6mRNA表达量的影响Fig.6 Effects of 9t18∶1 and 11t18∶1 on the mRNA expression levels of ICAM 1,VCAM 1,IL-6 mRNA in HUVEC cells
3 结论与讨论
一氧化氮(nitric oxide,NO)是一类调节生物体循环系统功能的非常重要的气体信号分子,在正常生理状态下,内皮型一氧化氮合酶(eNOS)可产生低浓度的NO,发挥内皮细胞源性舒张因子作用而舒张血管。NO分泌量的变化是检测内皮细胞是否受损的一个重要指标。NO不仅能调节血管张力,还被认为是一种抗炎分子[8],其抗炎作用主要是通过抑制核转录因子kappa B(NF-κB)活性,从而抑制动脉粥样硬化的形成。Kitamot 等[9]运用基因转染技术以大鼠为载体证实在内皮细胞处NO可通过NF-κB 途径抑制单核细胞趋化蛋白(MCP-1)的表达,从而减少单核细胞的迁移,发挥抗炎、抗动脉粥样硬化作用。目前公认的NOS被分为两个亚型,一种是结构型NOS(cNOS),包括eNOS和nNOS,另一种是诱导型NOS(iNOS)[10]。有研究表明随着eNOS水平的降低,会导致NO的分泌量相应减少,最终造成动脉血管的舒张功能受损和炎症的发生。邱斌[10]等报道不同饱和度反式脂肪酸可抑制eNOS活性减少NO的分泌。可见,TFA引发内皮细胞损伤可能是通过NOS-NO系统诱导。9t18∶1和11t18∶1作用后细胞内NOs活力呈现出下降,导致NO分泌量也相应的减少。而9t18∶1抑制NOS强度高于11t18∶1,NO分泌量也低于11t18∶1,所以9t18∶1对NOS-NO系统的影响要强于11t18∶1。
LDH存在于人体所有细胞中,是人体能量代谢中十分重要的酶。LDH的变化会直接或间接影响机体的能量代谢,当机体各组织器官发生病变时,其组织器官本身的LDH含量 要发生改变从而引起血液中LDH的改变。LDH渗出率是细胞氧化应激的指示因子之一,细胞LDH 渗出率提高表明细胞功能受损或者死亡,细胞膜的结构发生了脂质过氧化,导致细胞膜转运功能改变[11]。本实验发现9t18∶1和11t18∶1诱导细胞LDH 渗出率增加,且9t18∶1比11t18∶1作用更强。所以9t18∶1引起的LDH渗出导致内皮细胞功能障碍比11t18∶1要强。
SOD和MDA都是评估体内氧化程度的重要指标。SOD是一种蛋白酶,在体内能够清除氧自由基,保护生物体免受氧自由基的攻击,其活力的高低反应了机体内清除氧自由基的能力强弱。MDA作为生物膜中不饱和脂肪酸发生脂质过氧化反应的产物,通过MDA 含量可以反映细胞内氧自由基水平和脂质过氧化反应的强弱。9t18∶1和11t18∶1作用后,SOD酶活明显下降,而MDA含量上升,说明细胞内氧化还原平衡遭到破坏,氧化应激水平上升。而总体看来9t18∶1作用后SOD下降及MDA上升的量都要高于11t18∶1,可见9t18∶1对内皮细胞造成的氧化损伤明显高于11t18∶1。
炎症反应被认为是动脉粥样硬化的起始阶段。当系统炎症出现时,内皮细胞介导炎症细胞向感染部位和损伤的组织聚集,同时并释放相关细胞因子和生长因子,再与白细胞进行信号交流。TFA作为一种外源性刺激物可引起体内一系列炎性反应。9t18∶1和11t18∶1刺激产生的细胞间粘附因子(ICAM-1)、血管细胞粘附分子(VCAM-1)、白细胞介素(IL-6)等细胞炎症因子不仅会影响内皮细胞和炎症细胞之间的相互作用,还会影响内皮细胞的活力,诱导产生炎性表型的内皮细胞[12]。
上述实验结果总体显示出相同浓度的11t18∶1对人脐静脉内皮细胞造成的损伤明显低于9t18∶1。有研究指出11t18∶1在人类和反刍动物体内经过乙酰辅酶A脱饱和酶1催化可生成9c11t-CLA,9c11t-CLA有一定的抗炎作用[13-15],它能显著降低ICAM、VCAM、TNF-а、IL-1、IL-6的mRNA表达水平,抑制NF-кB通路的激活[16-18]。是否由于9c11tCLA的抗炎作用减少了11t18∶1对内皮细胞的损伤呢?这有待进一步研究。
[1]Mozaffarian D,Rimm E B,Meigs J B,et al.Trans fatty acids and systemic inflammation in hart failure[J].Am J Clin Nutr,2004,80:1521-1525.
[2]Bear D J,Judd J T,Clevidence B A,et al.Dietary fatty acids affect plasma markers of inflammation in healthy men fed controlled diets:a randomized crossover study[J].Am J Clin Nutr,2004,79:969-973.
[3]De Roos NM,Bots ML,Katan MB.Replacement of dietary saturated fatty caids by trans fatty acids lowers serum HDL cholesterol and impairs endothelial function in heathy men and women[J].Arterioscle Thromb Vasc Biol,2001,21:1233-1237.
[4]Veresov V G,Davidovskii A I. Monte Carlo simulations of tBid association with the mitochondrial outer membrane[J]. Eur Bio Phys J,2007,37(1):19-33.
[5]Bolton-Smith C,Woodward M,Fenton S,Brown CA.Does dietary trans fatty acid intake relate to the prevalence of coronary heart disease in Scotland?[J]Eur Heart J. 1996;17:837-845.
[6]Ascherio A,Hennekens CH,Buring JE,et al.. Trans-fatty acids intake and risk of myocardial infarction[J]. Circulation. 1994;89:94-101.
[7]Liu XR,Deng ZY,Hu JN,et al.. Erythrocyte membrane trans fatty acids index Is positively associated with a 10-year coronary heart disease risk probability[J]. Brit J Nutr,2013,109(9):1695-1703.
[8]Tedgui A,Mallat Z.Anti-inflammatory mechanisms in the vascular wall[J]. Circ Res,2001,88(9):877-887.
[9]Kitamato S,Egashira K,Kataoka C,et al. Increased activity of nuclear factor-κB participates in cardiovascular remodeling induced by chronic inhibition of nitric oxide synthesis in
rats[J]. Circulation,2000,102(7):806-812.
[10]邱斌,刘蓉,邓泽元,等.反式C18∶1通过NOS-NO通路诱导内皮细胞损伤机制的研究[J].食品科学,2011,32(15):277-280.
[11]Yetik-anacak G,Catravas J D. Nitric oxide and the endothelium:history and impact on cardiovascular disease[J]. Vascul Pharmaco,2006,45(5):268-276.
[12]Bierhuas A,Chen J,LIliensiek B,et al.LPS and cytokine~activited endothelium[J].Semin Thromb Hemost,2000,256:571-587.
[13]Loscher CE,Draper E,Leavy O,et al.Conjugated linoleic acid suppresses NF-κB activation and IL-12 production in dendritic cells through ERK-mediated IL-10 induction[J]. Immunol,2005,175:4990-4998.
[14]Bassaganya-Riera J,Hontecillas R & Beitz DC. Colonic anti-inflammatory mechanisms of conjugated linoleic acid[J]. Clin Nutr,2002,21:451-459.
[15]Hontecillas R,Wannemeulher MJ,Zimmerman DR,et al.Nutritional regulation of porcine bacterial-induced colitis by conjugated linoleic acid[J]. Nutr,2002,132:2019-2027.
[16]Yu Y,Correll PH & Vanden Heuvel JP. Conjugated linoleic acid decreases production of pro-inflammatory products in macrophages:evidence for a PPARg-dependent mechanism[J].Biochim Biophys Acta,2002,1581:89-99.
[17]Daynes RA,Jones DC.Emerging roles of PPARs in inflammation and immunity[J]. Nat Rev Immunol,2002,2:748-759.
[18]Kersten S,Desvergne B,Wahli W. Roles of PPAR in health and disease[J]. Nature,2000,405:421-424.
Exploration of elaidic acid and trans-vaccenic acid on inflammation of human umbilical vein endothelial cells
WEN Xiao-dong,LIU Ben-xin,DENG Ze-yuan,FAN Ya-wei,LI Jing*
(Key Laboratory of Food Science of Ministry of Education,Nanchang University,Nanchang 330047,China)
The aim of the present study was to compare the effects of the elaidic acid(9t18∶1)and the trans-Vaccenic acid(11t18∶1)on endothelial cells injury. After adding different concentrations of 9t18∶1 11t18∶1,the cell viability,cell morphology,oxidase activity(SOD and MDA),LDH leakage rates,effects of NO content and NOs activity were obserred. The results showed that 9t18∶1 and 11t18∶1 reduced the cell survival rate,and the inhibitory effect of 9t18∶1 on proliferation of endothelial cells were stronger than 11t18∶1 in 100 μ mol/L.Both of trans fatty acids lead to changes in endothelial cell morphology,cells from normal spindle to round and edge became rough. 9t18∶1 and 11t18∶1 increased LDH leakage rate and MDA in endothelial cell,but the 11t18∶1-treated group was reduced than 9t18∶1 in the same concentration. NO secretion,NOS and SOD activity was reduced by 9t18∶1 and 11t18∶1,but 11t18∶1 group was significantly higher in the same concentration of 9t18∶1. Both of 9t18∶1 and 11t18∶1 could increase the mRNA expression levels of ICAM,VCAM,and IL-6,the former was obviously higher than the latter. In summary,the HUVEC cells injury induced by 11t18∶1 was significantly weaker than that of 9t18∶1.
elaidic acid;trans-vaccenic acid;Endothelial cells injury
2014-12-24
文晓东(1989-),男,硕士研究生,研究方向:食品科学,E-mail:goodwenxiaodong@163.com。
*通讯作者:李静(1982-),女,博士,副教授,研究方向:营养学,E-mail:lijing66@ncu.edu.cn。
教育部新教师基金(20113601120004);江西省科技厅自然基金(20114BAB214016);国家自然基金(31401485)。
TS201.4
A
1002-0306(2015)23-0352-06
10.13386/j.issn1002-0306.2015.23.065
