桑葚果酒全渣发酵过程中生物活性物质及其抗氧化活性变化的研究
2015-05-05赵红宇陈敦洪李玉锋
赵红宇,陈敦洪,邓 良,雷 激,李玉锋,张 良,*
(1.西华大学生物工程学院,食品生物技术四川省高校重点实验室,四川成都 610039;2.遂宁市川梁农业开发有限公司,四川遂宁 629000)
桑葚果酒全渣发酵过程中生物活性物质及其抗氧化活性变化的研究
赵红宇1,陈敦洪1,邓 良2,雷 激1,李玉锋1,张 良1,*
(1.西华大学生物工程学院,食品生物技术四川省高校重点实验室,四川成都 610039;2.遂宁市川梁农业开发有限公司,四川遂宁 629000)
以桑葚干果为实验原料,考察桑葚发酵液中总酚、类黄酮、花青素的含量及抗氧化活性能力在发酵过程中的变化情况。结果表明:发现前发酵10 d的类黄酮和花青素类物质受发酵的影响逐渐变少,而总酚类物质含量逐渐升高;抗氧化活性总体上呈先升后降的趋势,相比于发酵开始时下降了近50%。DPPH和FRAP法相较于ABTS法,更适合表征桑葚发酵液的抗氧化活性变化情况。桑葚酒再经过40 d陈酿最终残还原糖为14.21 g/kg,乙醇浓度为101.6 g/kg,总酚含量2.124 g/kg,花青素含量579.4 mg/kg,类黄酮41.2 g/kg,DPPH自由基清除率为21.1%,FRAP抗氧化活性为40.9 μmol Fe2+/L,总浸出物为23.241 g/L,符合国家相关标准,为进一步开发高生物活性桑葚精深加工产品提供了一条可行的途径。
桑葚,抗氧化活性,果酒
桑葚又名桑果,桑枣,葚子,乌葚等,是落叶乔木桑树(MorusalbaLinn)的果穗。桑葚营养成分丰富,不仅含有多种糖类、氨基酸、脂肪酸、维生素,还含有芦丁、桑色素、花青素、鞣质、挥发油、磷脂矢车菊素和生物碱等生物活性成分,早在1988年就被卫生部首批列为“既是食品又是药品”的药食同源植物之一[1-2]。
目前,国内的桑葚加工产品有桑葚果酱、果汁饮料、桑葚果酒、桑葚果醋等[3]。其中,桑葚果酒已逐渐成为国内外学者的研究热点,王婷[4]、黄星源[5]等人优化了桑葚果酒的发酵工艺及澄清工艺;史清龙[6]、刘玮[7]等人分析了桑葚果酒中香气成分的变化。但对桑葚发酵过程中抗氧化活性变化的研究,则几乎没有报道。国外有学者指出,果酒和啤酒的酿造过程会使原料的抗氧化活性能力增强[8];林巧[9]等研究了樱桃果酒发酵过程中黄酮、多酚的含量及抗氧化性随时间的变化情况,发现随着发酵时间的延长,发酵体系中酒精含量逐渐增加,体系中黄酮与多酚含量及清除羟基自由基的能力也缓慢增加。本研究以市售的自然晒干的紫色川南桑葚干果为主要原料,考察深层静止发酵过程中发酵液中酚类、类黄酮、花青素含量的变化情况,以及通过ABTS、FRAP和DPPH方法衡量其抗氧化活性能力的变化,以期找到其中蕴含的规律,为进一步开发桑葚精深加工产品提供科学支撑。
1 材料与方法
1.1 材料与仪器
桑葚干果 产自四川遂宁市川梁农业开发有限公司规模化种植园,经热风干燥后储存,要求无霉变、含水率低于15%、色泽深紫、成熟度佳、口感淡甜的桑葚;无水葡萄糖、安琪果酒酵母(安琪葡萄酒果酒专用酵母RW)、焦亚硫酸钠、柠檬酸 均为食品级。
YJ-875型医用超净工作台、恒温摇床培养箱、台式干燥箱 重庆医疗设备厂;751 GW紫外、可见分光光度计 惠普上海分析仪器有限公司;JA2003电子天平 上海天平仪器厂;LD5-2A离心机 北京医用离心机厂;酶标仪 美国Bio-Rad 公司;气质联用系统 日本岛津公司GC20,配GC-Solution 7.0数据分析工作站。
1.2 实验方法
1.2.1 主要培养基的制作 种子培养基(g/L):葡萄糖5.0,酵母粉5.0,蛋白胨5.0,(NH4)2SO41.5,KH2PO41.5,MgSO4·7H2O 0.65,CaCl22.8,pH6.0,115 ℃条件下高压蒸汽灭菌15 min。
菌种活化:取0.5 g干酵母至预先配制的种子培养基中,30 ℃摇床培养16 h,摇床转速150 r/min。
桑葚发酵工艺:将桑葚干打粉后,按照120 KNU/kg添加焦亚硫酸钠,取桑葚粉100 g按照1∶4(桑葚粉∶水)混合,测定总糖,按照一定比例加无水葡萄糖,使初始糖浓度为300 g/L,初始发酵醪重量500 g,装入1000 mL具塞三角瓶。接入预先活化的菌种,静止发酵,温度为28 ℃,接种量为2%(v/w),每日取样。
1.2.2 发酵过程中还原糖、乙醇测定 待测样品分离:在2 mL EP管取少量发酵醪液在2400×g冷冻离心机(4 ℃)中离心1 min,再以孔径为0.45 μm的微孔滤膜过滤发酵液,-20 ℃保存备用。
还原糖测定以无水葡萄糖为对照,采用略作改进的3,5-二硝基水杨酸(DNS)比色法[10]。具体为:吸取0.25~1.5 mL 0.2%标准葡萄糖溶液,置于25 mL容量瓶中,再加入3,5-二硝基水杨酸溶液3 mL,用蒸馏水补足至总体积5 mL沸水浴中显色5 min,然后以流动水迅速冷却,蒸馏水定容至刻度,摇匀。以蒸馏水2 mL与3,5-二硝基水杨酸溶液3 mL试剂同样操作为空白调零,在波长540 nm处比色,得到吸光度值,参照葡萄糖标准曲线,求出还原糖的量。
乙醇测定采用气相色谱法[11],以正丙醇为内标,氢火焰离子化检测器,Agilent DB-WAX型柱(30 m×0.32 mm×0.25 μm)。具体为:进样口温度220 ℃,检测器220 ℃,柱流速1.6 mL/min;载气为40 mL/min氢气,空气流速400 mL/min;采用分流进样,分流比30∶1,进样量1 μL;程序升温条件:初始温度50 ℃,保持2 min,以10 ℃/min升至100 ℃,再以20 ℃/min升至160 ℃,保持1 min;单个样检测时间为10 min。
1.2.3 总多酚、总黄酮、总花青素测定 总多酚以没食子酸为标准品,依据文献采用福林-酚法略作修改测定[12]。总类黄酮以芦丁为标准品,将一定浓度的标准品和样品加入一定量质量分数为5%的NaNO2、10%的Al(NO3)3和4% NaOH溶液反应,在510 nm处用酶标仪测定吸光度,利用标准曲线测定总黄酮含量[13]。总花青素含量以矢车菊素-3-葡萄糖苷为标准品,采用pH示差法测定[14]。将经稀释的样品1 mL,分别用pH1.0的氯化钾和pH4.5的乙酸钠定容至10 mL,暗处反应30 min后在510 nm和700 nm处测定其吸光值,总花青素含量=(A/εL)×MW×DF×V/Wt,其中A=(A510 nmpH1.0-A700 nmpH1.0)-(A510 nmpH4.5-A700 nmpH4.5);MW为矢车菊素-3-葡萄糖苷的分子量449.2;ε为矢车菊素-3-葡萄糖苷的消光系数,取26900;DF为稀释倍数;L为光程;V为样品体积;Wt为样品质量。
1.2.4 抗氧化活性能力测定 为准确考察桑葚酒的抗氧化能力,本研究采用了ABTS、FRAP和DPPH这3种生物氧化剂,分别测试了桑葚果酒在发酵过程中抗氧化活性能力的变化。ABTS测定,采用试剂盒法(方法见http://www.senbeijia.com/njsbjsw-Products-4874682/。购自南京森贝伽生物科技有限公司,货号SBJ-0186)。DPPH法根据文献方法略作改进测定[15],具体为:取1 mL用甲醇稀释至一定浓度的样品,加入2 mL的DPPH溶液(0.5 mol/mL),摇匀至暗处反应20 min后,于波长517 nm处测定吸光值,以清水作为对照,DPPH自由基清除率(%)=(Acontrol-Asample)/Acontrol× 100。FRAP法采用试剂盒方法(购自碧云天生物科技公司,产品标号S0116,方法见http://www.beyotime.com/reactive-oxygen/s0116. html)。
1.2.5 感官评价 感官评定通过30名不同年龄阶段的食品专业人员采用果酒产品常用的盲评打分法进行,评分标准参照《葡萄酒、果酒通用实验方法》GB/T15038-2006进行,统计平均评价作为有效数据。
1.3 计算
发酵效率(%)=实际发酵乙醇浓度/理论乙醇发酵浓度(初始糖浓度×0.511)×100
糖利用率(%)=(初始糖浓度-最终残糖浓度)/初始糖浓度×100
2 结果与分析
2.1 桑葚果酒发酵情况分析
图1为桑葚酒发酵过程中还原糖消耗和酒精生成的情况,从中可以看出,桑葚果酒的发酵状况较好,发酵10 d后残还原糖为20.13 g/kg,酒精浓度为90.42 g/kg。发酵液中的还原糖消耗速度存在先升高后降低的情况,发酵第4 d的还原糖浓度从194.62 g/L快速下降至98.07 g/kg,究其原因,可能是由于酵母增殖和代谢速度在静止条件下较慢,到第3 d之后达到高峰。桑葚酒发酵完成时,其糖利用率为93.29%,发酵效率为65.53%,这与徐辉艳[16],郭卫芸[17]等人的发酵结果较为相似。耿红玲[18]等人的研究表明,全渣发酵比清液发酵其干浸出物高20%以上,而桑葚中的主要活性成分均大量分布在浸出物中,本研究采用全渣发酵有利于后续生物活性成分的研究。

图1 桑葚发酵过程中乙醇生产和糖消耗随时间变化曲线图Fig.1 Ethanol production and sugar consumption during fermentation
2.2 发酵过程中总酚、类黄酮、总花青素含量变化情况
如图2所示,本研究考察了桑葚酒发酵10 d过程中总酚、类黄酮和花青素的变化情况。从图2可以看出,桑葚酒酿造过程前5 d,总酚出现先上升后下降,最后5 d再上升的情况,发酵液总酚在第2 d出现最高值(2145 mg/kg),相比初始发酵液(1442 mg/kg,0 d)和最终发酵液(1898.6 mg/kg,10 d)高了48.75%和12.97%。值得注意的是:总酚含量最高的第3 d,发酵液中还原糖含量也较高,这可能是由于糖的高浓度促进了酚类在发酵液中的溶解;而之后的3~5 d,总酚出现快速下降,其原因可能是由于酵母发酵过程总产生的有机酸与酚类反应,生产酚酸类化合物,导致酚类物质快速减少;但是,这些酚酸在不断的聚合、氧化反应过程中,酚类物质会发生复杂的变化。在桑葚酒发酵后期,酚酸可与花色素及酒石酸结合,同时微生物代谢会生成对羟基类肉桂酸,并生成酚类,这也可能导致发酵后5 d桑葚发酵液中总酚含量的上升。
如图2所示,花青素含量出现先升高后降低的过程,最高值出现在发酵2 d时,达到623 mg/kg,这可能是由于原料结果前期干燥,花青素物质在发酵液中逐渐溶出导致。而发酵后期的缓慢下降,可能是由于花青素较敏感性,容易受到光照、pH、糖、乙醇等相关因素的影响,这也与张红娜等人的研究结果相似[19]。桑葚酒发酵过程中,类黄酮成分在发酵4 d时达到最低值22.71 mg/kg,相比最高值71.1 mg/kg(初始发酵液,发酵0 d)低了68%,而发酵后期含量趋于稳定后,含量为44.7 mg/kg(发酵10 d),也低了45%。究其原因,可能是由于,随着发酵前期总酚含量的快速上升,多酚氧化酶和氧气促进了花青素的转化,使其含量下降[20]。

图2 桑葚酒发酵过程中总酚、类黄酮、花青素含量随时间变化曲线Fig.2 Flavonoids,anthocyanins and total phenol content change of mulberry wine during fermentation
本研究追踪了桑葚酒前发酵期间主要生物活性物质的变化情况,这些物质均与桑葚酒的保健作用密切相关,同时对桑葚酒的品质也有重要影响。尤其是发酵过程中酚类物质会发生一系列复杂变化,引起桑葚酒色泽、口感等品质变化,因此研究发酵过程中活性成分的变化为酿造优质桑葚果酒提供了基础数据,为指导建立高保健功能桑葚酒生产工艺提供了理论基础。
2.3 基于ABTS、FRAP和DPPH法分析桑葚酒发酵过程中抗氧化活性能力变化情况
抗氧化活性主要表现在抑制脂质氧化降解、清除自由基、抑制促氧化剂(如螯合过渡金属)、还原性或者促进机体产生内源性抗氧化物质(如SOD、CAT、GSH等),相关的测定方法有很多[21]。桑葚发酵酒由于原料成分复杂,微生物水解等因素都会影响其抗氧化活性,因此利用多种方法同时评价其抗氧化活性能力变化情况非常有必要。
从图3可以看出,桑葚酒在发酵前5 d,DPPH自由基清除能力从39.61%下降至11.04%,在随后的5 d又逐步上升至14.5%左右,这与图2中前4 d花青素类物质快速下降的总趋势较为一致。有报道表明[22]桑葚细胞壁在微生物酶的作用下解聚并释放出蛋白质、糖苷等植物胞内成分,一定程度上会影响其DPPH自由基清除能力。同时,发酵液pH、温度、水分活度、乙醇浓度等均可能影响DPPH自由基的清除能力。从而导致本研究中DPPH自由基清除能力呈现大幅下降的趋势,而与林巧[9]等人的研究结果不相符。
ABTS法与DPPH法相似,均是基于分光光度测定反应体系的颜色改变来确定待测液的抗氧化活性。有报道表明[23],ABTS法和DPPH法测定柑橘、柠檬、白柚和橘子果汁的抗氧化能力结果基本一致。但是,从图3中可以看出,ABTS与DPPH法测定的抗氧化能力存在明显差异,ABTS法出现先下降后上升的过程,最低值出现在第5 d,仅41.24%,最高值出现在第8 d,达60.03%。ABTS法本质是一种间接方法,是反映桑葚发酵液清除ABTS+自由基的能力,与真实的氧化分解过程没有关系,ABTS+的氧化还原电势为0.68 V,也就是说只要某化合物的氧化还原电势低于0.68 V就能将ABTS+还原,出现颜色变化,进而出现ABTS自由基清除能力[24]。桑葚发酵液是一个复杂体系,其中有大量物质的氧化还原电势均低于0.68 V,因此该方法可能不适合反映桑葚发酵液的抗氧化能力。
Thaipong[25]等人比较了ABTS、DPPH、FRAP和ORAC法测定番石榴提取物的抗氧化能力,发现FRAP法在重复性、快速性和简洁性等多方面具有显著的优势,这也与我们的结果相似。从图3可以看出,利用FRAP法测定桑葚发酵液的抗氧化活性出现先上升后下降的趋势,从最高值的92.04 μmol Fe2+/L(第4 d)下降至41.71 μmol Fe2+/L(第10 d),下降了54.7%,这可能是由于桑葚中的抗氧化物质本身较敏感,容易收到发酵的影响,但这与酚类物质的变化情况较为一致。因此,利用DPPH和FRAP两种方法表征桑葚发酵液的抗氧化能力变化情况可能更为适宜,而ABTS法可能不太适合。

图3 发酵过程中基于DPPH、ABTS和FRAP法测定抗氧化活性变化图Fig.3 Antioxidant activities(DPPH,FRAP,ABTS) change during fermentation
2.4 桑葚发酵酒的产品分析
依据葡萄酒、果酒通用分析方法(国标GB/T 15038-2006),将本研究发酵10 d并陈酿40 d的桑葚酒与市场购买的桑葚泡酒(果露酒)和鲜桑葚清液发酵酒进行感官分析比较,统计20人数据取平均值,结果见表1。表明:通过总计50 d的发酵过程,桑葚果酒在香气、滋味和典型性上具有明显优势。在色泽方面,普遍比清液发酵制作的要深沉自然,具有明显的深紫色,但是澄清度方面不及清液发酵和露酒;在香气方面,比液态搅拌发酵的果香浓郁,无其他异香。滋味及典型性方面,该产品为典型的半甜型低度发酵酒。综合评分来看:相比市售的对照品具有果香浓郁、色泽深厚、甜酸适口绵长厚重的优势。
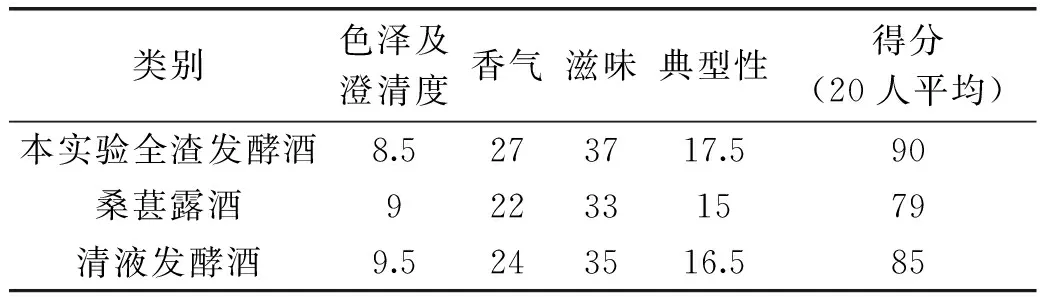
表1 发酵成品桑葚酒的分析结果
根据国标GB/T15038-2006的相关检测要求,结合本研究情况,对总发酵50 d的桑葚果酒进行相关指标分析,发现残还原糖为14.21 g/kg,乙醇浓度为101.7 g/kg,总酚含量2.124 g/kg,花青素含量579.4 mg/kg,类黄酮41.2 g/kg,DPPH自由基清除率为21.1%,FRAP抗氧化活性为40.9 μmol Fe2+/L,总浸出物为23.241 g/L,符合国家标准要求。
3 结论
本研究通过对自然干燥的桑葚全渣深层静止发酵,发现前发酵10 d的类黄酮和花青素类物质受发酵的影响逐渐变少,而总酚类物质含量逐渐升高,发酵10 d后残还原糖为20.13 g/kg,酒精浓度为93.71 g/kg;DPPH和FRAP法相较于ABTS法,更适合表征桑葚发酵液的抗氧化能力变化情况;通过40 d的后发酵陈酿发现,该桑葚酒相比市售的桑葚果露酒和桑葚清液发酵酒具有果香浓郁、色泽深厚、甜酸适口绵长厚重的优势。桑葚酒最终残还原糖为14.21 g/kg,乙醇浓度为101.7 g/kg,总酚含量2.124 g/kg,花青素含量579.4 mg/kg,类黄酮41.2 g/kg,DPPH自由基清除率为21.1%,FRAP抗氧化活性为40.9 μmol Fe2+/L,总浸出物为23.241 g/kg,符合国家相关标准,为进一步开发高生物活性桑葚精深加工产品提供了一条可行途径。
[1]周静,严栋林. 新疆三种桑椹营养成分的分析与评价[J]. 食品科学,2004,25(增刊):155-158.
[2]吴祖芳,翁佩芳. 桑椹的营养组分与功能特性分析[J]. 中国食品学报,2005,5(3):102-107.
[3]董阳辉,钱剑锐,竺修高. 桑果资源开发及综合利用[J]. 浙江万里学院学报,2007,20(5):93-96.
[4]王婷,毛亮,雷静,等. 优质桑葚酒酿造工艺的研究[J]. 酿酒科技,2015(1):86-88,92.
[5]黄星源,郭正忠. 发酵型桑葚果酒的研制[J]. 酿酒科技,2014(11):58-60.
[6]史清龙. 发酵型桑葚酒香气成分及澄清工艺的研究[D]. 西安:西北农林科技大学,2006:34-45.
[7]刘玮,陈亮,吴志明,等. 不同酵母发酵的桑葚果酒香气成分的分析[J]. 食品研究与开发,2013,34(24):212-217.
[8]Gorinstein S,Caspi A,Libman I,et al. Mechanism ofcardioprotective effect and the choice of alcoholic beverage[J]. Am J Cardiol,2000,85(2):280-281.
[9]林巧,向超,孙小波,等. 樱桃果酒的抗氧化性研究[J]. 酿酒,2009,36(3):72-75.
[10]Miller,G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Anal Chem. 1959,31:426-428.
[11]李超豪,胡强,吴蔚,等. 气相色谱法同时测定白酒中的甲醇和乙(己)酸乙酯[J]. 食品与机械,2013,29(1):81-84,87.
[12]Velioglu Y S,Mazza G,Gao L,et al. Antioxidant activity and totalphenolics in selected fruit,vegetables and grain products[J]. J Agric Food Chem,1998,(46):4113-4117.
[13]Arvouet-Grand A,Vennat B,Pourrant A,et al. Standardization ofpropolis extract and identification of principal constituents[J]. J Pharm. Belg,1994,49:462-468.
[14]Giusti M M,Wrolstad R E. Characterization of Red Radish Anthocyanins[J]. J Food Sci,1996,61(2):322-326.
[15]李丽,李昌宝,邓海燕,等. 广西桑葚果汁营养成分及抗氧化活性分析[J]. 南方农业学报,2012,43(9):1378-1381.
[16]徐辉艳,濮智颖,王汉屏,等. 桑葚果醋发酵工艺条件的研究[J]. 食品工业科技,2009,30(2):164-165.
[17]郭卫芸,马兆瑞,杨公明,等. 桑葚发酵酒的工艺研究[J].酿酒,2005,32(1):80-82.
[18]耿红玲,陈宜君. 干白桑椹酒发酵工艺的研究[J]. 酿酒,2013,40(3):72-75.
[19]张文娜,张立杰,俞龙泉,等. 桑葚果汁的抗氧化活性研究[J]. 农产品加工学刊,2011,253(8):62-64.
[20]Patrasa A,Bruntona N P,O’Donnellb C,et al. Effect of thermal processing on anthocyanin stability in foods;mechanisms and kinetics of degradation[J]. Trend Food Sci Tech,2010,21:3-11.
[21]王晓宇,杜国荣,李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报,2012,31(3):247-252.
[22]Lou H,Hu Y,Zhang L,et al. Nondestructive evaluation of the changes of total flavonoid,total phenols,ABTS and DPPH radical scavenging activities,and sugars during mulberry(MorusalbaL.)fruits development by chlorophyll fluorescence and RGB intensity values. Food Sci Technol—Leb,2012,47:19-24.
[23]Hur S J,Lee S Y,Kim Y C,et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chem,2014,160:346-356.
[24]王会,周燕. 筛选和表征抗氧化剂的方法——ABTS法[J]. 广州化工,2012,40(22):41-43.
[25]Kriengsak T,Unaroj B,Kevin C. Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. J Food Compos Anal,2006,16:669-675.
Influence of alcoholic solid-state fermentation process on bioactive constituents and antioxidant activity from mulberries(MorusnigraL.)
ZHAO Hong-yu1,CHEN Dun-hong1,DENG Liang2,LEI Ji1,LI Yu-feng1,ZHANG Liang1,*
(1.Key Lab of Food Biotechnology of Sichuan Province,College of Food & Bioengineering,Xihua University,Chengdu 610039,China;2.Suining Chuanliang Agricultural development Co.,Ltd. Suining 629000,China)
The aim of the present study was to evaluate the changes of contents of total phenol,flavonoids and anthocyanins from sun-dried mulberry(MorusnigraL.)and their antioxidant activities(DPPH,FRAP,ABTS)during fermentation process. The result showed that the total phenol was increased with the 10 days prefermentation period,while the contents of flavonoids and anthocyanins were gradually decreased. The antioxidant activity,showing a trend of a rise at first followed by a decline,was reduced by nearly 50% after the end of fermentation. The methods of DPPH and FRAP radical scavenging activities were more suitable for displaying the variation of antioxidative capacity of fermented mulberry wine than the method of ABTS radical scavenging activities. After the end of fermentation,14.21 g/kg of reducing sugar,101.6 g/kg concentration of ethanol,2.124 g/kg of total phenol,579.4 mg/kg of anthocyanins,41.2 g/kg of flavonoids,21.1% of DPPH radical scavenging rate,40.9 μmol Fe2+/L of FRAP antioxidant activity and 23.241 g/L of total extracts were obtained,which provided a feasible way to further develop high biological activity and deeply processed products of mulberries.
mulberries;antioxidant activity;wine
2015-03-23
赵红宇(1992-),男,在读硕士研究生,研究方向:食品科学,E-mail:zhyshian104@163.com 。
*通讯作者:张良(1982-),男,博士,副教授,研究方向:食品生物技术,E-mail:zhang-liang@foxmail.com。
四川省科技厅应用基础项目(2013jy0091);食品生物技术四川省高校重点实验室建设项目资助(川教2006-313);国家教育部春晖计划项目;西华大重点科研基金项目(Z1120538)。
TS201.1
A
1002-0306(2015)23-0182-05
10.13386/j.issn1002-0306.2015.23.029
