感染因素对川崎病及其冠状动脉病变的影响
2015-05-05赵春娜杜忠东
赵春娜 杜忠东
·论著·
感染因素对川崎病及其冠状动脉病变的影响
赵春娜 杜忠东
目的 探讨感染因素对川崎病(KD)及其冠状动脉病变的影响。方法 回顾性收集首都医科大学附属北京儿童医院2005年1月至2014年12月出院诊断中包含KD的病历,截取人口学信息、临床发现、急性期和后遗症期超声心动图发现、转归,对每份病历重新行典型KD、不完全KD、IVIG抵抗、冠状动脉病变及其程度和合并感染的甄别。分为KD感染组、KD非感染组分析组间临床发现的差异,分为冠状动脉病变组、非冠状动脉病变组分析感染因素的差异。结果 2 331例KD患儿进入分析。KD合并感染的发生率为57.1% (1 331/2 331),KD并发冠状动脉病变的发生率为36.0%(840/2 331)。KD感染组与KD非感染组年龄、发热天数及不完全KD比例差异有统计学意义(P均<0.05);冠状动脉病变组与非冠状动脉病变组肺炎支原体感染及消化系统感染伴发腹泻比例差异有统计学意义(P均<0.05)。结论 合并感染的KD患儿年龄多<1岁,易表现为不完全KD,合并肺炎支原体感染及消化系统感染伴发腹泻的KD患儿易发生冠状动脉病变。
川崎病; 感染; 冠状动脉病变
川崎病(KD)好发于5岁以下儿童,是以全身中小血管炎为病变的急性发热出疹性疾病[1]。在发达国家,KD已取代风湿热成为儿科最常见的后天性心脏病[2]。目前KD的病因尚不明确,感染因素可能起到一定作用。从流行病学特点来看,KD具有自限性和低复发率的特点,其年龄分布、流行的季节性和区域性均与感染性疾病流行特征一致,但目前尚无证据显示某种特异的病原体是引起KD的独立因素[3]。目前普遍认为KD是在一定的遗传易感因素基础上,由一种或多种感染因子引起的自身免疫系统异常激活导致的临床综合征[4,5]。本文回顾性收集首都医科大学附属北京儿童医院(我院)KD患儿住院病历,依据事先制定KD病例资料调查表,对每份病历重新判断典型KD、不完全KD、感染和冠状动脉病变程度,重新甄别感染,分析感染因素对KD及其冠状动脉病变的影响。
1 方法
1.1 纳入和排除标准 ①我院2005年1月至2014年12月电子病历系统中出院诊断包括KD的所有病历。②同一患儿多次入院,取第1次入院资料。③排除缺失急性期冠状动脉内径值的病历。
1.2 病例资料调查表 ①一般资料:性别、年龄;②临床发现:发热时间、眼结膜充血、四肢改变、口唇改变、颈淋巴结肿大、皮疹、卡疤改变、肛周改变、呕吐、腹泻;③急性期超声心动图:左冠状动脉主干、前降支、回旋支,右冠状动脉、右冠状动脉末端和巨大瘤等描述;④冠状动脉后遗症超声心动图(1个月后):左冠状动脉、右冠状动脉和巨大瘤等描述;⑤IVIG用法和剂量;⑥IVIG抵抗:以KD患儿在IVIG后36 h至7 d体温仍>38 ℃,并除外其他原因引起的发热[6];⑦转归:出院时存活与死亡。
1.3 诊断标准
1.3.1 典型和不完全KD 参照2013年日本循环协会修订的KD诊断标准[7]。
1.3.2Z值计算 参照美国de Zorzi等[8]制定的经体表面积校正的冠状动脉正常值公式,Z=(实际观察值-正常值均数)/标准差,通过入院体重估算体表面积,体重≤30 kg:体表面积 (m2) = 体重 (kg) × 0.035 (m2·kg-1) + 0.1 (m2);体重>30 kg:体重每增加5 kg体表面积增加0.1 m2。
1.3.3 冠状动脉病变 冠状动脉病变:左冠状动脉前降支或左冠状动脉主干或右冠状动脉内径Z值>2.5,冠状动脉扩张:Z>2.5且冠状动脉内径 ≤4 mm;冠状动脉内径>4 mm且<5 mm为小冠状动脉瘤,~8 mm为中等冠状动脉瘤,>8 mm为巨大冠状动脉瘤[9]。
1.3.4 感染的诊断标准 依据出院诊断中包含感染的诊断。上呼吸道感染根据患儿呼吸道症状及鼻咽分泌物检测判断;下呼吸道感染以X线胸片证实为支气管炎或肺炎;消化系统感染为患儿粪便培养阳性或消化道影像学检查示炎性改变;泌尿系统感染为中段尿培养单一病原体生长或菌落数≥106·mL-1。实验室检测肺炎支原体(MP)、EB 病毒(EBV)和巨细胞病毒(CMV)血清抗体IgM阳性分别为MP感染、 EBV感染和CMV感染。痰或咽拭子或血培养肺炎链球菌阳性为肺炎链球菌感染。
1.4 分组 KD同时符合本文感染诊断标准划为KD感染组,余为KD非感染组。以是否有冠状动脉病变分为冠状动脉病变组和非冠状动脉病变组。
2 结果
2.1 一般情况 符合本文纳入标准的KD患儿2 467例,排除同一患儿第2次以后入院99例、缺失急性期冠状动脉内径值37例,2 331例KD患儿进入本文分析。KD感染组1 331例,KD非感染组1 000例。年龄1个月至17.6岁(中位年龄为1.9岁),<5岁占89.1% (2 077/2 331)。
2.2 KD感染组与非感染组临床发现 表1显示,性别、总体年龄、发热天数,眼结膜充血、颈部淋巴结肿大、四肢改变和不完全KD比例KD感染组和非感染组差异有统计学意义。1~4岁患儿所占比例差异无统计学意义。KD感染组冠状动脉扩张375例,小冠状动脉瘤49例,中等冠状动脉瘤52例,巨大冠状动脉瘤17例;KD非感染组冠状动脉扩张250例,小冠状动脉瘤35例,中等冠状动脉瘤51例,巨大冠状动脉瘤11例;冠状动脉病变发生率两组差异无统计学意义。
表1 KD感染组与非感染组临床特点比较[n(%),M(P25,P75)]
Tab 1 Comparison of clinical characteristics between KD patients with or without infection[n(%),M(P25,P75)]
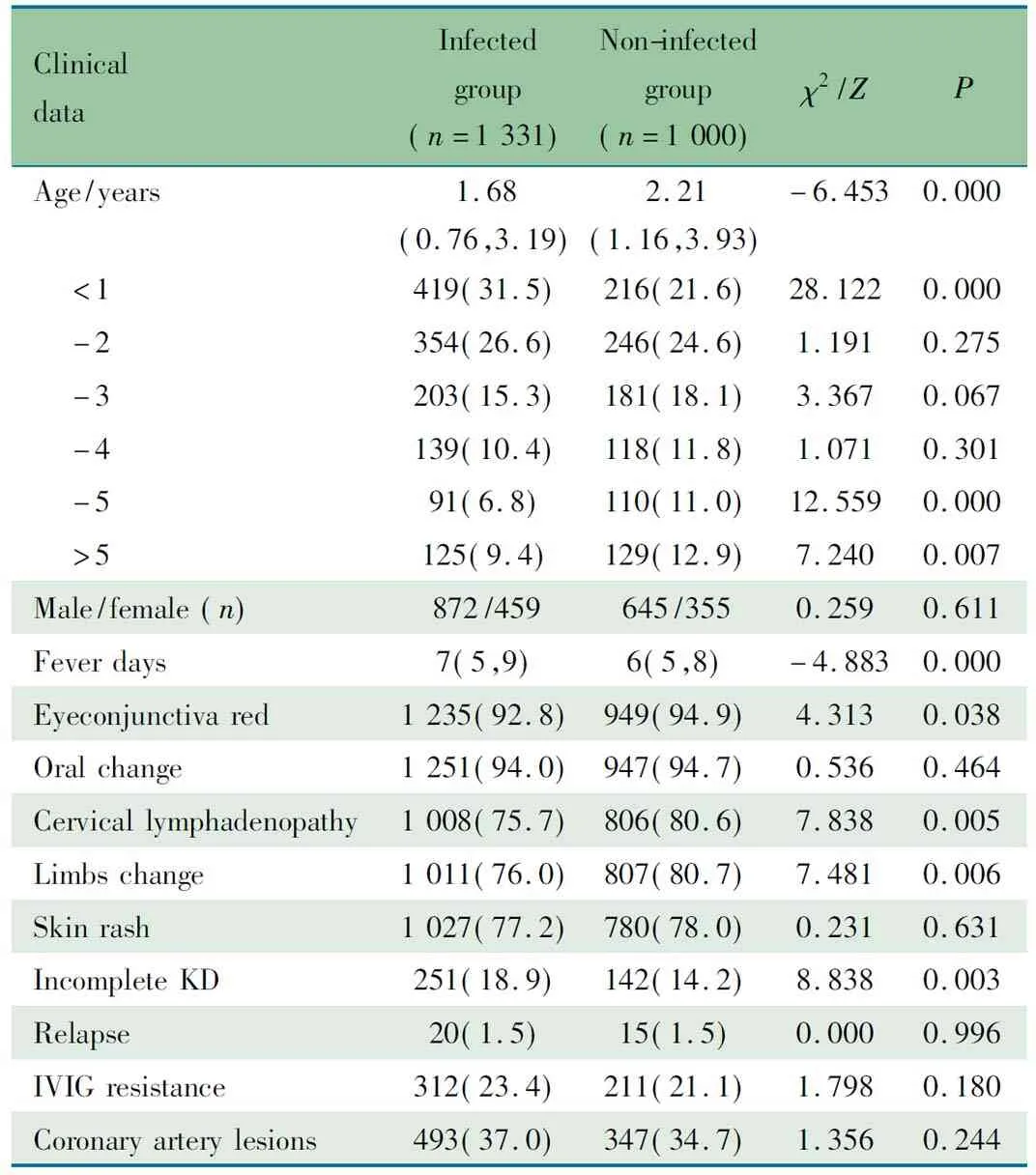
ClinicaldataInfectedgroup(n=1331)Non-infectedgroup(n=1000)χ2/ZPAge/years1.68(0.76,3.19)2.21(1.16,3.93)-6.4530.000 <1419(31.5)216(21.6)28.1220.000 -2354(26.6)246(24.6)1.1910.275 -3203(15.3)181(18.1)3.3670.067 -4139(10.4)118(11.8)1.0710.301 -591(6.8)110(11.0)12.5590.000 >5125(9.4)129(12.9)7.2400.007Male/female(n)872/459645/3550.2590.611Feverdays7(5,9)6(5,8)-4.8830.000Eyeconjunctivared1235(92.8)949(94.9)4.3130.038Oralchange1251(94.0)947(94.7)0.5360.464Cervicallymphadenopa-thy1008(75.7)806(80.6)7.8380.005Limbschange1011(76.0)807(80.7)7.4810.006Skinrash1027(77.2)780(78.0)0.2310.631IncompleteKD251(18.9)142(14.2)8.8380.003Relapse20(1.5)15(1.5)0.0000.996IVIGresistance312(23.4)211(21.1)1.7980.180Coronaryarterylesions493(37.0)347(34.7)1.3560.244
Notes KD: kawasaki disease; IVIG: intravenous immunoglobulin
2.3 KD合并感染的疾病分布 KD感染组中,1 181例为呼吸系统感染,127例为消化系统感染,29例为泌尿系统感染,其中包括73例呼吸系统合并消化系统感染,18例呼吸系统合并泌尿系统感染,1例消化系统合并泌尿系统感染 。1 181例呼吸系统感染患儿中,上呼吸道感染558例,下呼吸道感染623例。127例消化系统感染患儿中,伴发呕吐35例,伴发腹泻109例,其中30例伴发呕吐及腹泻。MP感染118例,EBV感染44例,CMV感染14例,肺炎链球菌感染12例,其中5例MP合并EBV感染,2例MP合并肺炎链球菌感染,1例CMV合并EBV感染,1例MP合并CMV、EBV感染。
2.4 感染因素对冠状动脉病变的影响 表2显示,冠状动脉病变组840例,非冠状动脉病变组1 491例,两组MP感染发生率(6.8%vs4.1%)、消化系统感染伴发腹泻的发生率(5.8%vs4.0%)差异有统计学意义(χ2=3.945,P=0.004;χ2=8.117,P=0.047)。
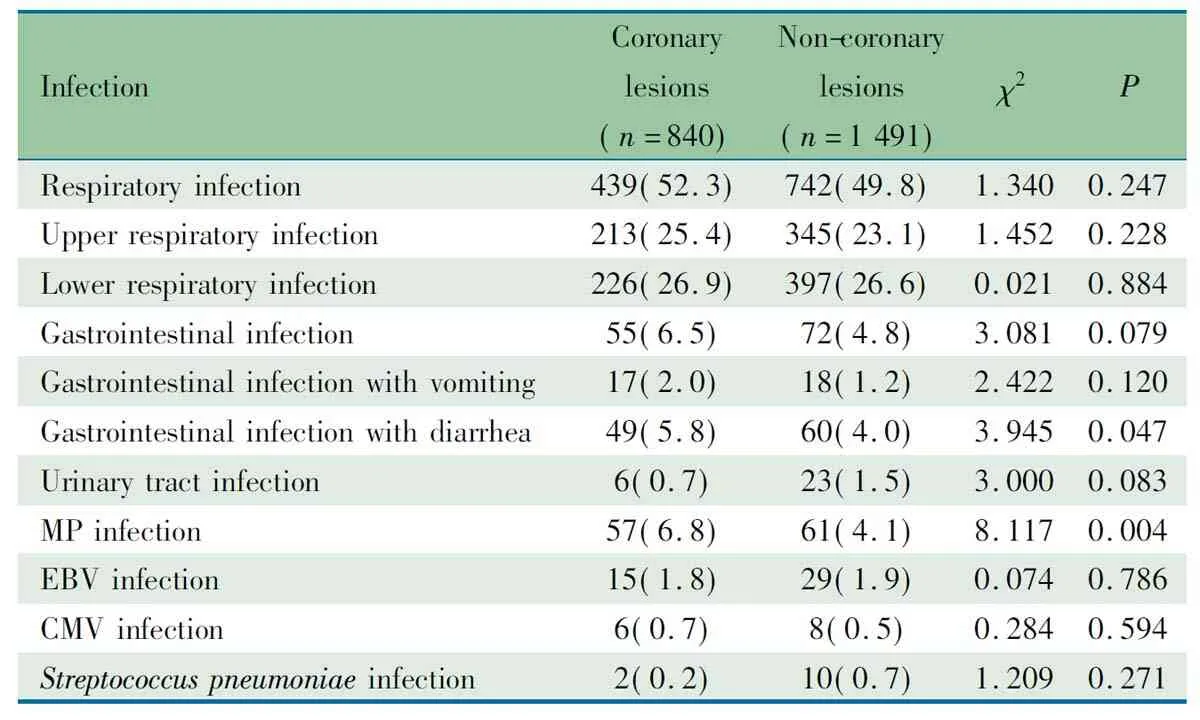
表2 冠状动脉病变组和非冠状动脉病变组感染因素比较[n(%)]
Notes MP:mycoplasmapneumonia; EBV: Epstein-Barr virus; CMV: cytomegalovirus
3 讨论
本研究系统的、回顾性的收集了我院近10年出院诊断中包含KD的病历,由于年度跨跃较大,在预先制定病例资料调查表时,对其中的采集指标进行了标准的界定,然后对每份病历重新行典型KD、不完全KD 、IVIG抵抗、冠状动脉病变及其程度和合并感染甄别,较好地反映了在临床真实病历中感染因素对川崎病及其冠状动脉病变的影响。
本研究KD感染组<1岁患儿的比例明显高于KD非感染组,>4岁患儿的比例明显低于非感染组,提示婴儿更易并发感染,而不完全KD的发生率感染组明显高于非感染组,提示感染的患儿更易出现不完全KD的表现,造成临床诊断困难,因此对于感染患儿应考虑到KD的可能,及时进行心脏彩色超声及相关实验室检查,综合分析,防止误诊、漏诊,以减轻患儿的痛苦和经济负担。
虽然发现KD已超过40余年,但其病因仍未明确,越来越多的资料显示感染可能与KD的发病相关。目前报道与KD有关的病原体有数十种,包括金黄色葡萄球菌、化脓性链球菌、肺炎链球菌、MP和衣原体,病毒包括EBV、CMV、腺病毒、细小病毒B19、疱疹病毒6型、副流感病毒3型、麻疹病毒、轮状病毒、登革热病毒、HIV、水痘带状疱疹病毒、甲型H1N1流感病毒、柯萨奇B3病毒、人类冠状病毒和人类博卡病毒[10~14]。
Tsai等[4]对142例KD患儿研究表明,66%的KD患儿起病前曾与患感染性疾病的家庭成员有密切接触,提示KD可能与感染相关。Benseler等[15]对129例KD患儿研究表明,33%的KD患儿合并感染,而64%的KD患儿在确诊前曾诊断为感染性疾病,包括扁桃体炎、病毒性疾病、肺炎、尿道感染、胃肠炎和败血症。Baker等[16]发现在诊断KD前10 d内,多数患儿有呕吐、腹泻和咳嗽等非特异性感染症状,提示感染可能是KD的触发因素。本研究2 331例KD患儿中,57.1%(1 131例)的患儿合并感染,最常见为呼吸系统感染,其次为消化系统感染;病原实验室检测提示MP感染最常见,其次为EBV感染,提示感染可能与KD相关。
目前KD并发冠状动脉病变的发病机制尚未完全清楚,多数学者认为KD在急性期存在免疫系统高度活化,T、B细胞及单核/巨噬细胞过度激活,激活的效应细胞可释放多种细胞因子,包括IFN-γ、IL-1、IL-6、TNF-α等,导致血管内皮细胞的激活和损伤[17],血管内皮功能障碍,造成血管基底膜、内弹力膜破坏,中膜变薄,内皮细胞及平滑肌细胞凋亡和迁移,加之成纤维细胞的增殖,导致血管重建,进而冠状动脉扩张、动脉瘤形成,晚期可发生血管狭窄甚至阻塞,发生心肌缺血[18,19]。本研究MP感染及消化系统感染伴发腹泻的发生率冠状动脉病变组高于非冠状动脉病变组,提示KD合并MP感染及消化系统感染伴发腹泻的患儿易发生冠状动脉病变。
MP感染是儿童呼吸道感染的常见病因,MP感染不仅损害呼吸系统,常有肺外脏器受累,导致神经、心血管和血液系统等多系统损害。1996年,Leen等[20]首次报道MP感染可能与KD有关。Ebrahim 等[21]和Lee等[22]均报道了KD合并MP感染的病例。有文献报道MP可致人单核细胞、T细胞和巨噬细胞等免疫细胞过度释放,并释放IL-6、TNF-α等多种细胞因子,进而介导机体炎症反应及冠状动脉损伤的发生[22]。本研究中冠状动脉病变组MP感染率明显高于非冠状动脉病变组,进一步提示KD合并MP感染的患儿易发生冠状动脉病变。
本研究中消化系统感染伴发腹泻的KD
患儿冠状动脉病变的发生率高,考虑感染性腹泻的患儿多为肠道病毒如轮状病毒感染,而有文献报道轮状病毒与KD相关。但本研究两组比较的P值(0.047)处于为临界值,此结果是否具有临床意义有待于进一步研究证实。
[1]Duan C, Du ZD, Wang Y, et al. Effect of pravastatin on endothelial dysfunction in children with medium to giant coronary aneurysms due to Kawasaki disease. World J Pediatr, 2014,10(3):232-237
[2]Makino N, Nakamura Y, Yashiro M, et al. Descriptive epidemiology of Kawasaki disease in Japan,2011-2012: from the results of the 22nd nationwide survey. J Epidemiol, 2015,25(3): 239-245
[3]Kim GB,Park S,Kwon BS,et al.Evaluation of the temporal association between Kawasaki disease and viral infections in South Korea. Korean Circ J, 2014,44(4):250-254
[4]Tsai HC, Chang LY, Lu CY, et al. Transmission of acute infectious illness among cases of Kawasaki disease and their household members. J Formos Med Assoc, 2015,114(1):72-76
[5]Bajolle F, Meritet JF, Rozenberg F, et al. Markers of a recent bocavirus infection in children with Kawasaki disease: "a year prospective study". Pathol Biol (Paris), 2014,62(6):365-368
[6]Tremoulet AH, Jain S, Jaggi P, et al. Infliximab for intensification of primary therapy for Kawasaki disease: a phase 3 randomised, double-blind, placebo-controlled trial. Lancet, 2014, 383(9930):1731-1738
[4]JCS Joint Working Group. Guidelines for diagnosis and management of cardiovascular sequelae in Kawasaki disease (JCS 2013). Digest version.Circ J, 2014,78(10):2521-2562
[8]de Zorzi A, Colan SD, Gauvreau K, et al. Coronary artery dimensions may be misclassified as normal in Kawasaki disease. J Pediatr, 1998, 133(2):254-258
[9]Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: A statement for health professionals from committee on rheumatic fever, endocarditis, and Kawasaki disease, council on cardiovascular disease in the young, American Heart Association. Circulation, 2004, 110(17): 2747-2771
[10]Principi N, Rigante D, Esposito S. The role of infection in Kawasaki syndrome. J Infect, 2013,67(1):1-10
[11]Pavone P, Cocuzza S, Passaniti E, et al. Otorrhea in Kawasaki disease diagnosis complicated by an EBV infection: coincidental disease or a true association. Eur Rev Med Pharmacol Sci, 2013,17(7):989-993
[12]Jaggi P, Kajon AE, Mejias A, et al. Human adenovirus infection in Kawasaki disease: a confounding bystander? Clin Infect Dis, 2013,56(1):58-64
[13]Shirato K, Imada Y, Kawase M, et al.Possible involvement of infection with human coronavirus 229E, but not NL63, in Kawasaki disease. J Med Virol, 2014,86(12):2146-2153
[14]Huang X, Huang P, Zhang L, et al. Influenza infection and Kawasaki disease. Rev Soc Bras Med Trop, 2015,48(3):243-248
[15]Benseler SM, McCrindle BW, Silverman ED, et al. Infections and Kawasaki disease: implications for coronary artery outcome. Pediatrics, 2005,116(6):e760-766
[16]Baker AL, Lu M, Minich LL, et al. Associated symptoms in the ten days before diagnosis of Kawasaki disease. J Pediatr, 2009,154(4):592-595
[17]Duan C (段超), Du ZD. Endothelial progenitor cells and the neovascularization in patients with coronary aneurysms due to Kawasaki disease. Chin J Pediatr (中华儿科杂志), 2011,49(5):397-400
[18]To L, Krazit ST, Kaye AD. Perioperative considerations of kawasaki disease. Ochsner J, 2013,13(2): 208-213
[19]Shi CP (史翠平), Zhang HY. Association of single nucleotide polymorphism in TGFBR2 gene with Kawasaki disease and coronary artery lesions. Chin J Contemp Pediatr (中国当代儿科杂志), 2013,15(9):767-770[20]Leen C, Ling S. Mycoplasma infection and Kawasaki disease. Arch Dis Child, 1996,75(3):266-267
[21]Ebrahim M, Gabay M, Rivas-Chacon RF. Evidence of acute mycoplasma infection in a patient with incomplete and atypical Kawasaki disease: a case report. Case Rep Med, 2011,2011:606920
[22]Lee MN, Cha JH, Ahn HM, et al. Mycoplasma pneumoniae infection in patients with Kawasaki disease. Korean J Pediatr, 2011,54(3):123-127
(本文编辑:张崇凡)
Influence of infection on Kawasaki disease and coronary artery lesions
ZHAOChun-na,DUZhong-dong
(DepartmentofCardiology,BeijingChildren′sHospital,CapitalMedicalUniversity; 2KeyLaboratoryofMajordiseasesinChildhood,MinistryofEducation,Beijing100045,China)
DU Zhong-dong,E-mail:duzhongdong@126.com,
ObjectiveTo explore the influence of infection on Kawasaki disease (KD) and coronary artery lesions.MethodsWe retrospectively reviewed the clinical records of patients with KD treated at Beijing Children′s Hospital, Capital Medical University from January 2005 to December 2014, the intercepted demographic information, clinical findings, echocardiography findings of acute and sequelae phase and outcomes. The typical KD, incomplete KD, IVIG resistance, the degree of coronary artery lesions and co-infection were re-screened for each case. The differences of clinical manifestations were analyzed between the infected group and non-infected group. The differences of infections were analyzed between the coronary artery lesions group and non-coronary lesions group.ResultsThe proportion of KD combined with infection and KD combined with coronary artery lesions was 57.1% (1331/2 331) and 36.0%(840/2 331), respectively. There were significant differences in age, length of fever (days) and incomplete KD. There were significant differences in mycoplasma pneumoniae infection and gastrointestinal infections associated with diarrhea between the coronary artery lesions group and non-coronary lesions group (Pvalues were 0.004 and 0.047, respectively).ConclusionThis study showed that KD children with infection were common in patients below 1 year old and characterized by incomplete KD. KD children with mycoplasma pneumoniae infection and gastrointestinal infection associated with diarrhea were prone to develop coronary artery lesions.
Kawasaki disease; Infection; Coronary artery lesions
国家自然基金面上项目:81274109,30973238;北京自然科学基金B 类/北京教育委员会重大科研项目:KZ201010025024;北京市教育委员会科技创新平台项目:PXM2011_014226_07_000085
首都医科大学附属北京儿童医院心脏中心,教育部儿科重大疾病重点实验室(首都医科大学) 北京,100045
杜忠东,E-mail:duzhongdong@126.com
10.3969/j.issn.1673-5501.2015.06.011
2015-07-17
2015-11-16)
