1-磷酸鞘氨醇对原代骨髓间充质干细胞增殖和分化的影响*
2015-05-03徐秀秀
陆 伟 ,林 婧 ,徐秀秀 ,桂 鸣
(1.南京医科大学,江苏 南京 210029; 2.泰山医学院附属医院,山东 泰安 271000)
骨髓间充质干细胞(BM-MSCs)近来被广泛用于治疗缺血性心脏病[1-2]。前期研究证实,与反复传代的骨髓间充质干细胞相比,原代骨髓间充质干细胞(PR-MSCs)在小鼠急性心肌梗死后具有更好的心肌修复作用及更强的心功能改善能力,但细胞没有经过反复传代扩增,获得的细胞数量不足[3-4]。因此,要想在临床应用 PR-MSCs,应寻找一种途径来获得更多的种子细胞[5-6]。1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)由鞘氨醇激酶(sphingosine kinase,SPK)催化鞘氨醇(sphingosine,Sp)生成[7],既是细胞内信号转导的第二信使分子,又可分泌至细胞外,与受体结合后激活 ERK/MAPK,PI3K-Akt等信号途径,从而调节细胞增殖、迁移等生物学效应,并介导血管生成、炎症反应等病理生理过程[8-9]。因此,本研究中利用 S1P预处理 PR-MSCs,期望 S1P能促进PR-MSCs增殖,在体外能得到数量足够的PR-MSCs用于移植,发挥修复损伤心肌、改善心脏功能的作用,同时研究S1P促进PR-MSCs增殖与分化的作用机制。现报道如下。
1 材料与方法
1.1 材料
除特别说明外,本研究中使用的试剂和耗材均来自Life Technologies,R&D,Millipore and Biolnd。用于分离培养骨髓间充质干细胞C57BL/6J野生型小鼠,购自南京医科大学医学动物中心。
1.2 方法
PR-MSCs的分离培养与S1P预处理:取C57BL/6J野生型小鼠,断颈处死,取双侧股骨和胫骨。用注射器缓慢将骨髓冲进试管,制备骨髓单细胞悬液。扩增培养于加入10%胎牛血清的DMEM中,置培养箱中。培养1 d后,将非贴壁细胞悬浮,移入另一培养皿中,按同样的方法反复转移4次。在移去非贴壁细胞后的贴壁细胞培养皿中加入新鲜培养液,继续培养至第10天止,得到 PR-MSCs。
分组:S1P预处理组(S1P-PR-MSCs),在种子细胞贴壁后,于培养液中加入 1 μmol/L S1P。对照组(PR-MSCs),细胞无药物干预。
流式细胞技术鉴定PR-MSCs表面抗原:干细胞通过针对CD29,CD34,CD45和 CD90特异性的 FITC结合抗体标记,通过 FACSCalibur体系(BD,San Jose,CA)进行处理。一抗为 Anti-Integrin beta 1 antibody[MEM-101A](FITC)(Abcam,ab21845),Anti-CD34antibody[4H11[APG]](FITC)(Abcam,ab18227),Anti-CD451 antibody[A20](FITC)(Abcam,ab24917),Anti-CD90/Thy1antibody[FITC.MRCOX-7](FITC)(Abcam,ab226).
S1P对PR-MSCs的细胞毒性测定:收集对数期细胞,分于96 孔板,1×104/孔,加入不同质量浓度的药物(0.09,0.27,0.81,2.43,7.29,21.9,61.5 μg /mL),处理 3 d,每孔加入 180 μL新鲜培养液,再加入 20 μL 四甲基偶氮唑盐(MTT)溶液(5 g /L,即0.5%MTT),继续培养 4 h 后终止培养,离心(1000 r/min,10 min),小心地吸去孔内培养液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪490 nm波长处测量各孔的吸光度,同时设置调零孔(培养基、MTT、二甲基亚砜)、对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜),每组设定3复孔。
PR-MSCs增殖检测:将PR-MSCs和S1P-PR-MSCs分别于 24,48,72 h时进行收集,采用 CCK-8测定法(YEASEN)进行细胞增殖的分析。
逆转录聚合酶链式反应(RT-PCR):所有的RNA由RNeasy小型试剂盒(Qiagen)收集的样品提取。使用PrimeScript®RT试剂盒(Perfect Real Time,TaKaRa)进行反转录。PT-PCR 反应使用SYBR®Premix ExTaqTMⅡ(Perfect Real Time,TaKaRa)和 7500 Real-Time PCR System(Applied Biosystems)进行。对于每个样品,循环阈(CT)由于次重复试验获得。靶基因的相对表达水平使用的2-ΔΔCT方法进行分析。

表1 引物设计
蛋白免疫印迹(Western Blot)测定:细胞提取物和培养基的制备如先前所述,提取蛋白,于10%SDS-PAGE凝胶中进行电泳,转移至硝酸纤维素膜,并在4℃含5%BSA的磷酸盐缓冲液(PBS)温育过夜。一抗为 Anti-AKT1(phospho S473)antibody(Abcam,ab66138), Anti-Erk1(pT202/pY204)+Erk2(pT185/pY187)antibody(Abcam,ab76165)。用单克隆抗体(Sigma,T5201)测定 β 微管蛋白的表达水平。
1.3 统计学处理
采用SPSS 19.0统计学软件进行分析。RT-PCR相关数据以均数±标准差(±s)表示,行 t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 S1P对PR-MSCs无细胞毒性
根据相应的S1P质量浓度绘制出对数浓度抑制率散点图(图 1A),根据计算公式绘制出终质量浓度抑制回归曲线图(图 1B)。结果表明试验质量浓度(1 μg/mL)S1P 对细胞的生长无明显毒性影响。

表2 S1P促进PR-MSCs增殖的研究结果(%)
2.2 S1P促进PR-MSCs的增殖
结果见表 2和图 2。PR-MSCs的增殖活性经S1P预处理后显著增强。
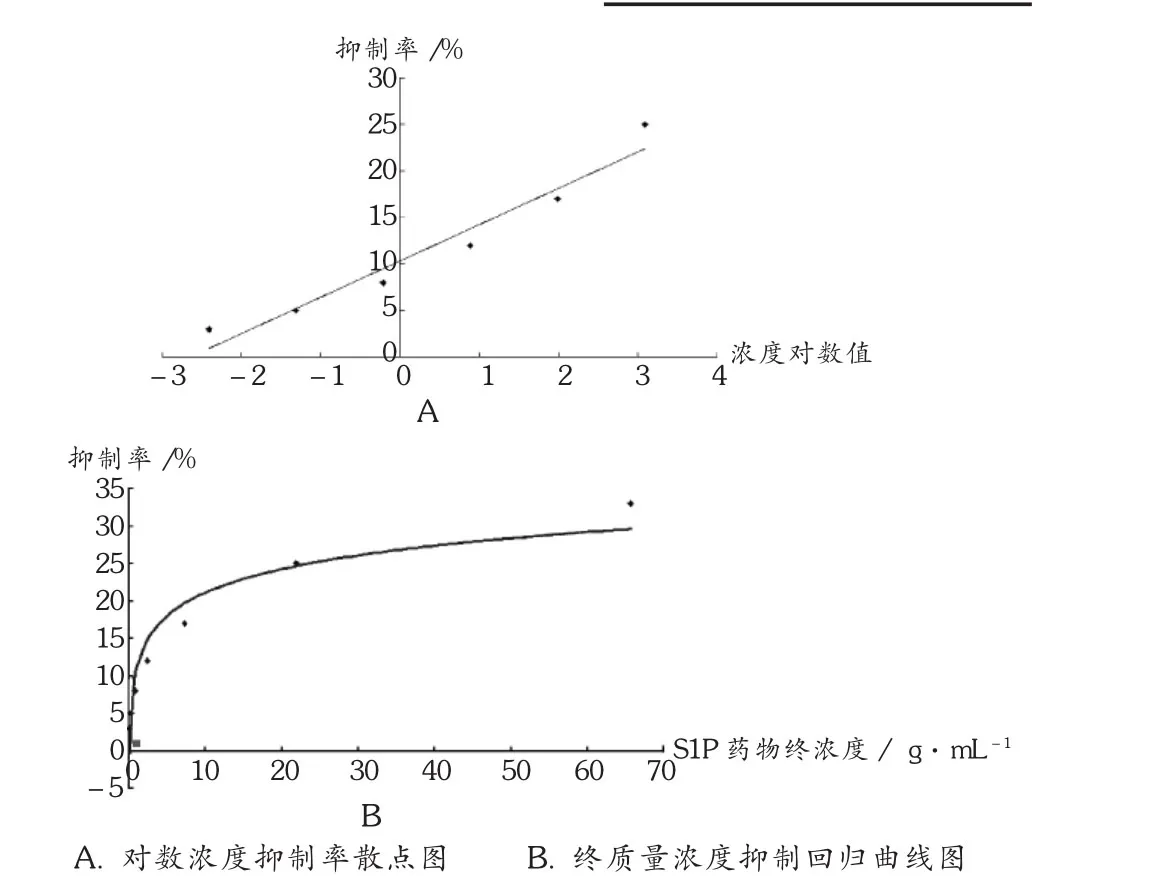
图1 试验质量浓度下S1P对PR-MSCs的作用
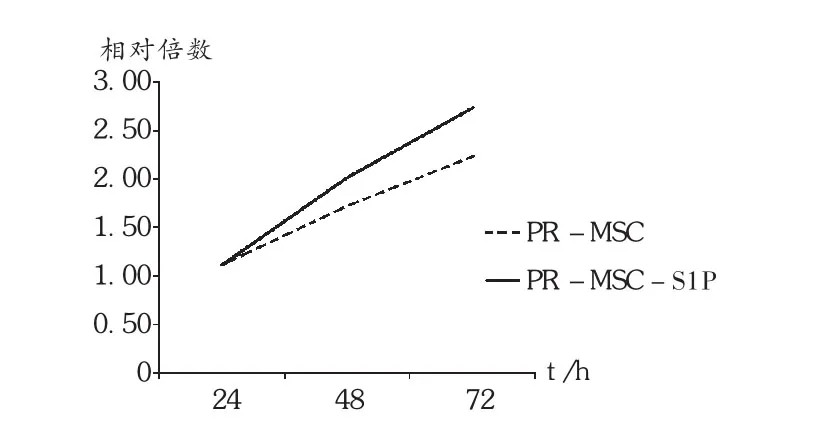
图2 S1P对PR-MSCs增殖的促进作用
对经VEGF诱导7d的PR-MSCs中内皮细胞特异性表达基因的检测,结果表明,与对照组相比,S1P-PR-MSCs组中表达VEGF的 mRNA和 Angiopointin-1在一个较高的水平(图 3A,3B),S1P可促进PR-MSCs分化为内皮细胞。
2.3 S1P促进PR-MSCs经VEGF诱导为内皮细胞

B.Angiopointin-1 mRNA相对表达倍数图3 S1P对PR-MSCs经VEGF诱导为内皮细胞的促进作用
2.4 S1P对PR-MSCs增殖分化影响的信号通路
在两组PR-MSCs中检测到P-ERK1/2和P-AKT的存在,比较发现,处理组中 P-ERK1/2高表达于 S1P-PR-MSCs组,但P-AKT组间没有显著性差异(图4)。这表明S1P可能通过ERK通路影响PR-MSCs的增殖和分化。

图4 P-ERK1/2的表达检测
3 讨论
骨髓间充质干细胞可以分化为血管内皮细胞和心肌细胞,从而修复损伤的心肌并改善心功能,因此在体外高效率地获得骨髓间充质干细胞以供临床应用尤为重要[10]。反复传代的骨髓间充质干细胞在心肌修复中的作用并不十分显著[11-12],PR-MSCs在改善小鼠心肌梗死后心功能方面具有更好的表现。但种子细胞没有经过反复传代扩增,获得的细胞数量不足[13]。动物试验可通过取更多的骨髓来解决,但临床患者的骨髓有限,故PR-MSCs要想在临床推广,还应寻找一种途径来获得更多的种子细胞。另外,移植的干细胞绝大部分会死亡,在心脏原位表达很少,因此限制了干细胞修复坏死心肌的作用[14-15]。
S1P是一种与细胞生命活动密切相关的物质,有刺激细胞生长、抑制细胞凋亡的作用。VEGF是促进血管生长最有效的细胞因子,通过对经VEGF诱导7 d后S1P-PR-MSCs组高表达内皮细胞相关基因的研究,表明经S1P处理的PR-MSCs更易内皮化。S1P与受体的结合,可激活ERK/MAPK和 PI3K-Akt信号通路,具有调节细胞增殖、迁移及其他生物作用,如血管生成和炎症过程。笔者发现,S1P-PR-MSCs中的 P-ERK1/2被激活显著,但不是P-AKT,表明S1P通过ERK信号通路促进 PR-MSCs的增殖和分化。
由本研究可见,S1P能促进PR-MSCs增殖、分化为血管内皮细胞,还可能通过ERK通路影响PR-MSCs的旁分泌,并发挥作用。这将促进PR-MSCs的临床应用,以及对S1P作用机制的了解。临床心血管病,(电子信箱)luweixnk@ 163.com;桂鸣(1957-),男,博士研究生,主任医师,硕士研究生导师,研究方向为心力衰竭、冠状动脉粥样硬化性心脏病及妇女心脏病,本文通讯作者,(电子信箱)guimingsrm@ 163.com。
参考文献:
[1]TongersJ,LosordoDW,LandmesserU.Stem and progenitorcellbased therapy in ischaemic heart disease: promise, uncertainties, and challenges[J].European Heart Journal,2011,32(10):1 197-1 206.
[2]Orlic D,Kajstura J,Chimenti S,et al.Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J].Proc Natl Acad Sci USA,2001,98(18):10 344-10 349.
[3]Shiota M,Heike T,Haruyama M,et al.Isolation and characterization of bone marrow-derived mesenchymal progenitor cells with myogenic and neuronal properties[J].Exp Cell Res,2007,313(5):1 008-1 023.
[4]Zhou L,Ma W,Yang Z,et al.VEGF165 and angiopoietin-1 decreased myocardium infarct size through phosphatidylinositol-3 kinase and Bcl-2 pathways[J].Gene Therapy,2005,12(3):196-202.
[5]Jin J,Zhao Y,Tan X,et al.An improved transplantation strategy for mouse mesenchymal stem cells in an acute myocardial infarction model[J].PloS One,2011,6(6):e21 005.
[6]Hait NC,Oskeritzian CA,Paugh SW,et al.Sphingosine kinases,sphingosine-1-phosphate,apoptosis and diseases[J].Biochim Biophys Acta,2006,1 758(12):2 016-2 026.
[7]Jin ZQ,Goetzl EJ,Karliner JS.Sphingosine kinase activation mediates ischemic preconditioning in murine heart[J].Circulation,2004,110(14):1 980-1 989.
[8]Li QF,Wu CT,Guo Q,et al.Sphingosine-1-phosphate induces mcl-1upregulation and protects multiple myeloma cells against apoptosis[J].Biochem Biophys Res Commun,2008,371(1):159-162.
[9]Gnocchi M,He H,Noiseux N,et al.Evidence supporting paracrine hypothesis forAkt-modified mesenchymal stem cell-mediated cardiac protection and functional improvement[J].Faseb J,2006,20(6):661-669.
[10]Hipp J,Atala A.Tissue engineering,stem cells,cloning,and parthenogenesis:new paradigms for therapy[J].J Exp Clin Assist Reprod,2004,1(1):3.
[11]Singleton PA,Dudek SM,Chiang ET,et al.Regulation of sphingosine-1-phosphate-induced endothelial cytoskeletal rearrangement and barrier enhancement by S1P1 receptor, PI3 kinase, Tiam1 /Rac1, and alpha-actinin[J].Faseb J,2005,19(12):1 646-1 656.
[12]Theilmeier G,Schmidt C,Herrmann J,et al.High-density lipoproteins and their constituent,sphingosine-1-phosphate,directly protect the heart against ischemia/reperfusion injury in vivo via the S1P3 lysophospholipid receptor[J].Circulation,2006,114(13):1 403-1 409.
[13]Li RK,Mickle DA,Weisel RD,et al.Optimal time for cardiomyocyte transplantation to maximize myocardial function after left ventricular injury[J].Ann Thorac Surg,2001,72(6):1 957-1 963.
[14]Yang ZJ,Ma DC,Wang W,et al.Experiment study of bone marrow-derived mesenchymal stem cells combined with hepatocyte growth factor transplantation[J].Gene Therapy,2006,13(22):1 564-1 568.
[15]López-De León A,Rojkind M.A simple micromethod for collagen and total protein determination in formalin-fixed paraffin-embedded sections[J].J Histochem Cytochem,1985,33(8):737-743.
