生长抑素联合奥美拉唑治疗急性胰腺炎的系统评价
2015-05-03米婷婷范开华张育勤任建东
米婷婷 ,范开华 ,张育勤 ,任建东
(1.中国人民解放军成都军区总医院药剂科,四川 成都 610083; 2.泸州医学院药学院,四川 泸州 646000)
急性胰腺炎(acute pancreatitis,AP)预后差,病死率可高达30% ~40%[1-2],严重威胁患者生命,且目前尚无特别有效的治疗方法[3-5]。生长抑素是一个对外分泌、内分泌、旁分泌及自分泌均起作用的调节肽,能有效控制胰酶分泌及合成,降低胰酶含量,保护胰腺细胞,稳定溶酶体膜,抑制血小板活化因子释放,减少并发症,目前已在国内广泛用于AP和胰腺炎术后并发症的防治。重症急性胰腺炎(SAP)中西医结合诊治常规(草案)中也推荐使用生长抑素[6]。Andriulli等[7]的荟萃分析结果证实,生长抑素可降低SAP的总病死率。奥美拉唑是强有力的质子泵抑制剂,其抑酸作用使因盐酸作用而引起的促胰液素、胆囊收缩素促进胰液分泌作用减弱,从而使由神经性分泌和体液分泌两大途径[8]引起的胰液分泌减少、胰酶活性降低,保护胰腺细胞,使胰腺炎症状减轻。目前,关于生长抑素联合奥美拉唑治疗AP,尚无有效的系统评价。现对生长抑素联合奥美拉唑治疗AP的临床疗效进行系统评价,报道如下。
1 资料与方法
1.1 纳入与排除标准
研究类型:随机对照试验(RCT),无论是否采用盲法及分配隐藏;文种限中、英文。研究对象:纳入符合2004年中华医学会消化病分会胰腺疾病学组制订的《中国急性胰腺炎诊治指南》中诊断标准[9]。排除标准:年龄小于18岁;妊娠、哺乳期;进行外科手术治疗;入院距发病时间超过72 h,治疗期间自动转院、出院、放弃治疗;有明显过敏体质或明确药物过敏史;已用过生长抑素、奥曲肽、奥美拉唑;有胰腺假性囊肿、胰腺脓肿等局部并发症;合并心、肺、肝、肾和造血系统严重原发性疾病、精神病患者。干预措施:试验组在常规治疗基础上加用生长抑素与奥美拉唑,不限制生长抑素、奥曲肽及奥美拉唑的剂型、剂量、给药次数及疗程;对照组给予常规治疗,包括抗休克治疗、禁食、胃肠减压、抗感染,以及镇静、解痉、止痛处理等。观察指标:AP相关病死率;并发症发生率;临床综合有效率;住院时间;血淀粉酶恢复时间;腹痛腹胀缓解时间。文献排除标准:缺失重要研究数据的文献;缺失主要结局指标数据的文献;无可用信息的文献。
1.2 检索策略
计算机检索中国期刊全文数据库(CNKI,1990至2014年)、中文科技期刊数据库(VIP,1989至2014年)、中国生物医学文献数据库(CBM,1990 至 2014 年)、PubMed(1980 至 2014 年)、万方数据库(WanFang Data,1990 至 2014 年)、Medline(1990 至 2014年)。中文检索词包括:奥美拉唑、洛赛克、生长抑素、奥曲肽、善宁、善得定、质子泵抑制剂、胰腺炎;英文检索词包括:omeprazole,Losec, somatostatin, sandostatin, octreotide, proton pump inhibitor,pancreatitis,并结合不同的检索方式。
1.3 文献筛选、资料提取及质量评价
由2位评价者根据纳入与排除标准独立筛选文献、提取资料,不作交叉核对,如有分歧,请第三方讨论解决。选择文献时,首先阅读问题及摘要,排除不符合纳入标准的文献,通读可能符合纳入标准的文献全文,以确定是否纳入。随后提取纳入文献的相关资料,参照 Cochrane Reviewer′s Handbook[10]质量评价标准进行试验质量评估。2位研究者根据以上评价标准对每篇符合纳入标准的文献进行方法学质量评价。按照预先设计好的资料提取表,由2名评价者独立提取和录入资料,主要内容包括文章题目、作者、发表时间、诊断标准、研究方法、干预措施、结局指标、是否采用分配隐藏、有无退出等。1.4 统计学分析
采用 Cochrane协作网提供的 RevMan5.2软件进行 Meta分析。计数资料采用相对风险率(RR)为分析统计量,计量资料采用均数差(MD)为分析统计量,各效应量均以 95%CI表示[11]。纳入研究首先进行异质性检验,若各研究结果间有统计学同质性(P>0.1,I2≤50%)时,采用固定效应模型进行 Meta分析;当各研究结果间存在统计学异质性(P≤0.1,I2>50%)时,先分析其异质性来源,对可能导致异质性的因素进行亚组分析,去除异质性。若各研究存在统计学异质性而无临床异质性或差异无临床意义时,可进行合并,应用随机效应模型进行Meta分析;如各组间异质性过大,则采用描述性分析。对因研究方法学不同导致的异质性,采用敏感性分析检验结果的稳定性,剔除权重最大的研究后对Meta分析结果的稳定性进行评价。
2 结果
2.1 文献检索结果
初检出文献181篇,通过阅读文题、摘要及全文,排除不符合纳入标准的177篇,最终纳入4项研究[12-15],均为中文文献,患者共计464例,治疗组和对照组各232例。纳入的4个RCT一般情况见表1。

表1 纳入试验的一般情况
2.2 质量评价
纳入的4个 RCT中均提及“随机”二字,但只有1个研究[14]描述了具体的随机方法,为随机数字表法;均未描述分配隐藏和盲法,未提及是否进行了ITT分析;退出/失访情况、选择性结果报告、其他偏倚评价结果均为“无”;均进行了基线可比性检验(P>0.05)。由于纳入研究 RCT质量均不高,故未能进行敏感性分析。
2.3 Meta分析
治疗有效率:4项研究治疗结束后均采用了治疗总有效作为疗效判定指标,且判定有效的指标一致。异质性检验结果显示,各试验结果间无异质性(P=1.00,I2=0%),可采用固定效应模型进行数据合并。Meta分析结果显示,试验组的治疗有效率(217/232,93.53% )明显高于对照组(165 /232,71.12% ),差异具有统计学意义[RR = 1.32,95%CI(1.20,1.44),P< 0.000 01]。见图 1。
并发症发生率:4项研究均有报道,且并发症均为胰腺假性囊肿、肺部感染和腹腔脓肿。异质性检验结果显示,各试验结果间无异质性(P=0.48,I2=0%),故按照固定效应模型进行Meta分析。结果显示,试验组并发症发生率(11/232,4.74%)明显低于对照组(67 /232,28.88% ),差异具有统计学意义[RR =0.16,95%CI(0.09,0.30),P< 0.000 01] 。见图 2。
病死率:4项研究均有报道。异质性检验结果显示,各试验结果间无异质性(P=0.55,I2=0%),故按照固定效应模型进行Meta 分析。结果显示,试验组病死率(8 /232,3.45% )低于对照组(22 /232,9.48% ),差异有统计学意义[RR = 0.36,95%CI(0.17,0.80),P = 0.01]。见图 3。
平均住院时间:4项研究均有记录。异质性检验结果显示,各试验结果间无异质性(P=0.99,I2=0%),故按照固定效应模型进行Meta分析。结果显示,试验组的平均住院时间低于对照组,差异具有统计学意义[MD-4.82,95%CI(-5.20,-0.44),P< 0.000 01]。见图 4。
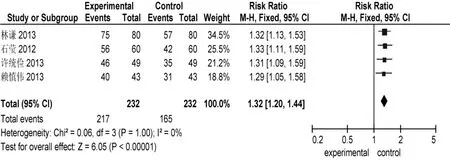
图1 治疗有效率的Meta分析

图2 并发症发生率的Meta分析

图3 病死率的Meta分析
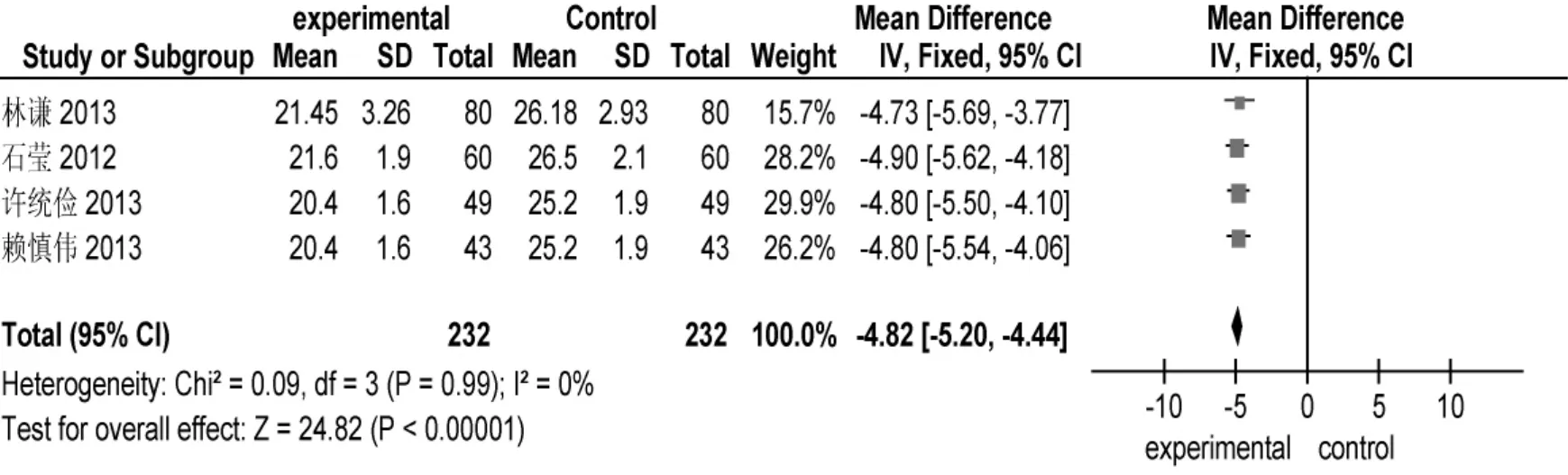
图4 平均住院时间的Meta分析
腹痛腹胀缓解时间:4项研究均有记录。异质性检验结果显示,各试验结果间存在异质性(P=0.002,I2=80%),故采用随机效应模型。Meta分析结果显示,试验组腹痛腹胀缓解时间低于对照组,差异具有统计学意义[MD-1.63,95%CI(-2.08,-1.18),P< 0.000 01]。见图 5。
血淀粉酶恢复时间:4项研究均有记录。异质性检验结果显示,各试验结果间存在异质性(P=0.005,I2=76%),故采用随机效应模型。Meta分析结果显示,试验组血淀粉酶恢复时间短于对照组,差异具有统计学意义[MD-3.20,95%CI(-3.76,-2.64),P< 0.000 01]。见图 6。

图5 腹痛腹胀缓解时间的Meta分析
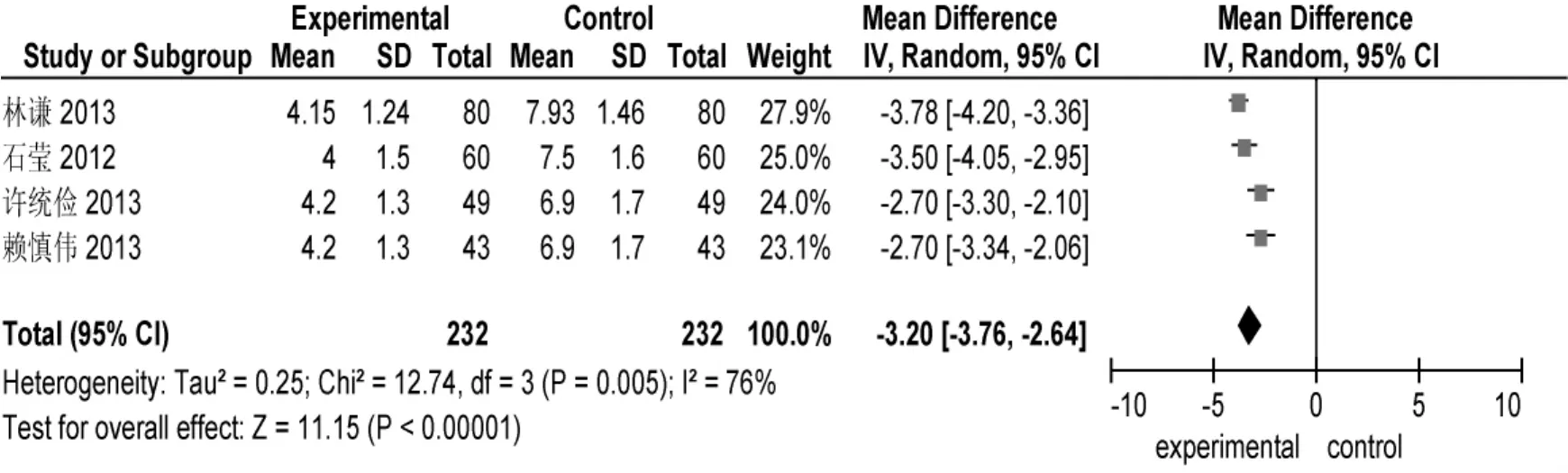
图6 血淀粉酶恢复时间的Meta分析
3 讨论
本研究结果表明,生长抑素联合奥美拉唑在改善AP患者的有效率、并发症发生率、病死率、平均住院时间、腹痛腹胀缓解率和血淀粉酶恢复时间等方面明显优于常规治疗。
本系统评价中纳入研究的文献虽发表时间均较近,但质量普遍较低,仅1篇[14]文献采用随机数字表法,其余文献均无具体的随机方法,且无文献报道分配隐藏和盲法。4个试验纳入的样本含量低,共纳入464例患者,且均无样本量计算。纳入的试验中,生长抑素与奥美拉唑治疗的剂量、给药方案不同,患者发病至入院的时间也不同,这些因素均可能直接影响疗效。另外,文献报道的随访时间较短,AP患者有两个死亡高峰时间,第一个高峰在发病1周以内,主要死于多器官功能衰竭;另一个高峰为发病3~4周,主要死亡原因是胰腺炎的并发症等所致的多器官功能衰竭。本系统评价所纳入文献数量较少,且均为中文文献,在方法学质量上也存在一定问题,文献质量较低,因此该系统评价的结论论证强度会受到一定程度的影响,有待今后更多大样本高质量的RCT结论加以佐证。
参考文献:
[1]Agapov MA,Khoreva MV,Gorskiǐ VA.The systemic inflammatory response syndrome correction in acute destructive pancreatitis[J].Eksp Klin Gastroenterol,2011(7):18-23.
[2]Gukovsky I, Pandol SJ, Gukovskaya AS.Organellar dysfunction in the pathogenesis of pancreatitis[J].Antioxid Redox Signal,2011,15:2 699-2 710.
[3]Sargen K,Kingsnorth AN.Acute pancreatitis:an overview of emerging pharmacotherapy[J].Bio Drugs,1998,10:359-371.
[4]Navicharern P,Wesarachawit W,Sriussadaporn S,et al.Management and outcome of severe acute pancreatitis[J] .J Med Assoc Thai, 2006, 89(Suppl 3):S25-S32.
[5]Pezzilli R,Uomo G,Gabbrielli A,et al.A prospective multicentre survey on the treatment of acute pancreatitis in Italy[J].Dig Liver Dis,2007,13:794-802.
[6]中国中西医结合学会普通外科专业委员会.重症急性胰腺炎中西医结合诊治常规(草案)[J].中国危重病急救医学,2007,19(8):448-451.
[7]Andriulli A,Leandro G,Clemente R,et al.Meta-analysis of somatostatin,octreotide and gabexate mesilate in the therapy of acute pancreatitis[J].Aliment Pharmacol Ther,1998,12(3):237-245.
[8]姚 泰,乔健天 .生理学[M].第 5版.北京:人民卫生出版社,2001:191-194.
[9]中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].中华内科杂志,2004,43(3):236-238.
[10]Higgins J,Green S.Cochrane handbook for systematic reviews of interventions version 5.1.0.New York:Wiley,2011[EB /OL].[2011-08-01].http: //www.cochrane-handbook.org.
[11]文 进,李幼平.Meta分析中效应尺度指标的选择[J].中国循证医学杂志,2007,7(8):606-613.
[12]赖慎伟,张 旭,朱树生.奥美拉唑联合生长抑素治疗重症胰腺炎的临床疗效观察[J].中国医学创新,2013,10(28):126-128.
[13]许统俭,王 营.生长抑素联合奥美拉唑治疗重症胰腺炎的疗效[J].中国老年学杂志,2013,33(23):6 025-6 026.
[14]石 莹.生长抑素与奥美拉唑联合治疗重症急性胰腺炎的临床疗效[J].肝胆外科杂志,2013,20(6):417-419.
[15]林 谦,伍俊妍.生长抑素与洛赛克联合治疗重症急性胰腺炎的临床疗效[J].临床医学工程,2013,20(7):857-858.
