阿托伐他汀联合胺碘酮治疗原发性高血压并阵发性心房颤动50例
2015-05-02翟雨佳崔欣欣
苗 阳,刘 娜,舒 景,翟雨佳,崔欣欣
(河北省正定县人民医院,河北 石家庄 050800)
阵发性心房颤动(paroxysmal atrial fibrillation,PAF)是原发性高血压患者常见的并发症,能降低心脏储备、促进血栓形成、增加中风危险,还可引起左心房扩大以及左心收缩功能不全[1]。胺碘酮是临床最常用的心房颤动复律药物,有效率为60%~80%;三羟基三甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂即他汀类药物可调节脂肪酸的生成,调整心房肌膜离子通道,改变跨膜离子流,使心房肌的电生理特性发生改变[2]。研究表明,阿托伐他汀可降低患者C-反应蛋白(CRP)水平,抑制左心房重构,预防PAF[3]。笔者将阿托伐他汀与胺碘酮二者联合用于原发性高血压并PAF的治疗,现报道如下。
1 资料与方法
1.1 一般资料
选取医院心内科2012年7月至2013年12月收治的原发性高血压伴PAF患者95例,高血压诊断标准依据中国高血压联盟制订的《中国高血压防治指南》标准[4],入院时心室率均欠规则,伴乏力、头晕、心悸或胸痛、呼吸困难等症状;均为原发性高血压患者,高血压病史不少于5年;PAF年发作次数不少于5次、每次发作时间≤7 d,左心房内径(LAD)<45mm,经电复律或药物转为窦性心律者。排除标准:风湿性心瓣膜病;继发性高血压;甲状腺功能亢进;Ⅱ度以上房室传导阻滞及急性心肌梗死(AMI);肿瘤;丙氨酸氨基转移酶(ALT)≥80 U/L;治疗2周未复律,治疗中出现Q-T间期>0.50 s或扭转为室上速者或治疗中转氨酶升高至正常值上限3倍以上的患者。95例患者中,男52例,女43例;年龄52~77岁,平均(63.6±7.5)岁;高血压病程 5~18年,平均(8.7±3.5)年;心功能分级Ⅰ级49例,Ⅱ级46例;合并糖尿病20例。随机分为观察组50例和对照组45例。两组患者性别、年龄、病程、并发症等一般资料见表1,比较无显著性差异(P>0.05),具有可比性。
1.2 治疗方法
患者治疗方案均获得本人知情同意,降压药物选用马来酸依那普利,PAF复律选择电复律或静脉注射胺碘酮。胺碘酮复律具体操作:胺碘酮注射液(上海第一生化药业有限公司,国药准字H31022099,规格为每安瓿150mg)150mg加入0.9%氯化钠注射液20mL中静脉注射10min,然后行微量泵泵注,前6 h 1mg/min,后18 h0.5mg/min,转为窦性心律停止静脉用药;复律后24 h改口服盐酸胺碘酮片(赛诺菲<杭州>制药有限公司,国药准字H19993254,规格为每片 200mg),第 1 周每天 3 次,每次 300mg,第2周每天2次、每次200mg,第3周每天1次、每次200mg,连续6个月。观察组在对照组基础上加服阿托伐他汀片(辉瑞制药有限公司,国药准字J20070061,规格为每片20mg),每日1次,疗程同对照组。
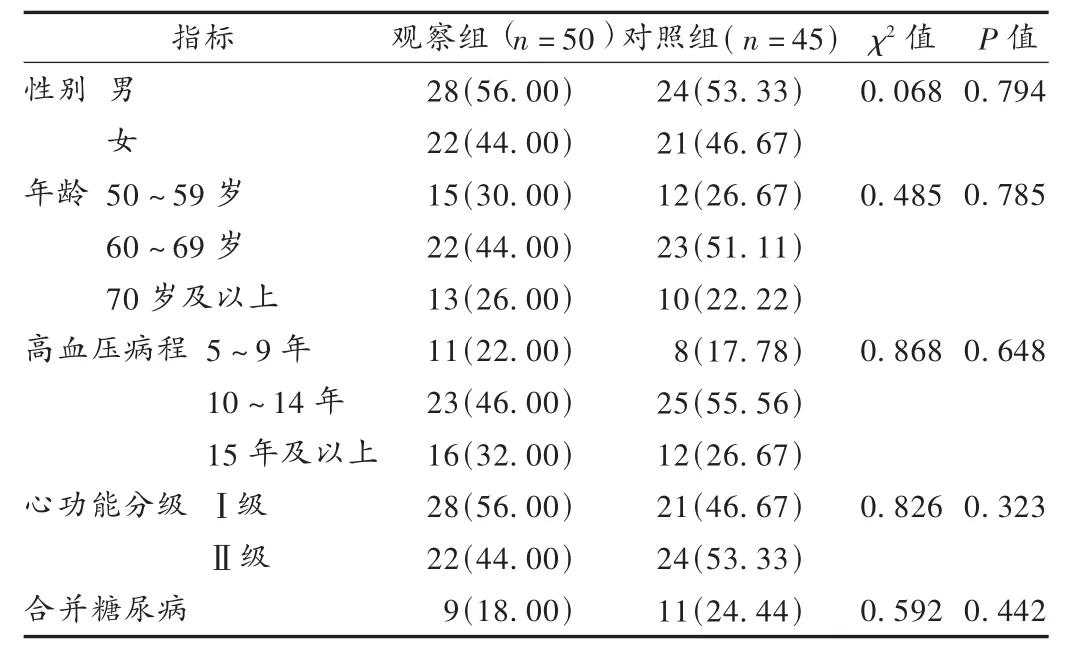
表1 两组患者一般资料比较[例(%)]
1.3 观察指标
左心内径与心功能指标:治疗前后采用Philips IE 33型彩色多普勒超声诊断仪,探头设定频率2.5MHz,测量左室舒张末期内径(LVDD)、收缩末期左房内径(LAD)和左室舒张末期容量(LVEDV)以及左室收缩末期容量 (LVESV),以公式 (LVEDV-LVESV)/LVEDV计算左室射血分数(LVEF)。
理化指标:治疗前后空腹采集静脉血10 mL,采用美国贝克曼5800型全自动生化分析仪测定血清CRP、白细胞介素-6(IL-6)、血管紧张素Ⅱ(AngⅡ)水平,检测均采用酶联免疫吸附法,CRP试剂盒购自上海科兴生物科技有限公司,IL-6与AngⅡ检测试剂盒购自美国R&D公司。
1.4 统计学处理
采用SPSS 17.0软件处理,定量数据用均数±标准差(±s)表示,两样本行 t检验,定性数据采用构成比[例(%)]表示,定性数据行 χ2检验或fisher精确概率法,α取双侧检验。P<0.05表示差异有统计学意义。
2 结果
结果见表2至表4。两组患者治疗过程中未见丙氨酸氨基转移酶(ALT)、促甲状腺释放激素(TSH)明显升高。
表2 两组患者血压比较(±s,mmHg)

表2 两组患者血压比较(±s,mmHg)
组别 SBP DBP P治疗后127.8±8.1 130.4±7.7 1.599 0.113 t值P t值观察组(n=50)对照组(n=45)<0.001<0.001 23.738 21.508 13.087 10.277<0.001<0.001 t值P值治疗前168.2±8.9 166.7±8.3 0.847 0.399治疗前98.2±6.5 97.1±6.0 0.854 0.395治疗后82.2±5.7 84.1±6.0 1.582 0.117
表3 两组患者心脏彩超与理化指标比较(±s)
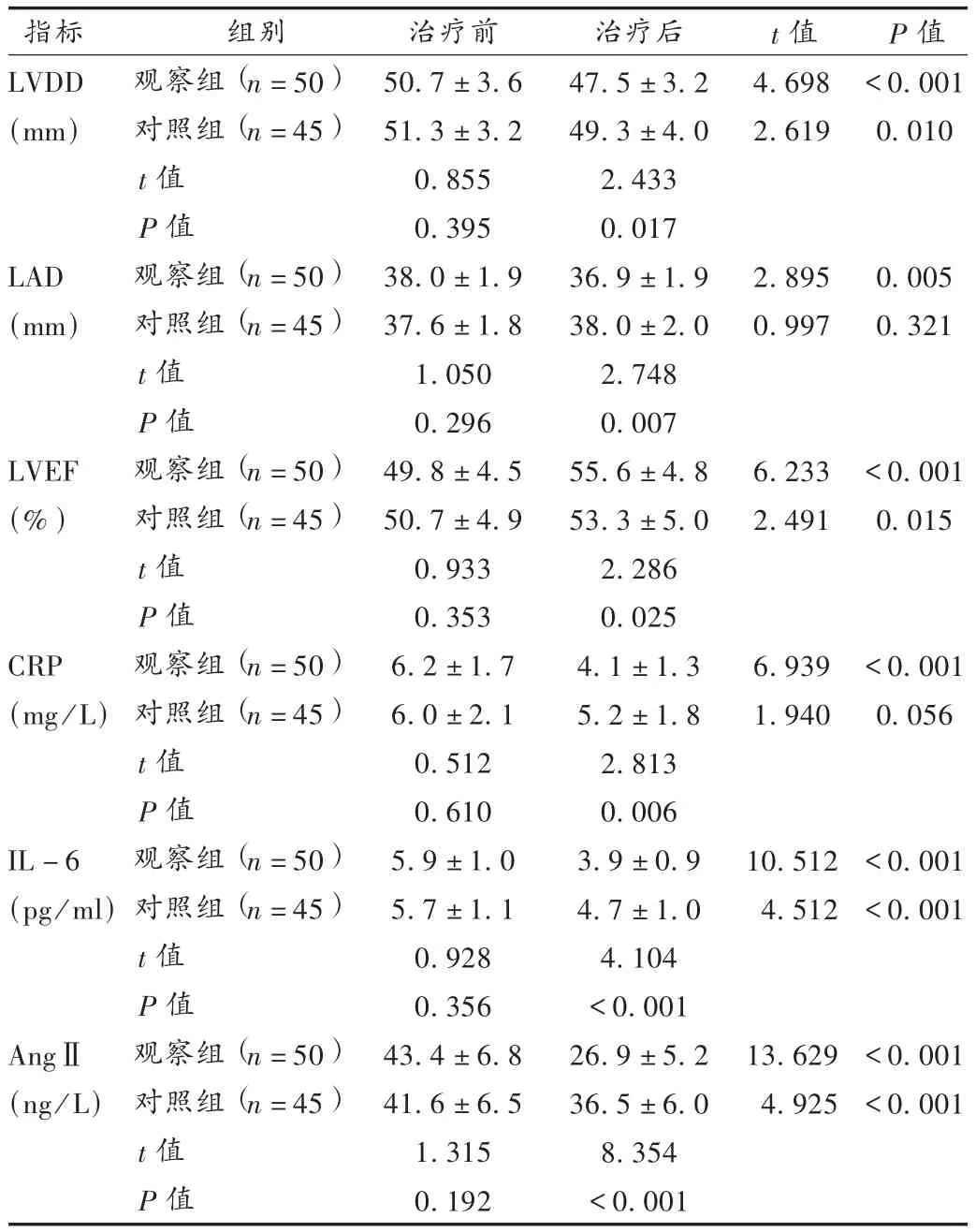
表3 两组患者心脏彩超与理化指标比较(±s)
指标LVDD(mm)组别观察组(n=50)对照组(n=45)t值P值治疗前50.7±3.6 51.3±3.2 0.855 0.395 38.0±1.9 37.6±1.8 1.050 0.296 49.8±4.5 50.7±4.9 0.933 0.353 6.2±1.7 6.0±2.1 0.512 0.610 5.9±1.0 5.7±1.1 0.928 0.356 43.4±6.8 41.6±6.5 1.315 0.192治疗后47.5±3.2 49.3±4.0 2.433 0.017 36.9±1.9 38.0±2.0 2.748 0.007 55.6±4.8 53.3±5.0 2.286 0.025 4.1±1.3 5.2±1.8 2.813 0.006 3.9±0.9 4.7±1.0 4.104<0.001 26.9±5.2 36.5±6.0 8.354<0.001 4.698 2.619<0.001 0.010 t值P值LAD(mm)观察组(n=50)对照组(n=45)2.895 0.997 0.005 0.321 t值P值LVEF(%)观察组(n=50)对照组(n=45)6.233 2.491<0.001 0.015 t值P值CRP(mg /L)观察组(n=50)对照组(n=45)6.939 1.940<0.001 0.056 t值P值IL-6(pg /m l)观察组(n=50)对照组(n=45)10.512 4.512<0.001<0.001 t值P值AngⅡ(ng /L)观察组(n=50)对照组(n=45)13.629 4.925<0.001<0.001 t值P值
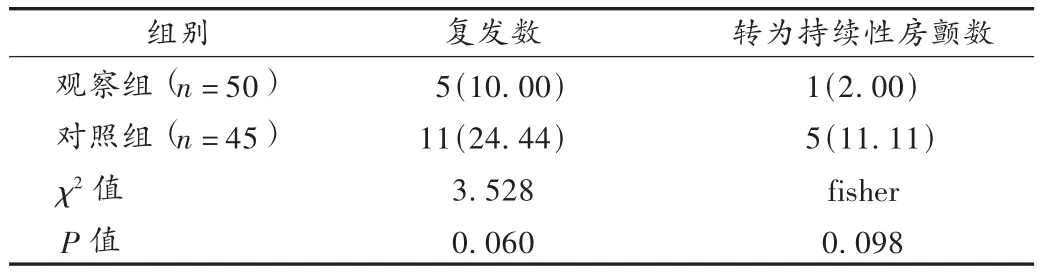
表4 两组患者治疗中房颤复发与转持续性房颤例数比较[例(%)]
3 讨论
原发性高血压对心脏的损害主要为左室心肌肥大、心肌纤维化和左室舒张功能减退,进而心室充盈能力下降、射血能力降低;左心室病理变化常引发心房结构重构、心房扩大,导致心房内传导迟缓、除极异质性增加和心房肌细胞不应期缩短,而心房电重构和结构重构是引发心房颤动和维持的主要机制[5]。房颤可使心排出量降低20% ~30%,同时可增加血栓栓塞几率,引发脑部供血不足或脑卒中。研究表明,心房重构与炎性反应、肾素-血管紧张素 - 醛固酮系统 (RAAS)的激活关系密切[6]。诸多研究证明[7],房颤人群中炎症介质CRP,IL-6,IL-8明显升高,其中IL-6是最重要的炎性介质,具有促进细胞分化和刺激血管活性物质释放,诱导纤维蛋白原分泌的作用;CRP是重要的促炎因子,通过激活补体增强炎症反应,促进心肌细胞凋亡,参与心肌损伤与左心重塑[8]。CRP水平与 LAD≥35mm的 PAF患者房颤水平呈正相关,而与LVEF与LAD呈负相关[9]。高血压病患者AngⅡ升高,加重心房肌细胞钙超载,参与心房电重构,使心房折返波长缩短,引发心房颤动[10];同时可加重心房肌纤维化,参与心房重构;再次,AngⅡ又可促进 IL-1,IL-6,IL-8,TNF-α 多种炎性细胞因子的生成。
目前,房颤患者复律的主要手段是射频消融与使用抗心律失常药物,前者因其技术难度与设备成本等因素限制了应用,故合理应用抗心律失常药物对于PAF的治疗意义重大。胺碘酮属于Ⅲ类抗心律失常药物,能选择性地扩张冠状动脉,降低心肌耗氧量,最初应用于心绞痛治疗。研究发现[11],胺碘酮能抑制K+通道,延迟复极而延长动作电位时间,延长心房、房室结、心室及旁道的有效不应期,消除折返和降低自律性,有效减少房颤的发生。与其他抗心律失常药物比较,胺腆酮负性肌力作用较小,半衰期较长,停药后药效维持时间长,作为顽固性、恶性心律失常的首选药,其疗效已得到公认[12]。
既往研究表明[13],HMG-CoA还原酶抑制剂即他汀类药物除具有调脂作用外,还能减轻心脏病患者系统性炎症反应和氧化应激反应,降低CRP及IL-6生成,减少AngⅡ受体表达、抑制RAAS系统,抑制胶原组织生成,减缓心肌纤维化和心脏重构;能降低血管紧张素转换酶活性和内皮素-1的合成,改善血管舒张功能,协同降低血压;同时可直接作用于心房肌细胞的膜离子通道,改变跨膜离子电流而影响心肌的电生理特性,利于改善心肌细胞复极化[2]。本试验结果显示,治疗6个月后,观察组LVDD及LAD较对照组缩短,LVEF明显提高,可以推断观察组患者在心室、心房重构改善方面优于对照组;观察组CRP,IL-6,AngⅡ水平明显低于对照组水平,则进一步说明阿托伐他汀有抑制炎性反应和拮抗RAAS系统的功效。上述作用机制协同改善了心律异常,观察组PAF总体有效率达90%,且转为持续性房颤的比率低于对照组,说明观察组加服阿托伐他汀后疗效进一步增强。
综上所述,在常规降压治疗基础上,阿托伐他汀可降低PAF患者体内炎性因子与血管紧张素水平,减缓左心重构,联合胺碘酮可进一步提高临床有效率,减少PAF复发率与转为持续性房颤的几率。
参考文献:
[1]蒋少华,李 洪.辛伐他汀对高血压并发阵发性心房颤动患者的影响[J]. 西部医学,2010,22(1):65-67.
[2]Dundua GI,Abuladze GV,Dzhindzholiia NR,etal.The efficasy of atorvastatin in the case of paroxismal atrial fibrillation in patients with ischemic heartdisease[J].Georgian Med News,2010,180:29-32.
[3]熊 攀,周 莉,侯玉娟.阿托伐他汀联合胺碘酮治疗原发性高血压伴阵发性房颤的研究[J]. 中国临床实用医学,2010,4(4):16-17.
[4]中国高血压防治指南起草委员会.中国高血压防治指南[J].中华高血压杂志,2005,13(8):13-15.
[5]邵 强,都恒剑,王艳玲.辛伐他汀联合缬沙坦治疗老年原发性高血压伴阵发性心房颤动疗效[J]. 临床荟萃,2011,26(18):1 628-1 629.
[6]杨 玲.厄贝沙坦联合阿托伐他汀治疗高血压合并阵发性心房颤动的临床分析[J]. 新医学,2012,43(4):243-247.
[7]郭忠秀.阿托伐他汀对高血压并发阵发性心房颤动的作用及机制[J].泰山医学院学报,2011,32(3):186-189.
[8]彭 程,赵 进.老年慢性心衰患者高敏C反应蛋白和血尿酸变化的意义[J]. 心血管康复医学杂志,2010,19(4):385-387.
[9]黎 红,龙健猷,贾旭荣,等.缬沙坦和阿托伐他汀治疗高血压病合并持续性房颤的疗效观察[J]. 陕西医学杂志,2010,39(8):1 057-1058.
[10]魏子秀,杨雪珍,丛培玲,等.厄贝沙坦联合阿托伐他汀对急性心肌梗死合并阵发性心房颤动患者复发的影响[J].中华老年心脑血管病杂志,2011,13(7):604-607.
[11]孟林英.胺碘酮治疗充血性心力衰竭心律失常34例[J].中国药业,2012,21(7):88-89.
[12]林桐梅,赵慧艳.胺碘酮联合瑞舒伐他汀对非瓣膜性持续性心房颤动患者窦性心律的维持作用[J]. 中国循环杂志,2014,29(1):40-42.
[13]白乐君.阿托伐他汀联合依那普利对高血压患者左室重构的影响[J].中国现代药物应用,2010,4(23):168-169.
