电针对急性饮酒抑郁大鼠海马TLR2/4 及炎性细胞因子表达的影响
2015-04-28王彦青王建光
陈 渔,胡 珊,王彦青,王 林,王建光
(1.贵州医科大学 疼痛诊疗学教研室,贵州 贵阳 550004;2.复旦大学上海医学院 中西医结合系,上海 200032;3.上海交通大学附属第六医院奉贤分院 疼痛科,上海 201400)
酒精被公认为是影响各种神经递质释放的饮料,不仅影响γ-氨基丁酸、谷氨酸、多巴胺、5-羟色胺及内源性阿片肽等递质释放[1],而且使大脑组织白介素-1β(IL-1β)、白介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)等表达增加,尤其是使海马区域炎性细胞因子表达明显增多[2]。炎症和炎症细胞因子几乎参与抑郁症的发病机制中的下丘脑-垂体-肾上腺(HPA)轴,神经递质代谢,海马神经再生和突触可塑性等途径[3]。Toll 样受体(TLR2/4)属于Toll 样受体家族,有研究表明TLR2/4 的高表达与许多炎症性疾病有关[4]。因此炎症或炎症标记物可能有助于抑郁症病理及治疗机制的研究。本研究拟探讨电针对急性酒精灌胃后抑郁样行为大鼠海马组织的TLR2/4 和炎性细胞因子的影响,为临床电针治疗酒精导致的行为改变提供依据。
1 材料和方法
1.1 实验动物
健康雄性成年SD 大鼠,体重180 ~200 g,购自中国科学院上海实验动物中心。动物饲养按12 h/12 h 昼夜交替,自由摄食饮水,保持恒温(21±1)℃,相对湿度约55%,室内噪音低于60 dB,环境适应1 周后进行实验。动物处理符合国际实验动物使用准则。
1.2 主要试剂
Trizol Reagent 购自invitrogen 公司,iScript cDNA Synthesis Kit、iQ SYBR Green Supermix 购 自Bio-Rad 公司;上下游引物由上海生物工程技术服务有限公司合成,见表1。

表1 上下游引物序列Tab.1 Sequences of the forward and reverse primers
1.3 方法
1.3.1 分组与造模 将48 只大鼠随机分成2 组,各24 只,生理盐水对照组(Control,生理盐水溶液灌胃)和酒精模型组(Ethanol,50%酒精5 g/kg 灌胃)。参照文献[5],造模前12 h 禁食,2 h 禁水。通过强迫游泳实验和旷场实验观察两组的行为学改变,若出现抑郁样症状提示造模成功。强迫游泳实验(forced swimming test,FST):实验大鼠在酒精造模前预游泳。将大鼠放入高40 cm、直径18 cm的玻璃圆筒内,筒内水位15 cm,水温22 ~23 ℃,15 min 后取出,用45 w 白炽灯烘干;第2 天相同时间段将大鼠再次放入圆筒内,记录造模前5 min 内大鼠静止时间(大鼠轻微摆动四肢保持头部或鼻部露出水面评判为静止状态。酒精造模后同时间段采取该方法记录各组大鼠5 min 内静止时间;与生理盐水对照组比较,静止时间明显延长可反映大鼠产生抑郁,造模成功。旷场实验(open field test,OFT)装置由不透明材料制成,底面黑色为100 cm×100 cm 的正方形,侧壁高45 cm。在造模后24 h、72 h 分别进行测试前用5%的醋酸水溶液彻底清洁敞箱,并擦干,同时开启摄像监控器,记录5 min内各只大鼠水平运动和直立次数(两前爪腾空或攀爬墙壁为垂直运动1 次),醋酸清洗后进行下一只大鼠;用旷场视频分析系统分析大鼠水平运动总路程和直立总次数;同时观察每只大鼠的探究行为及运动能力,探究行为和运动能力比生理盐水组明显下降,可表明大鼠产生抑郁,造模成功。随机从Control 组和Ethanol 组各抽取12 只大鼠,为生理盐水加电针组(Control+EA)和酒精模型加电针组(Ethanol+EA),均予电针刺激(1 次/d)。
1.3.2 电针治疗 安静环境下,将大鼠躯干固定于木架上,头部和四肢可以自由活动,待大鼠平静10 min 后,将0.3 mm×1.3 cm 银针刺大鼠百会穴和右侧足三里穴,针刺深度0.4 cm,定位参照文献[6]。Control+EA 和Ethanol+EA 组在酒精或生理盐水灌胃后第24 h、48 h、72 h(1 次/d)使用一个回路的两个电极,连接韩氏电针仪,进行通电治疗。给予疏密波(疏波频率2 Hz,串长2.5 s,密波频率约15 Hz,串长2.5 s),强度以引起大鼠耳朵和腿部肌肉轻微抖动而不嘶叫为宜(1 ~2 mA),持续30 min。
1.3.3 大鼠海马TLR2/4 及IL-1β、IL-6、TNF-α mRNA 检测 (1)总RNA 的提取(Trizol 法),各组(Control、Ethanol、Control+EA 和Ethanol+EA 组)均在实验24h、72h 取大鼠海马组织,按照Trizol 试剂盒说明书在无菌无酶冰浴条件下提取总RNA;(2)按照iScript cDNA Synthesis Kit 试剂盒进行逆转录聚合酶链反应,把RNA 逆转录成cDNA;(3)用iQ SYBR Green Supermix 试剂盒进行PCR 扩増;(4)使用IQ5 多重实时荧光定量PCR 仪所带软件进行样本自动分析。
1.4 统计学处理
应用SPSS 17.0 统计学软件进行数据分析,计量资料数据均用均数±标准差()表示,数据符合正态分布且组间比较方差齐性检验(P >0.05)的基础上,采用方差分析(one-way ANOVA)进行比较,差异用LSD 进行统计分析;若方差不齐,采用非参数检验。以P <0.05 表示差异有统计学意义。
2 结果
2.1 大鼠行为学改变
急性酒精造模后24 h、72 h,Ethanol 组与Control 组相比较,大鼠的静止时间明显增多,水平运动总路程和直立总次数明显减少,差异有统计学意义(P <0.05),Ethanol 组大鼠造模成功。见表2 和表3。
表2 两组大鼠FST 结果Tab.2 Forced swimming test results of rats in the two groups

表2 两组大鼠FST 结果Tab.2 Forced swimming test results of rats in the two groups
(1)与Control 组比较,P <0.05
静止时间(s/5min)组别造模后24 h 造模后72 h Control 组164.98±6.21 105.99±20.01 Ethanol 组 202.88±12.25(1) 184.13±12.54(1)
表3 两组大鼠OFT 结果Tab.3 Open field test results of rats in the two groups

表3 两组大鼠OFT 结果Tab.3 Open field test results of rats in the two groups
(1)与Control 组比较,P <0.05
水平运动总路程(cm)直立(次)组别24 h 72 h 24 h 72 h Control 组1 528.55±130.19 1 544.33±144.31 27.83±2.66 23.17±2.69 Ethanol 组 637.05±86.58(1)585.60±148.69(1)15.00±1.25(1)12.57±1.54(1)
2.2 海马组织IL-1β、IL-6、TNF-α mRNA 的表达
急性酒精灌胃后24 h 和72 h,与Control 组比较,Ethanol 组大鼠IL-1β、IL-6、TNF-α mRNA 的表达明显增加(P <0.05),Control+EA 组无明显差异(P >0.05);与Ethanol 组相比,Ethanol+EA 组的IL-1β、IL-6、TNF-α mRNA 表达显著减少(P <0.05);Control+EA 与Ethanol+EA 两组间比较差异无统计学意义(P >0.05),见表4。
2.3 海马组织TLR2、TLR4 mRNA 表达
急性酒精灌胃后24 h 和72 h,与Control 组比较,Control+EA 组无明显差异(P >0.05),而Ethanol 组大鼠TLR2、TLR4 mRNA 的表达明显增加(P <0.05);与Ethanol 组相比,Ethanol+EA 组TLR2、TLR4 mRNA 的表达显著减少(P <0.05);Control+EA 与Ethanol+EA 两组间比较,差异无统计学意义(P >0.05)。见表5。
表4 电针对大鼠海马组织IL-1β、IL-6、TNF-α mRNA 表达的影响(,n=6)Tab.4 The effect of EA on expressions of IL-1β,IL-6 and TNF-α mRNA in hippocampus of acute ethanol administration-induced depression rats

表4 电针对大鼠海马组织IL-1β、IL-6、TNF-α mRNA 表达的影响(,n=6)Tab.4 The effect of EA on expressions of IL-1β,IL-6 and TNF-α mRNA in hippocampus of acute ethanol administration-induced depression rats
(1)与Control 组比较,P <0.05;(2)与Ethanol 组比较,P <0.05
组别 24 h IL-1β 72 h 24 h IL-6 72 h24 h TNF-α 72 h Control 组 1.04±0.35 1.17±0.58 1.03±0.26 1.25±0.82 1.04±0.30 1.05±0.37 Control+EA 组 1.04±0.29 1.17±0.29 1.12±0.35 1.43±0.61 0.97±0.25 1.05±0.08 Ethanol 组 3.32±1.45(1) 3.85±1.43(1) 5.04±2.63(1) 4.63±1.91(1) 2.97±1.20(1) 2.57±0.54(1)Ethanol+EA 组 0.81±0.40(2) 1.62±0.77(2) 0.83±0.38(2) 1.06±0.63(2) 0.98±0.31(2) 1.40±0.57(2)
表5 电针对急性酒精抑郁大鼠海马组织TLR2、TLR4 mRNA 表达的影响(,n=6)Tab.5 The effect of EA on expressions of TLR2 and TLR4 mRNA in hippocampus of acute ethanol administration-induced depression rats
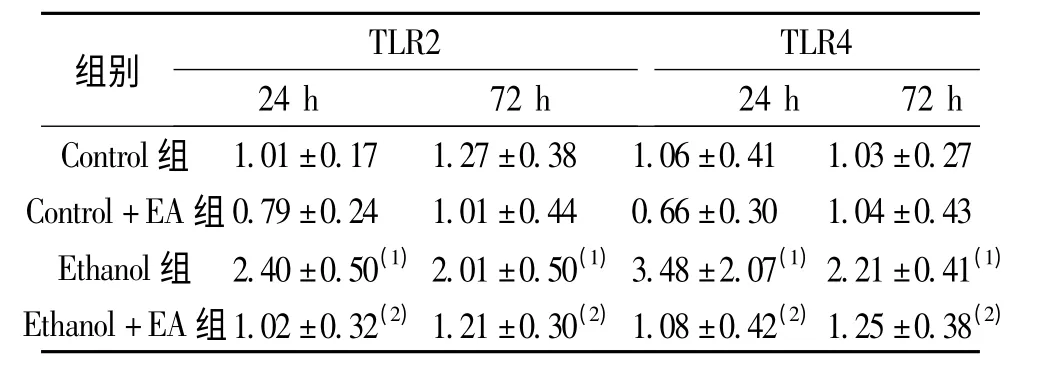
表5 电针对急性酒精抑郁大鼠海马组织TLR2、TLR4 mRNA 表达的影响(,n=6)Tab.5 The effect of EA on expressions of TLR2 and TLR4 mRNA in hippocampus of acute ethanol administration-induced depression rats
(1)与Control 组比较,P <0.05;(2)与Ethanol 组比较,P <0.05
TLR2TLR4组别24 h 72 h24 h 72 h Control 组1.01±0.17 1.27±0.38 1.06±0.41 1.03±0.27 Control+EA 组0.79±0.24 1.01±0.44 0.66±0.30 1.04±0.43 Ethanol 组 2.40±0.50(1)2.01±0.50(1)3.48±2.07(1)2.21±0.41(1)Ethanol+EA 组1.02±0.32(2)1.21±0.30(2)1.08±0.42(2)1.25±0.38(2)
3 讨论
本实验制作的急性灌酒后大鼠抑郁样行为模型,模拟人类急性饮酒代谢后行为改变的发生和机理,可用于其病理生理机制研究。该模型在24 h、72 h 通过强迫游泳实验和旷场实验衡量大鼠抑郁样行为,而日常生活或临床工作中酒精代谢后抑郁症状轻,异常行为持续时间短暂,易被忽略,也无便捷可靠的治疗方法,这可能存在潜在的危害。本研究中,急性灌酒后24 h、72 h,Ethanol 组大鼠静止不动时间较Control 组明显延长,可反映动物的绝望状态;Ethanol 组较Control 组大鼠水平运动总路程和垂直运动总次数显著性减少,反映自发性探究行为和运动能力明显下降,表明大鼠活动度和对新鲜事物的好奇程度降低。成功模拟临床上抑郁症病人的情绪低落,兴趣丧失、活动减少症状,提示造模成功。强迫游泳实验和旷场实验也常作为评价抑郁症研究的行为指标[7-8]。
本实验显示急性灌酒后24 h、72 h 与Control组比较,Ethanol 组大鼠海马组织的TLR2/4、IL-1β、IL-6、TNF-α mRNA 表达明显增加(P <0.05),表明急性酒精可以激活TLR2/4 受体,增加炎性细胞因子的释放。目前大部分研究认为慢性或急性酒精暴露引起的行为或认知障碍与TLR4 有关,机制可能是激活TLR(尤其TLR4)下游的MAPK、MyD88、NF-κB 通路,上调其主要的炎性靶基因的转录和表达,从而增加细胞释放炎性因子(如IL-1β、IL-6、TNF-α 等),引起炎性损害等[9-11]。有研究报道,急性酒精暴露后成年啮齿动物大脑多个区域细胞因子表达改变,尤其IL-6 的表达明显增加[12]。在抑郁症的患者血和脑脊液中发现IL-1β、IL-6、TNF-α 的表达增加,提示炎性细胞因子可能影响抑郁症的发生[13]。这些研究结果都与本研究大体一致,个别指标不同的原因考虑可能为模型动物、造模方式、观察指标等因素所致;本研究结果提示急性灌酒可能是通过酒精刺激TLR2/4 样受体,激活下游的通路,增加炎性细胞因子的释放,导致大脑组织炎症反应,引起相应的抑郁样行为[14]。
目前认为针刺治疗有利于中枢神经系统生物化学平衡的维持和机体内稳态的恢复。本研究通过低频电针刺激足三里穴和百会穴使得大鼠造模后抑郁样行为明显改善,QRT-PCR 结果显示在24 h、72 h 与Ethanol 组 相 比,Ethanol+EA 组TLR2/4、IL-1β、IL-6、TNF-α mRNA 的表达显著减少(P <0.05),趋于正常。提示电针能有效的缓解急性灌酒后大鼠抑郁样行为。早前Chen XH[15-16]认为不同频率的电针可以激发不同的受体,2/15 Hz 低频电针治疗可调节大鼠脊髓上μ、δ、κ 三种类型阿片受体释放,而如前言所述酒精刺激这些内源性阿片肽的释放增加,与中枢神经系统密切相关。王育红等[17]人认为低频电针不仅能抑制大鼠饮酒行为、戒断反应,也能改善抑郁症状[18]。近期研究认为电针能抑制TLR2/4、IL-1β、TNF-α 蛋白表达[19]。电针刺激足三里穴和百会穴不仅能抑制酒精行为敏化,而且调节脑内神经递质的释放,发挥抗抑郁和改善空间学习记忆障碍的作用[20-22]。而抗抑郁机制主要是与炎症和炎症细胞因子的减少有关[23]。根据以往研究,再结合本实验结果,可推测低频电针抑制急性灌酒后的抑郁行为机制可能是通过抑制TLR2/4 信号通路激活,并下调炎性细胞因子的表达,减少炎症反应。
综上所述,急性酒精灌胃后24 h、72 h 能引起大鼠抑郁样行为,电针能改善症状,其机制可能是电针抑制TLR2/4、IL-1β、IL-6、TNF-α mRNA 的表达。本实验为临床治疗酒精导致的异常行为改变提供实验依据,未来研究有待进一步阐明电针和酒精作用的中枢机制,明确炎性细胞因子的来源通路。
[1]Cui C,Noronha A,Morikawa H,et al.New insights on neurobiological mechanisms underlying alcohol addiction[J].Neuropharmacology,2013(67):223-232.
[2]Tiwari V,Kuhad A,Chopra K.Suppression of neuro-inflammatory signaling cascade by tocotrienol can prevent chronic alcohol-induced cognitive dysfunction in rats[J].Behav Brain Res,2009(2):296-303.
[3]Capuron L,Miller AH.Immune system to brain signaling:neuropsychopharmacological implications[J].Pharmacol Ther,2011(2):226-238.
[4]Liu Y,Yin H,Zhao M,et al.TLR2 and TLR4 in autoimmune diseases:a comprehensive review[J].Clin Rev Allergy Immunol,2014(2):136-147.
[5]史清海,伏建峰,路西春,等.酒精灌胃大鼠血浆中乙醇浓度变化[J].实用预防医学,2006(5):1312-1323.
[6]华兴邦,李辞蓉,周浩良,等.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[7]刘靖,郑臣浩,洪先扬,等.慢性酒精摄入对应激抑郁模型的影响[J].佛山科学技术学院学报:自然科学版,2013(5):85-86.
[8]刘琼,俞瑾,毛应启梁,等.电针对慢性应激抑郁模型大鼠行为改变的影响[J].上海针灸杂志,2005(11):44-46.
[9]Szabo G,Dolganiuc A,Dai Q,et al.TLR4,ethanol,and lipid rafts:a new mechanism of ethanol action with implications for other receptor-mediated effects[J].J Immunol,2007(3):1243-1249.
[10]Pandey SC.TLR4-MyD88 signalling:a molecular target for alcohol actions[J].British Journal of Pharmacology,2012(5):1316-1318.
[11]Pascual M,Baliño P,Alfonso-Loeches S,et al.Impact of TLR4 on behavioral and cognitive dysfunctions associated with alcohol-induced neuroinflammatory damage[J].Brain,Behavior,and Immunity,2011(25):80-91.
[12]Doremus-Fitzwater TL,Buck HM,Bordner K,et al.Intoxication-and withdrawal-dependent expression of central and peripheral cytokines following initial ethanol exposure[J].Alcohol Clin Exp Res,2014(8):2186-2198.
[13]Dinan TG.Inflammatory markers in depression[J].Curr Opin Psychiatry,2009(1):32-36.
[14]Pascual-Lucas M,Fernandez-Lizarbe S,Montesinos J,et al.LPS or ethanol triggers clathrin-and rafts/caveolaedependent endocytosis of TLR4 in cortical astrocytes[J].J Neurochem,2014(3):448-462.
[15]Chen XH,Han JS.Analgesia induced by electroacupuncture of different frequencies is mediated by different types of opioid receptors:another cross-tolerance study[J].Behav Brain Res,1992(2):143-149.
[16]Chen XH,Han JS.All three types of opioid receptors in the spinal cord are important for 2/15 Hz electroacupuncture analgesia[J].Eur J Pharmacol,1992(2):203-210.
[17]王育红,俞建良,黄劲松,等.低频电针足三里对酒依赖大鼠饮酒行为的影响[J].中国心理卫生杂志,2008(3):157-163.
[18]官昌伦,曹光宇,熊波,等.综合康复治疗对脑卒中后抑郁的影响[J].内蒙古中医药,2014(2):11.
[19]Wang J,Zhao H,Mao-Ying QL,et al.Electroacupuncture downregulates TLR2/4 and pro-inflammatory cytokine expression after surgical trauma stress without adrenal glands involvement[J].Brain Res Bull,2009(1-2):89-94.
[20]王育红,成爽,郝伟,等.低频电针足三里穴对SD 大鼠酒精行为敏化及相关脑区神经肽Y 表达的影响[J].广东医学,2013(17):2612-2615.
[21]陈华德,金灵青,娄冉.电针百会穴对慢性应激抑郁模型大鼠HPA 轴的影响[J].浙江中医药大学学报,2010(2):252-253.
[22]Lu B,Ma Z,Cheng F,et al.Effects of electroacupuncture on ethanol-induced impairments of spatial learning and memory and Fos expression in the hippocampus in rats[J].Neurosci Lett,2014(576):62-67.
[23]An L,Li J,Yu ST,et al.Effects of the total flavonoid extract of Xiaobuxin-Tang on depression-like behavior induced by lipopolysaccharide and proinflammatory cytokine levels in mice[J].J Ethnopharmacol,2015(163):83-87.
