氧化苦参碱联合顺铂对卵巢癌Bcl-2、Bax 表达的影响
2015-04-28王东晖史春燕李霞刘丹彤高洁凡冯静王晓红
王东晖 史春燕 李霞 刘丹彤 高洁凡 冯静 王晓红
卵巢癌是严重威胁女性生命的恶性肿瘤,目前临床常用治疗手段主要是手术和化疗,而铂类是卵巢癌化疗方案中最常用的药物,但是肿瘤细胞对铂类的耐药性及其毒副作用往往导致化疗方案难以顺利实施。因此,寻找对化疗药物具有减毒或增效作用的辅助用药至关重要。氧化苦参碱是从豆科植物苦参中提取分离的一种生物碱,药理作用广泛[1]。目前,氧化苦参碱的抗肿瘤活性受到了广泛关注并进行了大量的机制研究[2,3]。但氧化苦参碱用于卵巢癌的研究报道较少,本课题将对苦参碱辅助临床化疗治疗卵巢癌进行实验研究,并对其作用机制进行初步探讨。
1 材料与方法
1.1 实验动物 2 月龄雌性Fisher344 大鼠60 只,SPF 级,体重130 ~160 g,由北京维通利华实验动物技术有限公司提供,合格证号SCXK(京)2012 -0001。
1.2 试剂 氧化苦参碱胶囊,正大天晴制药公司;顺铂,齐鲁制药有限公司生产;NuTu-19 细胞株,上海丰寿实业有限公司。卵巢癌SKOV3 细胞,购于吉妮欧生物科技公司。氧化苦参碱注射液购于正大天晴制药公司。四甲基偶氮唑蓝(MTT)为Sigma 公司产品。Annexinv-FITC/PI 凋亡检测试剂盒,购于上海碧云天生物技术研究所。Bcl-2、Bax 一抗购于Abcam 美国公司。
1.3 实验方法
1.3.1 动物分组与给药[4]:NuTu-19 细胞株用含10%胎牛血清的PRIM-1640 培养基培养,胰酶消化后,用培养基洗涤,计数后用0.9%氯化钠溶液制备成2 ×107/ml 细胞悬液。按0.2 ml/只接种于Fisher344 大鼠右侧腋部皮下(留出10 只作为正常对照组)。7 d 后,将荷瘤大鼠随机分为5 组:模型组(灌胃蒸馏水,腹腔注射0.9%氯化钠溶液)、顺铂组(灌胃蒸馏水,腹腔注射顺铂3 mg/kg,隔日注射1 次)、顺铂+氧化苦参碱低剂量组(灌胃氧化苦参碱40 mg/kg,隔日腹腔注射1 次顺铂3 mg/kg)、顺铂+氧化苦参碱中剂量组(灌胃氧化苦参碱80 mg/kg,隔日腹腔注射1 次顺铂3 mg/kg)、顺铂+氧化苦参碱高剂量组(灌胃氧化苦参碱160 mg/kg,隔日腹腔注射1 次顺铂3 mg/kg)每组10 只。疗程12 d。
1.3.2 检测指标:给药结束后,10%水合氯醛麻醉,摘取肿瘤组织,称重,计算抑制率,抑制率=(模型组平均瘤重- 治疗组平均瘤重)/模型组平均瘤重×100%。称取100 mg 肿瘤组织,70%乙醇固定,制成单细胞悬液,碘化丙啶染色,流式细胞仪检测肿瘤细胞凋亡率。
1.3.3 细胞培养及分组:在37℃、5% CO2培养箱内,用含10%胎牛血清的1640 培养基常规培养卵巢癌SKOV3 细胞。细胞融合80%左右时,0.25%胰酶消化传代,取对数生长期细胞进行实验。将SKOV3 细胞分为空白对照组、顺铂组、顺铂与氧化苦参碱联用3 个剂量组,顺铂终浓度为3 μg/ml,氧化苦参碱终浓度分别为2.5 mg/ml、5.0 mg/ml、10.0 mg/ml,每组10 个复孔。
1.3.4 MTT 法检测SKOV3 细胞增殖[5]:取对数生长期细胞,胰酶消化,台盼蓝计数,调整细胞浓度为5 ×106个/ml,每孔加细胞悬液200 μl,置37℃、5% CO2培养箱培养24 h,分别加入相应药物,空白对照组加入等量培养基。加药48 h 后,加入MTT 20 μl(浓度为2 g/L),继续培养4 h。丢弃培养基,每孔加入200 μl DMSO,震荡1 min,蓝色晶体完全溶解后用酶标仪于570 nm 处检测吸光度(OD 值),并计算抑制率:抑制率=(空白对照组OD 值-用药组OD 值)/空白对照组OD 值×100%。
1.3.5 流式细胞术检测SKOV3 细胞周期[6]:取对数生长期细胞,胰酶消化,台盼蓝计数,调整细胞浓度为5 ×106个/ml,按5 ml/瓶移至无菌培养瓶中,每组6瓶,培养24 h 后加药,空白对照组加入等量培养基。继续培养48 h。胰酶消化,收集细胞,PBS 洗2 遍,70%乙醇固定2 h,PI 避光染色30 min,300 目尼龙网过滤,流式细胞仪进行检测细胞周期及凋亡率。
1.3.6 Western blot 检测SKOV3 细胞Bcl-2、Bax 蛋白表达:细胞裂解后收集蛋白,考马斯亮蓝法定量蛋白。SDS-PAGE 电泳转膜,5% 脱脂奶粉封闭2 h。加入TTBS 稀释(1∶500)的一抗/β-actin(1∶1 000)稀释液,4℃过夜。洗膜后,加入TTBS 1∶10 000 稀释的辣根过氧化物酶标记的二抗,室温反应2 h。化学发光法检测蛋白条带。Labworks 软件对条带进行吸光度积分扫描,用目的蛋白灰度值/β-actin 内参照胶片灰度值的比值为蛋白的相对表达量,进行统计分析。
1.4 统计学分析 应用SPSS 11.5 统计软件,计量资料以± s 表示,采用单因素方差分析(One-Way ANOVA),两两比较采用最小显著差法(LSD),P <0.05为差异有统计学意义。
2 结果
2.1 氧化苦参碱对顺铂化疗卵巢癌大鼠肿瘤重量的影响 与模型组相比,各治疗组肿瘤重量均明显降低(P <0.01);与顺铂组相比,氧化苦参碱80 mg/kg 及160 mg/kg 2 组肿瘤重量显著降低(P <0.05);氧化苦参碱辅助治疗各组肿瘤抑制率均有所升高。见表1。
2.2 氧化苦参碱对顺铂化疗卵巢癌大鼠肿瘤组织细胞凋亡率的影响 与模型组相比,各治疗组肿瘤组织细胞凋亡率均明显升高(P <0.05);与顺铂组相比,氧化苦参碱辅助治疗各组凋亡率均有不同程度的升高,尤以160 mg/kg 组最为明显(P <0.05)。见表2。

表1 氧化苦参碱对顺铂化疗卵巢癌大鼠肿瘤重量的影响n =10

表2 氧化苦参碱对顺铂化疗卵巢癌大鼠肿瘤组织细胞凋亡率的影响 n =10
2.3 氧化苦参碱联合顺铂对SKOV3 细胞增殖的影响MTT 法显示,联合化疗组能够明显抑制SKOV3 细胞增殖,且能增强顺铂的抑制作用,其中氧化苦参碱5.0 mg/ml、10.0 mg/ml 剂量组与顺铂组比较,差异有统计学意义(P <0.05)。见表3。

表3 氧化苦参碱联合顺铂对SKOV3 细胞增殖的影响n =10
2.4 氧化苦参碱对顺铂处理SKOV3 细胞周期的影响 与空白对照组相比,各用药组G0/G1 期细胞均增多(P <0.01),且氧化苦参碱3 个剂量均能增强顺铂的作用(P <0.05);与空白对照组相比,S、G2/M 期细胞均减少,其中G2/M 期细胞减少尤为明显(P <0.01),氧化苦参碱5.0 mg/ml、10.0 mg/ml 组与顺铂组相比明显降低(P <0.05);与空白对照组相比,各用药组SKOV3 细胞均显著升高(P <0.01),而氧化苦参碱10.0 mg/ml 组较顺铂组升高尤为明显(P <0.05)。见表4。
表4 氧化苦参碱对顺铂处理SKOV3 细胞周期的影响 n =6 ± s
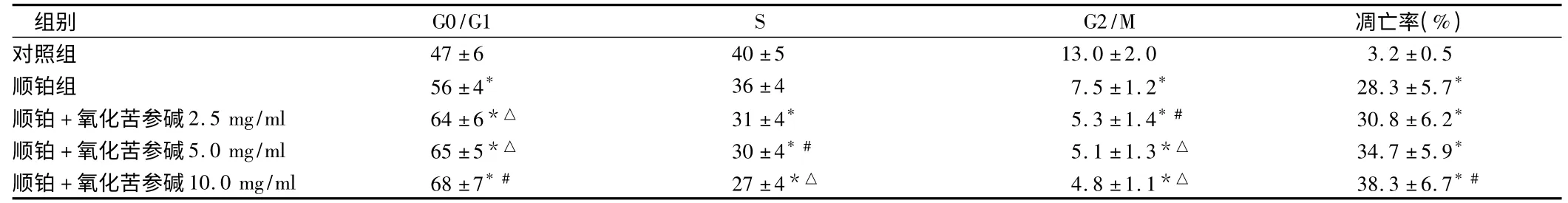
表4 氧化苦参碱对顺铂处理SKOV3 细胞周期的影响 n =6 ± s
注:与对照组比较,* P <0.01;与顺铂组比较,#P <0.05,△P <0.01
组别 G0/G1 S G2/M 凋亡率(%)47 ±6 40 ±5 13.0 ±2.0 3.2 ±0.5顺铂组 56 ±4* 36 ±4 7.5 ±1.2* 28.3 ±5.7*顺铂+氧化苦参碱2.5 mg/ml 64 ±6*△ 31 ±4* 5.3 ±1.4* # 30.8 ±6.2*顺铂+氧化苦参碱5.0 mg/ml 65 ±5*△ 30 ±4* # 5.1 ±1.3*△ 34.7 ±5.9*顺铂+氧化苦参碱10.0 mg/ml 68 ±7* # 27 ±4*△ 4.8 ±1.1*△ 38.3 ±6.7*#对照组
2.5 氧化苦参碱对顺铂处理SKOV3 细胞Bcl-2、Bax蛋白表达的影响 与空白对照组相比,各用药组Bcl-2蛋白表达均显著下调(P <0.05),而Bax 蛋白表达均显著上调(P <0.05);与顺铂组相比,氧化苦参碱5.0 mg/ml、10.0 mg/ml 组Bcl-2 蛋白表达显著下调(P <0.05),氧化苦参碱10.0 mg/ml 组Bax 蛋白表达显著上调(P <0.05)。见表5。
表5 氧化苦参碱对顺铂处理SKOV3 细胞Bcl-2、Bax 相对蛋白表达量的影响 n =3,± s

表5 氧化苦参碱对顺铂处理SKOV3 细胞Bcl-2、Bax 相对蛋白表达量的影响 n =3,± s
注:与对照组比较,* P <0.05,#P <0.01;与顺铂组比较,△P <0.05,☆P <0.01
Bcl-2 Bax对照组组别0.67 ±0.03 0.36 ±0.04顺铂组 0.55 ±0.04* 0.48 ±0.05*顺铂+氧化苦参碱2.5 mg/ml 0.52 ±0.03# 0.53 ±0.05#顺铂+氧化苦参碱5.0 mg/ml 0.43 ±0.04#△ 0.58 ±0.06#顺铂+氧化苦参碱10.0 mg/ml 0.40 ±0.03#☆ 0.61 ±0.04#△
3 讨论
卵巢恶性肿瘤是女性生殖器官常见恶性肿瘤之一,上皮性卵巢癌病死率占妇科肿瘤首位,严重威胁着女性患者的生命。NuTu-19 是从Fisher344 大鼠卵巢表面上皮细胞体外培养20 代后出现的,具有接触抑制消失、染色体核型改变、成瘤性等恶性细胞的特性,属于一种上皮性卵巢癌细胞系[7],故本实验选择此细胞系建立大鼠卵巢癌实体瘤模型。实验结果显示,顺铂能够有效抑制卵巢癌实体瘤的重量,而氧化苦参碱能够增强顺铂的抑瘤作用。
细胞凋亡(apoptosis)是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡,是机体清除衰老、损伤、突变细胞的重要方式。目前,很多学者认为细胞凋亡受抑是肿瘤发生的重要原因,而诱导细胞凋亡已经成为肿瘤治疗的新靶标。迄今为止,国内外众多科研人员借助分子生物学技术,就细胞凋亡做了大量的探索工作,提出了很多观点和假说,但是仍然没有找到有关细胞凋亡过程的确切机制[8]。研究表明,细胞凋亡和细胞周期有相关性,细胞周期阻滞于哪一期,凋亡就发生在哪一期[9]。细胞周期分为间期和分裂期两个阶段,细胞大部分生命活动时间是在间期度过的。间期又分为DNA 合成前期(G1 期)、DNA 合成期(S期)与DNA 合成后期(G2 期)。细胞增殖周期能否顺利进行,主要取决于G1/S 转换盒G2/M 转换,这是调控细胞周期进程的2 个节点。本研究结果表明,顺铂能够将卵巢癌SKOV3 细胞阻滞于G0/G1 期,使得进入S 期的细胞比例有所降低,而氧化苦参碱能够增强顺铂对卵巢癌SKOV3 细胞的阻滞作用,并且随浓度增高,G0/G1 期细胞比例逐渐升高,S 期细胞比例显著降低,故我们推测,细胞凋亡主要发生在G1 期。凋亡的发生过程受到多种基因的调控,目前研究较多的有p53、caspase、Bcl-2 等。Bcl-2 是抗细胞凋亡蛋白的代表,Bax 是促细胞凋亡的代表,两者相互拮抗,二者平衡时细胞正常生长[10]。随着氧化苦参碱浓度的升高,Bcl-2 蛋白表达明显降低,Bax 蛋白表达明显升高,而细胞凋亡率也随之升高,故我们推测氧化苦参碱诱导SKOV3 细胞凋亡与Bcl-2、Bax 蛋白表达失衡有关。
顺铂作为卵巢癌常用化疗药物,肿瘤细胞产生的耐药性以及药物本身的不良反应为临床应用造成了一定障碍,本研究对氧化苦参碱用于卵巢癌化疗辅助用药有一定的参考价值,但仍然存在缺陷,如只观察了药物对卵巢癌SKOV3 一个时间点作用效果,未进行动态观察来评价药物作用与时间的关系,程度如何;顺铂只设一个剂量组,未进行氧化苦参碱能否降低顺铂IC50值的相关研究等,这些我们将在后续研究中进行完善。另外,氧化苦参碱对耐药卵巢癌细胞株的作用、对其他卵巢癌细胞株的作用等一系列研究等待我们开展。我们将通过大量的研究工作来观察氧化苦参碱能否在不影响疗效的前提下降低化疗药物用量,增强化疗效果,或增加肿瘤对化疗药物的敏感性。
1 郑幼兰,彭华毅.氧化苦参碱(苦参素)治疗慢性乙型肝炎、肝纤维化的基础与临床.海峡药学,2007,19:1-3.
2 Ling Q,Xu X,Wei X,et al.Oxymatrine induces human pancrealic cancer PANC-1 cells apoptosis via regulating expression of Bcl-2 and LAP families,and releasing of cytochrome.Exp Clin Cancer Res,2011,30:66.
3 Qin XG,Hua Z,Shuang W,et al.Effects of matrine on HepG2 cell proliferation and expression of tumor relevant proteins in vitro.Pharmaceutical Biology,2010,48:275-281.
4 邹党华,谭布珍,黄艳琴,等.小剂量雷公藤内酯对荷卵巢癌大鼠体内抑瘤作用的观察.江西医学院学报,2009,49:110-111.
5 司徒镇强,吴军正主编.细胞培养.第1 版.西安:世界图书出版公司,1996.186-187.
6 郭启帅,黄曦,李少林.苦参碱诱导卵巢癌SKOV3 细胞凋亡的机制研究.中国药理学通报,2010,26:1104-1107.
7 Testa JR,Getts LA,Salazar H,et al.Spontaneous transformation of rat ovarian surface epithelial cells results in well to poorly differentiated tumors with a parallel range of cytogenetic complexity.Cancer Res,1994,54:2778-2784.
8 Yamashita S,Masuda Y,Kurizaki T,et al.Survivin expression predicts early recurrence in early-stage breast cancer.Anticancer Res,2007,27:2803-2808.
9 姜浩,樊光华.人参皂甙-Rh2 对人肝癌Bel-7404 细胞增殖和凋亡的影响.中国肿瘤临床与康复,2004,11:289-292.
10 Cory S,Huang DC,Adams JM.The Bcl2 family:roles in cell survival and oncogenesis.Oncogene,2003,22:8590-8607.
