短链酰基辅酶A脱氢酶在心肌细胞凋亡中的作用*
2015-04-27曾振华黄秋菊黄金贤舒朝辉刘培庆陈少锐周四桂广东药学院临床药学系中山大学药学院药理与毒理学实验室广东广州50006
曾振华,黄秋菊,黄金贤,舒朝辉,刘培庆,陈少锐,刘 冰,周四桂△(广东药学院临床药学系,中山大学药学院药理与毒理学实验室,广东广州50006)
短链酰基辅酶A脱氢酶在心肌细胞凋亡中的作用*
曾振华1,黄秋菊1,黄金贤1,舒朝辉1,刘培庆2,陈少锐2,刘冰1,周四桂1△
(1广东药学院临床药学系,2中山大学药学院药理与毒理学实验室,广东广州510006)
[摘要]目的:研究短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase,SCAD)在心肌细胞凋亡中的变化,探讨其与心肌细胞凋亡之间的关系。方法:以叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)刺激心肌细胞建立凋亡模型。检测细胞存活率、SCAD mRNA和蛋白表达、SCAD活性以及游离脂肪酸含量变化;并采用SCAD的最优干扰序列siRNA-1186进行干扰,观察其对心肌细胞凋亡的影响。结果:与对照组相比,在tBHP诱导的心肌细胞凋亡模型中,SCAD的mRNA和蛋白表达均显著下调。与阴性对照序列组相比,siRNA-1186干扰后心肌细胞的SCAD表达和活性明显下降,心肌细胞游离脂肪酸含量明显增加,同时,心肌细胞出现了明显凋亡,与tBHP诱导的心肌细胞凋亡趋势一致。结论: SCAD表达失调可能参与心肌细胞凋亡的过程,上调SCAD可能成为干预心肌细胞凋亡的重要环节之一。
[关键词]短链酰基辅酶A脱氢酶;心肌细胞;细胞凋亡;心力衰竭;能量代谢;叔丁基过氧化氢
[修回日期]2015-05-12
细胞凋亡是细胞在生理或病理条件下主动结束生命的过程,又称程序性细胞死亡,它在心脏发育和心血管疾病的发生发展过程中发挥着重要作用[1-2]。研究表明,心肌细胞凋亡是心肌肥厚向心力衰竭转化的重要机制,在肥大后期,由于心肌细胞的不断丢失,使心肌组织合胞体的功能逐渐受损,心功能逐渐降低,最终导致心力衰竭[3]。然而,诱发心肌细胞凋亡的相关因素及线粒体在心肌细胞凋亡中的作用机制尚未完全阐明。
心肌是耗能最多的组织之一。正常心肌能量的60%~90%由脂肪酸氧化提供[4]。因此,线粒体脂肪酸β氧化对于维持心肌能量代谢有重要意义。但是,心力衰竭时,心肌底物利用和能量代谢发生改变,即心肌的“代谢重构”[5]。心力衰竭初期,能量代谢底物从脂肪酸转化成葡萄糖优先利用,可以避免衰竭心脏发展至不可逆损伤的状态;心力衰竭后期,整个葡萄糖和脂肪酸的代谢速率均下降,使心肌出现能量缺乏,最终导致心脏功能紊乱[6]。
短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase,SCAD)是酰基辅酶A脱氢酶家族中的一员,特异性地分解短链酰基辅酶A底物,是脂肪酸β氧化的第一个限速步骤,是脂肪酸氧化的关键酶[7]。生理情况下,进入线粒体的酰基辅酶A在相应的脱氢酶作用下脱氢,开始脂肪酸β氧化循环,从而产生大量能量,供给心肌需要[8]。
在前期研究中,我们采用定量蛋白质组学技术比较了16周龄自发性高血压大鼠和血压正常大鼠的心肌蛋白质组,首次发现SCAD在自发性高血压大鼠肥大心肌中的表达明显降低[9]。进一步研究显示,在病理性心肌肥大的体内外模型中SCAD的表达和酶活性均显著下降。此外,采用siRNA对SCAD进行干扰,心肌细胞出现了明显的病理性肥大,表明SCAD的表达失调在病理性心肌肥大中具有重要意义[10-11]。然而,SCAD在心肌细胞凋亡中的作用尚不清楚。
本研究以叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)建立细胞凋亡模型,观察SCAD在心肌细胞凋亡中的变化,从心肌能量代谢的视角来探讨心肌细胞凋亡的发病机制,以期为心力衰竭寻找新的分子标志物,并为心力衰竭治疗寻找新的药物作用靶点。
材料和方法
1材料
RT-PCR测定试剂盒和TRIzol和SYBR Green购于TaKaRa; BCA蛋白定量试剂盒和Western blot发光液购于Thermo;细胞SCAD活性比色法定量检测试剂盒购于上海杰美基因;单克隆鼠抗α-tubulin、叔丁基过氧化氢购于Sigma;单克隆兔抗SCAD购于Abcam; Annexin V-FITC凋亡检测试剂盒购于凯基。
2方法
2.1乳鼠原代心肌细胞培养采用乳鼠心肌细胞改良法分离并培养心肌细胞,取1~3 d SD乳鼠心脏,0.08%胰蛋白酶冰上冷消化20 min后,37℃恒温水浴消化4 min,多次消化将乳鼠心脏消化成为单细胞悬液,收集细胞沉淀重悬后差速贴壁1 h去除成纤维细胞,取上清调节细胞密度接种于培养皿中,置于37℃、5% CO2培养箱中培养,并加入BrdU(0.1 mmol/L)抑制成纤维细胞生长。按照上述方法分离制备的心肌细胞,经α-actin抗体的免疫细胞化学染色,纯度可达95%以上,符合实验要求。
2.2tBHP处理心肌细胞选取正常培养2~3 d的心肌细胞用于实验,用不同浓度的tBHP刺激心肌细胞不同时间,以研究tBHP对心肌细胞凋亡的诱导及其与SCAD表达的量效及时效关系。
2.3心肌细胞活力的检测用MTT比色法测定心肌细胞活力。按照每孔5×104的浓度将心肌细胞接种于96孔板,按实验分组给予相应的处理因素,每组设6个复孔。处理终止后吸去原培养基,每孔加入MTT溶液(浓度为5 g/L) 20 μL,于5% CO2、37℃继续孵育4 h后,每孔加入150 μL的DMSO,摇床上振荡10 min使蓝紫色结晶甲臜充分溶解,在酶标仪570 nm处测其A值并计算各组细胞存活率。
2.4Real-time PCR检测mRNA的表达按照TRIzol说明书步骤提取细胞总RNA,紫外分光光度计检测RNA样品的260和280 nm波长下的A值,检测纯度并计算出RNA的浓度。参照RT-PCR试剂盒说明书进行逆转录反应。按照SYBR Green说明书反应体系加入荧光染料、引物和RT产物后在Bio-Rad IQ5 PCR仪中进行real-time PCR反应。反应程序为: 95℃10 s,90℃5 s,循环50次; 95℃15 s,60 ℃1 h,65℃30 s,循环61次。引物由上海生工合成,序列见表1。
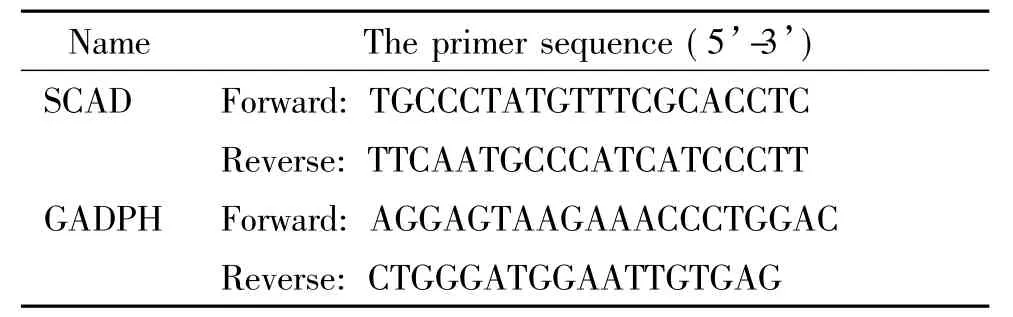
表1 Real-time PCR引物序列Table 1.The primers for the real-time PCR amplification
2.5Western blot法检测蛋白表达提取各组心肌细胞总蛋白,BCA试剂盒检测细胞蛋白含量后调整上样量,分装、变性,配置10% SDS分离胶和5%浓缩胶进行电泳,电泳结束后转移至PVDF膜(Bio-Rad),室温封闭1 h后加入Ⅰ抗(SCAD,1∶1 000;αtubulin,1∶10 000)过夜。漂洗后加入Ⅱ抗,室温孵育1 h,化学发光试剂增强反应,X线压片曝光、显影、定影,结果采用ImageJ图像分析系统对条带进行分析。
2.6SCAD活性的检测按照实验分组处理细胞,收集细胞后置于冰上裂解30 min,取上清液用BCA蛋白定量试剂盒定量蛋白。酶活性检测是基于2,6-二氯酚靛酚(2,6-dichlorophenol indophenol,DCPIP)作为人工电子受体,替代黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD),在SCAD的作用下,由短链脂酰辅酶A提供的电子,经过硫酸甲酯吩嗪(phenazine methosulphate,PMS)的传递,被还原为无色产物,通过分光光度仪的峰值变化(600 nm波长)来定量分析SCAD的活性。严格按照说明书采用酶标仪法进行检测。
2.7流式细胞术检测细胞凋亡用0.25%不含EDTA胰酶消化贴壁心肌细胞,1 000 r/min,5 min离心收集细胞,用PBS漂洗细胞2次,用500 μL结合缓冲液重悬细胞并调整细胞浓度。应用Annexin V/PI试剂盒进行双标。应用流式细胞仪检测心肌细胞膜磷脂酰丝氨酸外翻情况,计算凋亡细胞的百分比。
2.8siRNA干扰siRNA干扰序列购于上海吉玛制药技术有限公司。采用本实验室筛选出的最优干扰序列siRNA-1186进行实验,转染方法按照公司提供的转染试剂说明书进行。具体siRNA序列见表2。

表2 siRNA核酸序列Table 2.The primer sequences of siRNA
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件处理,组间比较采用单因素方差分析。并运用Bonferroni t检验进行组间两两比较,以P<0.05为差异有统计学意义。
结果
1 tBHP对心肌细胞存活率的影响
MTT比色法检测不同浓度tBHP(0、50、100、200、300和400 μmol/L)干预心肌细胞6 h后,细胞活力明显降低,且呈浓度依赖性;用200 μmol/L tBHP处理不同时间(0、1、2、6和8 h),发现细胞存活率也随时间的延长逐渐下降。当200 μmol/L tBHP作用6 h时细胞存活率约为50%,因此后续的RNA干扰实验采用200 μmol/L tBHP作用6 h进行研究,见图1。
2心肌细胞凋亡模型中SCAD的mRNA以及蛋白的表达变化
Real-time PCR结果显示,随着tBHP处理浓度和时间的增加,心肌细胞内SCAD的mRNA表达明显下降,见图2。Western blot的结果显示出与real-time PCR结果相一致的趋势,SCAD的蛋白表达均有下降,以浓度为200 μmol/L作用6 h和8 h时,SCAD的表达下降更为显著(P<0.01),见图3。
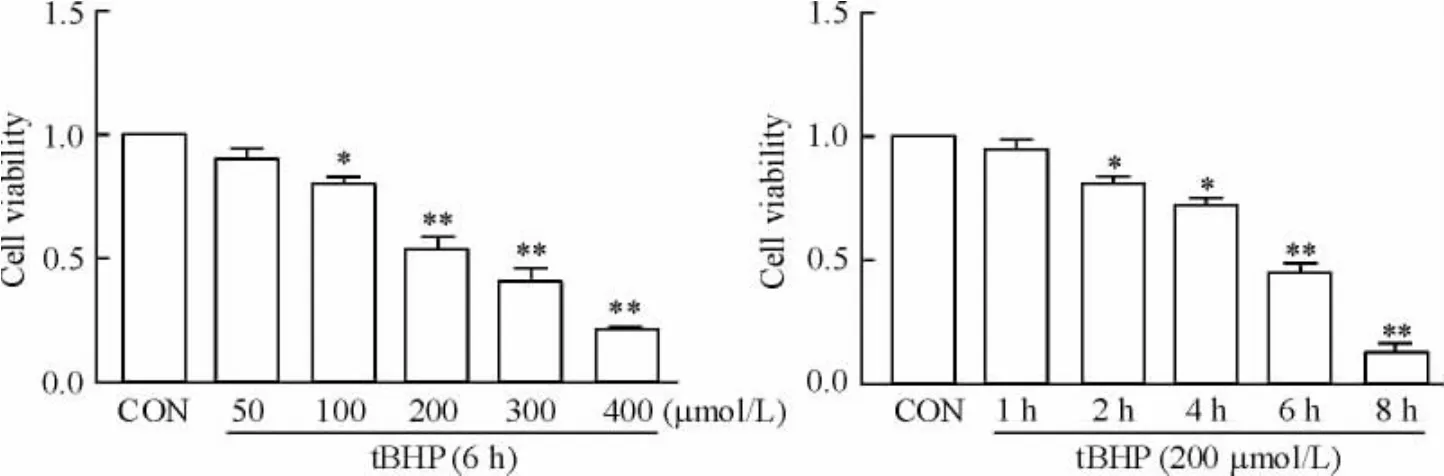
Figure 1.The viability of tBHP-treated cardiomyocytes.Mean±SD.n=3.*P<0.05,**P<0.01 vs CON.图1各组心肌细胞存活率的变化
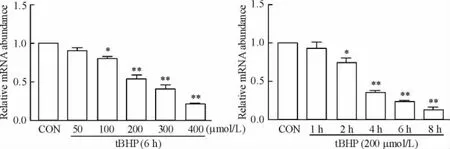
Figure 2.The mRNA expression of SCAD in tBHP-stimulated cardiomyocytes.Mean±SD.n=3.*P<0.05,**P<0.01 vs CON.图2 tBHP刺激后心肌细胞SCAD的mRNA表达
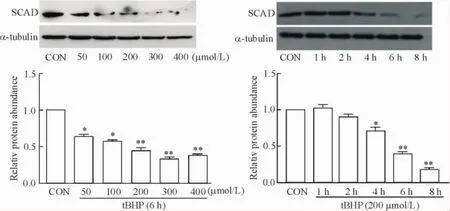
Figure 3.The protein expression of SCAD in tBHP-stimulated cardiomyocytes.Mean±SD.n=3.*P<0.05,**P<0.01 vs CON.图3 tBHP刺激后心肌细胞SCAD蛋白的表达变化
3 siRNA干扰序列的筛选结果
由图4可见,与空白对照和阴性对照组相比较,3条干扰序列siRNA-1186、siRNA-744和siRNA-207均可不同程度地降低SCAD的蛋白及mRNA表达,其中以siRNA-1186的降低程度最明显。这一趋势与SCAD活性检测结果的趋势一致,siRNA-1186组的SCAD活性相对于对照组的活性最低。因此,选择1186干扰序列进行后续研究。

Figure 4.Selection of the siRNA sequences in the cardiomyocytes.NC: negative control.Mean±SD.n=3.*P<0.05,**P<0.01 vs CON.图4 siRNA筛选结果
4 siRNA-1186敲低SCAD基因对心肌细胞存活率和凋亡率的影响
由图5可见,1186干扰序列通过瞬时转染对SCAD基因表达进行干扰后,心肌细胞存活率显著降低,心肌细胞出现了明显凋亡,其程度与刺激因素tBHP诱导的心肌细胞凋亡趋势一致。这表明SCAD在心肌细胞凋亡过程中可能具有重要作用,其表达量的降低可能是造成心肌细胞凋亡的一个重要因素。
5 siRNA-1186敲低SCAD基因对心肌细胞SCAD表达、SCAD活性及游离脂肪酸含量的影响
mRNA、蛋白表达以及酶活性水平结果均显示siRNA干扰可以明显减少心肌细胞SCAD的表达量,降低SCAD的活性。此外,心肌细胞对脂肪酸的氧化能力明显降低,心肌细胞内游离脂肪酸含量显著增多,SCAD下调对心肌细胞脂质代谢的影响与tBHP诱导心肌细胞凋亡导致的脂质变化一致,见图6。表明SCAD的表达下调可能导致了心肌细胞脂肪酸β氧化能力下降,从而引起心肌细胞的游离脂肪酸含量增加,导致心肌细胞凋亡发生。
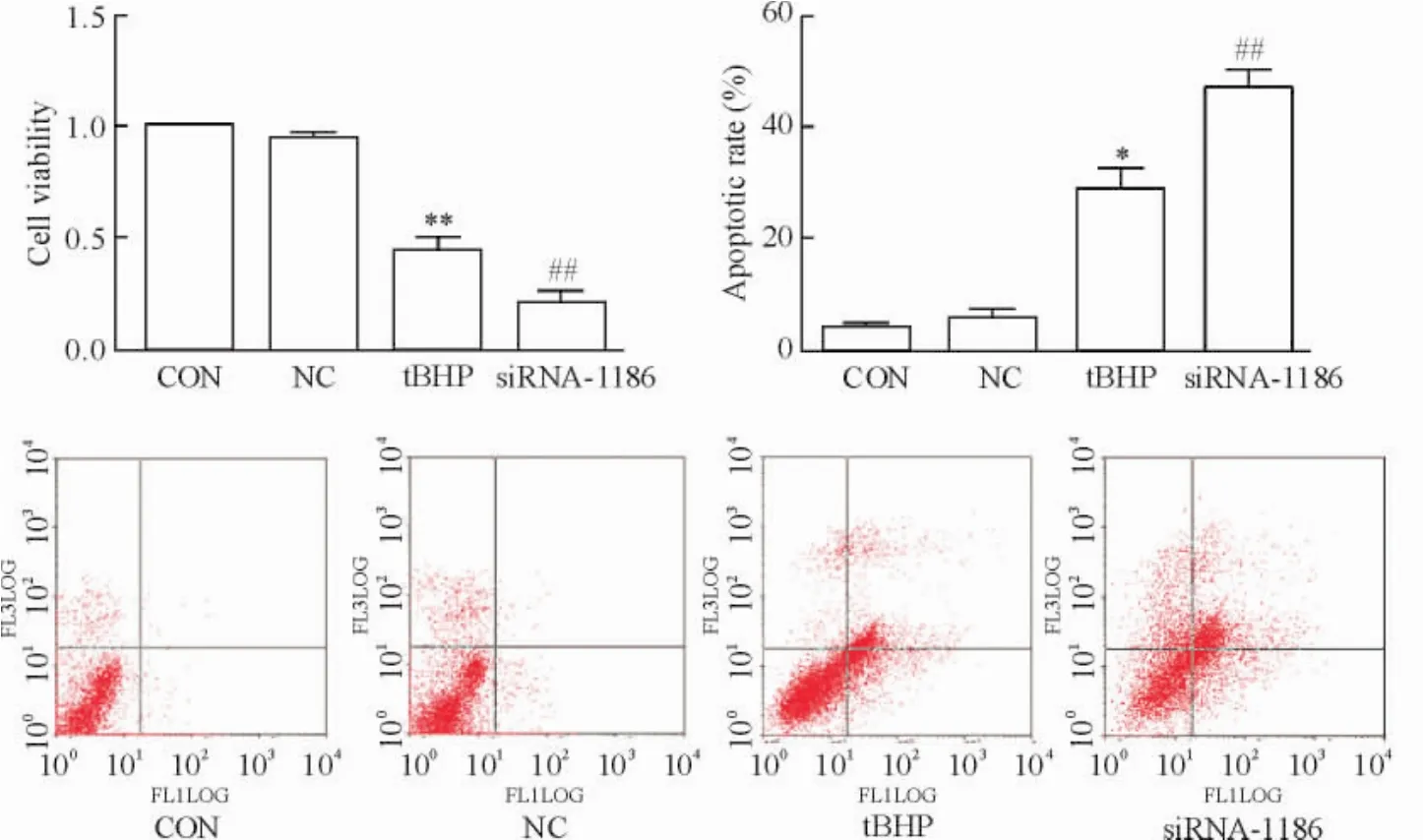
Figure 5.The changes of the viability and apopototsis of the cardiomyocytes treated with tBHP (200 μmol/L,6 h) or siRNA-1186 (48~72 h).NC: negative control.Mean±SD.n=3.*P<0.05,**P<0.01 vs CON;##P<0.01 vs NC.图5 siRNA-1186或tBHP诱导的心肌细胞凋亡模型中细胞存活率和凋亡率的变化
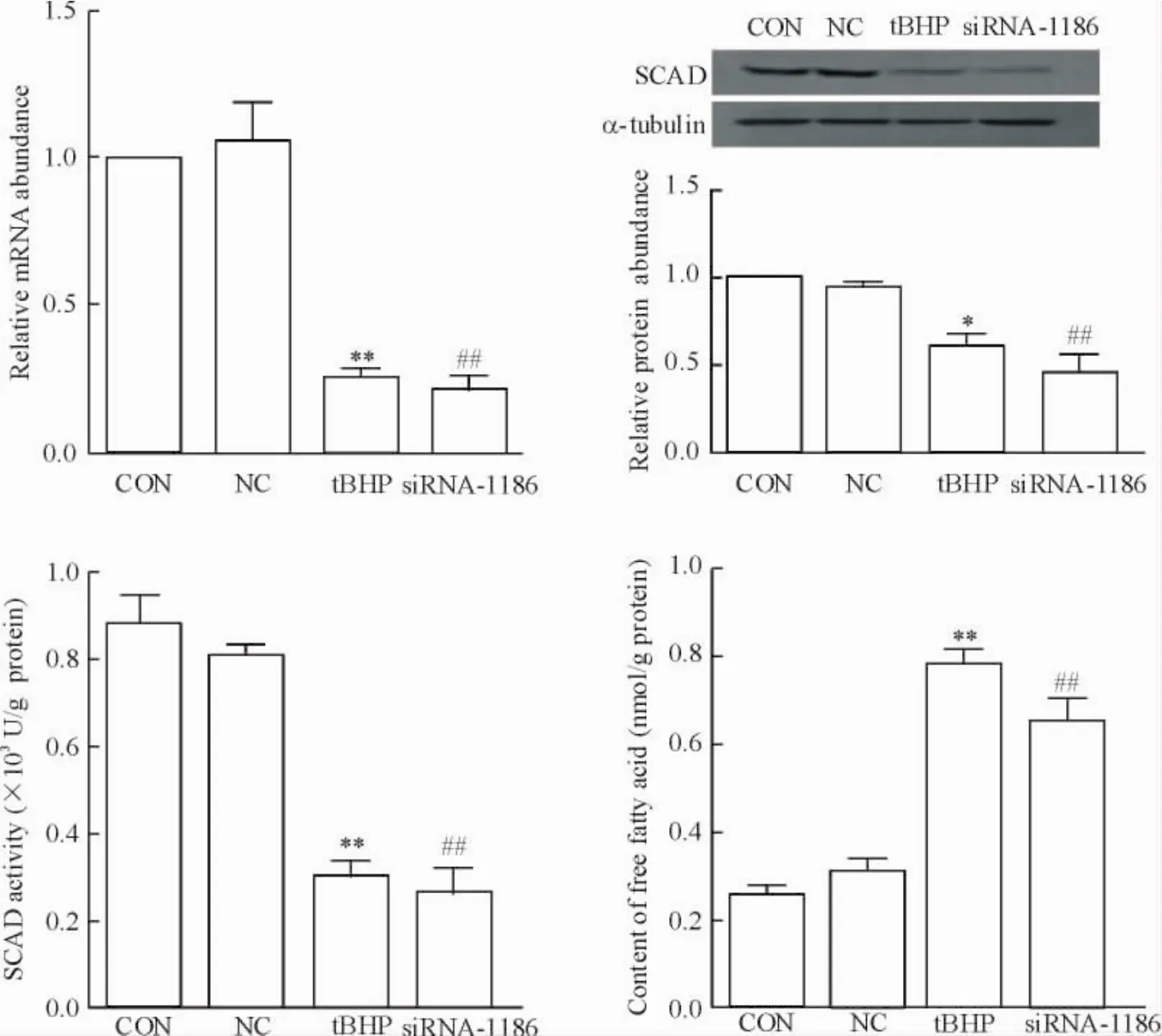
Figure 6.The expression and activity of SCAD and the content of free fatty acids in cardiomyocytes treated with tBHP (200 μmol/L,6 h) or siRNA-1186 (48~72 h).Mean±SD.n=3.*P<0.05,**P<0.01 vs CON;##P<0.01 vs NC.图6 siRNA-1186或tBHP诱导的凋亡模型中心肌细胞SCAD表达、SCAD活性及游离脂肪酸的变化
讨论
凋亡是在基因控制下一种程序性细胞死亡,能维持正常组织形态和功能。细胞凋亡是机体的一种生理防御机制,对于机体内环境的稳定起着重要的作用,过高或过低的凋亡都会对机体产生不利影响[12]。心肌是高耗能组织之一。正常心肌主要以产能高、需氧量大的脂肪酸氧化为主要产能方式,其中主要产能方式是心肌细胞线粒体内的β氧化。心力衰竭时,脂肪酸氧化减少并在细胞聚集增多导致脂毒性,心肌细胞凋亡增多,加速心功能恶化。因此,从心肌能量代谢角度防治心力衰竭,延缓心力衰竭进展,可能是一条新思路。
研究发现,很多与代谢酶相关的基因在心力衰竭发展过程中具有明显的表达变化,尤其是与脂肪酸氧化相关酶的基因[13-14]。SCAD是脂酰辅酶A脱氢酶家族成员之一,与脂肪酸β氧化密切相关[7]。我们的前期研究结果表明,病理性心肌肥大时,SCAD的表达量明显下降,与胚胎期的表达水平一致,能量代谢发生了胚胎型转变[11]。病理性心肌肥大最终会失代偿导致心力衰竭。而心肌细胞凋亡则是心肌肥厚向心力衰竭转化的重要机制。因此,我们进一步观察了SCAD在心肌细胞凋亡中的变化。
tBHP是一种脂质过氧化物,与H2O2性质相似,均可用来诱导构建细胞氧化损伤模型,但与H2O2相比具有稳定性高,不易降解的优点。研究发现,在体外,tBHP可诱导多种细胞凋亡,且低浓度时细胞多表现为凋亡,而高浓度多致细胞坏死[15]。本研究中,我们采用不同浓度的tBHP处理心肌细胞6 h且用200 μmol/L tBHP作用不同时间。MTT结果显示tBHP可以明显降低细胞存活率,且具有一定的浓度与时间依赖性。根据文献报道,常采用细胞存活率为40%~60%的处理因素来选择诱导凋亡[16]。因此,本研究选择200 μmol/L tBHP,刺激6 h作为后续RNA干扰部分的实验条件。此外,我们用相同时间和浓度的tBHP处理心肌细胞,随着浓度的增加和时间的延长,SCAD的mRNA和蛋白表达都有一定程度的下降,以浓度为200 μmol/L作用6 h和8 h时,SCAD的表达下降更为显著,表明在心肌细胞凋亡发生的过程中SCAD发生了明显的变化,这可能与心肌细胞凋亡途径中能量代谢的转变有关。
为了进一步明确SCAD与心肌细胞凋亡的关系,我们采用了RNA干扰技术,观察到siRNA干扰心肌细胞引起SCAD表达下调的同时,心肌细胞出现了明显的凋亡,与tBHP诱导心肌细胞凋亡的趋势一致,SCAD表达下调直接导致了心肌细胞凋亡的发生,表明SCAD表达下调在心肌细胞凋亡过程中具有重要作用。siRNA引起心肌细胞SCAD表达下调的同时,SCAD活性也明显下降,心肌细胞内游离脂肪酸含量显著增多,SCAD下调对心肌细胞脂质代谢的影响与tBHP诱导心肌细胞凋亡导致的脂质变化一致。这表明SCAD的表达下调可能导致了心肌细胞脂肪酸β氧化能力下降,从而引起心肌细胞的游离脂肪酸含量增加,导致心肌细胞凋亡发生,这一结果与能量代谢途径改变和心肌细胞凋亡有密切关系的文献报道相一致[3]。
综上所述,SCAD在心肌细胞凋亡过程中可能发挥了至关重要的作用,为我们进一步研究SCAD在心肌细胞凋亡中的作用奠定了基础。然而,SCAD的表达失调在心肌细胞凋亡中的具体作用机制还有待进一步研究。
[参考文献]
[1]Whelan RS,Kaplinskiy V,Kitsis RN.Cell death in the pathogenesis of heart disease: mechanisms and significance[J].Annu Rev Physiol,2010,72: 19-44.
[2]Zhang Y,Herman B.Apoptosis and successful aging[J].Mech Ageing Dev,2002,123(6) : 563-565.
[3]刘伟,冯兵.能量代谢途径改变对心肌细胞凋亡的影响[J].中国病理生理杂志,2004,20(12) : 2342-2346.
[4]Scolletta S,Biagioli B.Energetic myocardial metabolism and oxidative stress: let’s make them our friends in the fight against heart failure[J].Biomed Pharmacother,2010,64(3) : 203-207.
[5]van Bilsen M,van Nieuwenhoven FA,van der Vusse GJ.Metabolic remodelling of the failing heart: beneficial or detrimental?[J].Cardiovasc Res,2008,81(3) : 420-428.
[6]陈游洲,袁建松,乔树宾.心力衰竭中能量代谢重构研究进展[J].中国循环杂志,2014,4(29) : 306-308.
[7]Edhager AV,Stenbroen V,Nielsen NS,et al.Proteomic investigation of cultivated fibroblasts from patients with mitochondrial short-chain acyl-CoA dehydrogenase deficiency [J].Mol Genet Metab,2014,111(3) : 360-368.
[8]Marthe HR,Plamena RA,Ying Z,et al.Nrf2 affects the efficiency of mitochondrial fatty acid oxidation[J].Biochem J,2014,457(3) : 415-424.
[9]Zhou SG,Zhou SF,Huang HQ,et al.Proteomic analysis of hypertrophied myocardial protein patterns in renovascularly hypertensive and spontaneously hypertensive rats[J].J Proteome Res,2006,5(11) : 2901-2908.
[10]黄金贤,罗佳妮,刘培庆,等.AMPK/PPARα/SCAD信号途径对心肌肥大的调控研究[J].中国病理生理杂志,2014,30(5) : 769-778.
[11]周四桂,王平,路遥,等.短链酰基辅酶A脱氢酶在大鼠心脏发育中的表达及其与心肌肥厚的关系[J].中国病理生理杂志,2013,29(1) : 9-14.
[12]周凤华,贾钰华,李丽君.H2O2上调乳鼠心肌细胞PDCD5的表达[J].辽宁中医杂志,2010,8 (37) : 1599-1601.
[13]Kolwicz SC Jr,Purohit S,Tian R.Cardiac metabolism and its interactions with contraction,growth,and survival of cardiomyocytes[J].Circ Res,2013,113 (5) : 603-616.
[14]Siddiqi N,Singh S,Beadle R,et al.Cardiac metabolism in hypertrophy and heart failure: implications for therapy [J].Heart Fail Rev,2013,18(5) : 595-606.
[15]Sardão VA,Oliveira PJ,Holy J,et al.Vital imaging of H9c2 myoblasts exposed to tert-butylhydroperoxide: characterization of morphological features of cell death[J].BMC Cell Biol,2007,8: 11.
[16]Zhang F,Huang B,Zhao Y,et al.BNC protects H9c2 cardiomyoblasts fromH2O2-induced oxidative injury through ERK1/2 signaling pathway[J].Evid Based Complement Alternat Med,2013,2013: 802784.
(责任编辑:陈妙玲,罗森)
Effects of short-chain acyl-CoA dehydrogenase on cardiomyocyte apoptosis
ZENG Zhen-hua1,HUANG Qiu-ju1,HUANG Jin-xian1,SHU Zhao-hui1,LIU Pei-qing2,CHEN Shao-rui2,LIU Bing1,ZHOU Si-gui1
(1Department of Clinical Pharmacy,Guangdong Pharmaceutical University,2Department of Pharmacology and Toxicology,School of Pharmaceutical Sciences,Sun Yat-sen University,Guangzhou 510006,China.E-mail: zhousg201014@163.com)
[ABSTRACT]AIM: To investigate the change of short-chain acyl-CoA dehydrogenase (SCAD) expression during cardiomyocyte apoptosis and to explore the relationship between SCAD and cardiomyocyte apoptosis.METHODS: The neonatal rat cardiomyocytes treated by tert-butyl hydroperoxide (tBHP) were used as the model of cardiomyocyte apoptosis.The cell viability,the expression of SCAD at mRNA and protein levels,the activity of SCAD and the content of free fatty acids were determined.RESULTS: The mRNA and protein expression of SCAD decreased in the cardiomyocyte apoptosis model.Compared with negative control group,SCAD expression and activity were both significantly decreased in siRNA-1186 group,but the content of free fatty acids were obviously increased in the cardiomyocytes.Meanwhile,SCAD siRNA treatment triggered the same apoptosis as cardiomyocytes treated with tBHP.CONCLUSION: Down-regulation of SCAD may play an important role in primary cardiomyocyte apoptosis.Increase in the expression of SCAD may become an important part in intervening cardiomyocyte apoptosis.
[KEY WORDS]Short-chain acyl-CoA dehydrogenase; Cardiomyocytes; Apoptosis; Heart failure; Energy metabolism; Tert-butyl hydroperoxide
通讯作者△Tel: 020-39352123; E-mail: zhousg201014@163.com
*[基金项目]国家自然科学基金青年科学基金资助项目(No.81000072) ;广东省“十二五”医学重点学科,依托广东药学院附属第一医院、药科学院;广东省科技计划(No.2014A020212315)
[收稿日期]2015-04-09
[文章编号]1000-4718(2015)09-1589-06
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.010
