猪α干扰素基因突变、表达及其高效抗病毒活性筛选研究
2015-04-26爽张杏崔栩刘海燕苏敬良金忠辉
李 爽张 杏崔 栩刘海燕苏敬良金忠辉∗
(1.北京伟嘉集团创新研究院,北京102206;2.中国农业大学动物医学院,北京100193)
猪α干扰素基因突变、表达及其高效抗病毒活性筛选研究
李 爽1,2,张 杏1,崔 栩1,刘海燕1,苏敬良2,金忠辉1,2∗
(1.北京伟嘉集团创新研究院,北京102206;2.中国农业大学动物医学院,北京100193)
利用RT-PCR方法从猪肝细胞总RNA中扩增出编码猪α干扰素基因,根据大肠杆菌偏嗜性及活性位点改造基因并克隆至原核表达载体pET21a,转化大肠杆菌BL21(DE3)进行蛋白诱导表达和鉴定。重组蛋白以包涵体形式表达,经变-复性及纯化处理后,获得多种不同基因型的高纯度猪α干扰素。用细胞病变抑制法在MDBK/VSV系统上进行抗病毒活性测定,结果表明经过基因改造的猪α干扰素(PoIFN-M6)具有更高抗病毒活性,约为2.97×108U/mg。本研究为猪α干扰素基因工程产品的研发及其在临床兽医的应用奠定基础。
猪α干扰素;表达;基因型;抗病毒活性
随着我国养猪业从传统养殖向规模化、集约化模式地迅速发展,疾病的威胁也随之增加,尤其是猪病毒性疾病严重制约着行业的持续发展。干扰素(Interferon,IFN)是动物机体第一抵御病毒体系,具有广谱抗病毒活性,可以有效的抑制RNA病毒及DNA病毒的复制[1-3]。因此,发展有广谱抗病毒效应的猪干扰素具有重要的意义。
近年来,基因工程技术发展快速,国内外许多学者利用不同的表达系统对干扰素进行表达[4-6],然而干扰素的相关分子结构、理化特性、生物学特性、产生和作用机理等仍需进一步研究。国内学者曹瑞兵等[7]发现IFN基因中含有较多的大肠杆菌稀有密码子,并对其进行基因改造获得干扰素抗病毒活性为6.4×106U/mg。陈涛等[8]用定点突变方法把猪α干扰素第86位半胱氨酸(Cys)突变为酪氨酸(Tyr),获得蛋白活性为5.2×103IU/mg。Li等[9]根据不同亚型干扰素基因合成保守猪α干扰素序列(consensus porcine interferon,CoPoIFN-α),抗病毒活性提高约10倍。研究从猪肝脏中克隆获得猪α干扰素基因,根据大肠杆菌偏嗜性及活性位点改造基因,然后利用大肠杆菌融合表达系统表达猪α干扰素融合蛋白,目的产物较原始序列对应的蛋白具有更高的抗病毒活性。本研究为猪α干扰素基因工程产品的研发及其在兽医临床的应用奠定基础。
1 材料与方法
1.1 材料 菌种和质粒:感受态细胞E.coliBL21(DE3),北京康为世纪生物科技有限公司,质粒pET21a为中国农业大学动物医学院苏敬良博士惠赠;工具酶和试剂:Phusion高保真DNA聚合酶、内切酶、T4 DNA连接酶购自NEB公司;Trizol及Su⁃perscript III反转录试剂盒购自Invitrogen;一步法快速WB(HRP)试剂盒购自北京康为世纪生物科技有限公司,小鼠抗猪α干扰素抗体(ab11408)购自美国Abcam公司,其它试剂均为国产分析纯;牛肾细胞(MDBK)及水疱性口炎病毒(VSV)为本实验室保存。
1.2 方法
1.2.1 猪肝脏总RNA提取与猪α干扰素基因克隆
用Trizol试剂法提取猪肝脏总RNA,以总RNA为模板,用SuperscriptⅢ反转录试剂盒合成cDNA。根据 GenBank公布的猪 α干扰素序列(No.KF414740.1),设计扩增引物(1F:ATGGCCCCAA CCTCAGCCTTCCT; 1R: TCACTCCTTCTTCCT⁃GAGTCTGTC),以cDNA为模板,进行PCR扩增,扩增条件:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸60 s,30个循环,所得产物即为猪α干扰素,命名为PoIFN-α。1%琼脂糖凝胶电泳鉴定后,送北京诺赛基因组研究中心有限公司测序。
1.2.2 猪α干扰素序列分析及定点突变 将获得的猪α干扰素序列与GenBank公布的序列进行对比。根据大肠杆菌偏嗜性,将稀有密码子进行改造并交于公司重新合成,根据文献报道对基因序列进行定点突变(表1)。利用overlap PCR方法设计突变引物,以PoIFN-α为模板对第38、78、152、156位氨基酸进行突变获得 PoIFN-M1、PoIFN-M2及PoIFN-M3。在之前突变序列的基础上对第86位氨基酸进行突变,获得PoIFN-M4、PoIFN-M5及PoIFN-M6。

表1 猪α干扰素突变位点
1.2.3 重组猪α干扰素原核表达质粒的构建 根据pET21a多克隆位点设计带有BamHI、XhoI酶切位点引物(BF:CGCGGATCCTGCGACCTGCCT⁃CAGAC;XR: CCGCTCGAGTCACTCCTTCTTCCT⁃GAG),以突变的不用基因型干扰素基因为模板进行扩增,用1%琼脂糖凝胶分离回收扩增产物。分别用BamHI、XhoI对pET21a和扩增产物进行双酶切后,16℃进行连接。连接产物转化至感受态细胞E.coliBL21(DE3),菌落PCR筛选阳性克隆并测序,测序正确后进行表达。
1.2.4 重组猪α干扰素原核表达及包涵体提取挑选阳性克隆菌株接种于含氨苄青霉素的LB培养基,37℃振荡培养过夜,次日以10%接种扩大培养,37℃继续培养,当菌液 OD600=0.6时,加入IPTG(0.5 mmol/L)于37℃诱导表达,表达5 h后收集菌体,超声波裂解、离心,分别取上清和沉淀进行SDS-PAGE电泳,检测重组蛋白的表达形式。超声波破碎后,离心沉淀用适量包涵体洗涤液(50 mmol/L Tris-HCl;10 mmol/L EDTA;0.5% Triton X-100;0.15 mol/L NaCl)洗涤2次,再次离心得到初步纯化的包涵体。
1.2.5 重组猪α干扰素原核包涵体变性及复性将获得包涵体加入 9倍体积的包涵体裂解液(50 mmol/L Tris-HCl;2 mmol/L EDTA;6 mol/L盐酸胍;10 mmol/L DTT),剧烈震荡后4℃过夜直至完全溶解,离心上清液即为变性后蛋白。将变性蛋白过加入已平衡的Ni-Agarose,用500 mmol/L咪唑洗脱目的蛋白,收集洗脱液,加入包涵体复性液(50 mmol/L Tris-HCl;0.2 mmol/L EDTA;0.5 MLArg;1 mmol/L GSSG;3 mmol/L GSH;1mol/L盐酸胍;0.15 mol/L NaCl)中,4℃静置4 h,离心取上清即为复性的重组蛋白。将溶液放入透析袋中,4℃条件下用0.01 mol/L PBS(pH 7.2)透析72 h,无菌过滤后测定蛋白含量及抗病毒活性。
1.2.6 Western-bolt鉴定 将获得的重组蛋白经SDS-PAGE电泳后,电转至硝酸纤维素膜,然后用含5%BSA的PBST封闭过夜,以小鼠抗猪α干扰素抗体作为一抗,HRP标记的兔抗鼠IgG为二抗,显色试剂盒显色。
1.2.7 重组猪α干扰素原核的活性测定 微量细胞病变抑制法测定重组猪α干扰素生物学活性,采用MDBK-VSV系统测定。将抑制50%细胞病变(CPE50)的干扰素的最高稀释度定为1个干扰素单位(U)。
2 结果
2.1 猪α干扰素基因克隆及定点突变 以提取的新鲜猪肝细胞总RNA为模板,RT-PCR产物电泳后可见一条570 bp大小的条带,与预期一致(图1)。测序结果表明,克隆产物大小为 570 bp,与GenBank上发表的猪α干扰素基因同源性为100%(No.EU127823.1)。基因组含有一个ORF,共编码189个氨基酸。其中前23个氨基酸为信号肽,后166个氨基酸为 IFN-α成熟序列。利用 overlap PCR方法获得设计引物并对24-189位氨基酸进行蛋白表达。

图1 猪α干扰素基因扩增
2.2 表达载体的构建及鉴定 用BamHI和XhoI双酶切pET21a及获得的突变基因PCR产物,16℃连接。连接产物转化至感受态细胞E.coliBL21(DE3)中,挑取单个转化菌培养,提取质粒,BamHI和XhoI双酶切鉴定,结果与设计一致(图2)。
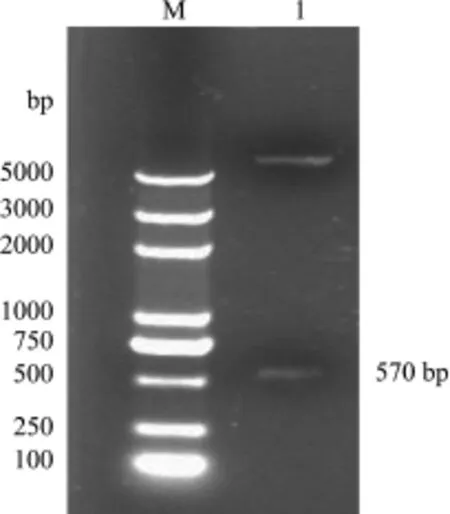
图2 pET-PoIFN-a的双酶切鉴定
2.3 重组蛋白的表达 取诱导菌体,用加样缓冲液煮沸10 min后作SDS-PAGE鉴定。在电泳图谱上出现一条约19 kD的目的条带(图3),经过灰度分析软件Image J分析表明,目的蛋白约占细菌总蛋白的17%。收集诱导表达后的菌体,分别取超声破菌的上清液和离心后的沉淀作SDS-PAGE分析,结果显示表达蛋白以包涵体形式存在。
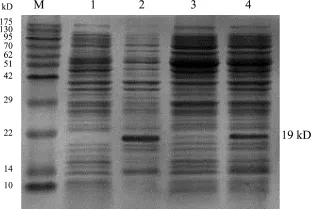
图3 猪α干扰素在重组菌株中的表达
2.4 包涵体的变性、复性与纯化 包涵体用含Triton X-100的洗涤液洗涤,得到初步纯化的包涵体。包涵体在含6 mol/L盐酸胍的变性液中溶解至澄清,经 Ni-Agarose纯化后的变性蛋白在含1 mol/L盐酸胍的复性液中复性,复性后重组蛋白进行SDS-PAGE分析,结果表明复性的重组猪α干扰素纯度高于95%(图4)。

图4 重组猪α干扰素纯化
2.5 Wester-bolt鉴定 重组猪α干扰素经转印,将蛋白区带转到硝酸纤维膜上,用小鼠抗猪α干扰素抗体和HRP标记抗体与之反应、显色,结果显示在相对分子质量约为19 kD处出现清晰的区带(图5)。
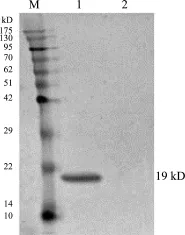
图5 猪α干扰素的Western-blot检测
2.6 重组猪α干扰素活性的测定 重组猪α干扰素的活性测定采用目前国内外通用的MDBK/VSV系统微量细胞病变抑制法。多次活性检测结果表明,复性后的重组蛋白在MDBK细胞上表现出较高的抗病毒活性,能够有效地抑制VSV病毒。将抑制50%细胞病变(CPE)的干扰素的最高稀释度定为1个干扰素单位。检测结果显示(表2),经过基因改造的干扰素蛋白活性较原始序列对应的蛋白具有更高的抗病毒活性,第86位氨基酸的突变能明显提高重组干扰素蛋白活性,其中PoIFN-M6活性最高,约为2.97×108U/mg。

表2 重组干扰素蛋白抗病毒活性测定
3 讨论
本研究应用PCR技术从猪肝细胞基因组中克隆出猪α干扰素基因,测序结果表明本研究克隆的的猪α干扰素基因与GenBank上发表的猪α干扰素基因同源性为100%,全基因为570 bp,编码166个氨基酸的成熟蛋白和23个氨基酸的信号肽。猪α干扰素无内含子,无糖基化位点。在氨基酸水平上,猪 α干扰素与人类 α干扰素的同源性为77.8%,而与猪β干扰素及猪γ干扰素的同源性为53.1%和41.7%。
根据大肠杆菌偏嗜性及文献报道的增强抗病毒活性位点[8-9],对克隆的猪 α干扰素进行突变,以增加其表达量及提高抗病毒活性。改造的重组猪α干扰素连接至带有His标签的pET21a,pET系统在E.coli表达系统中具有较大的优点,pET质粒的T7强转录及翻译信号控制的T7 RNA聚合酶机制,能充分诱导表达目的蛋白。构建工程菌经过IPTG诱导表达的重组猪α干扰素约占细菌总蛋白的17%。通过软件分析重组猪α干扰素具有较强的疏水性,本研究重组蛋白以包涵体形式表达,包涵体可以通过洗涤、离心方法将其迅速纯化,但包涵体蛋白需经过变复性处理才能得到有生物活性的蛋白。Hagihara等[10]发现高浓度盐酸胍可使天然蛋白的高级结构发生破坏而低浓度的盐酸胍能够保护伸展肽链和部分折叠片段的疏水基团,可辅助蛋白质复性。本研究在复性液中加入终浓度为1 mmol/L的盐酸胍可较好提高重组蛋白在复性液中的溶解度并促进其复性。
试验通过对猪α干扰素序列进行定点突变,获得不同基因型重组蛋白,抗病毒活性检测结果显示经过基因改造的干扰素蛋白活性较原始基因抗病毒活性增高,第86位氨基酸的突变能明显提高重组干扰素蛋白活性。成熟PoIFN-α基因存在5个半胱氨酸,其中在1、99和29、139位之间形成2个二硫键,有研究发现存在的二硫键对干扰素活性具有重要影响[11]。Wang等[12]报道将IFN的第86位Cys突变为Asp,生物学活性有明显提高。另外陈涛等[8]也发现突变86位Cys能提高干扰素活性。推测可能在包涵体表达情况下,重组蛋白复性过程中86位Cys错配影响正常二硫键结构从而降低干扰素活性。Li[9,13]通过同源建模发现其中38、78位氨基酸分别位于IFN helixB及Loop CD结构,38、151位氨基酸相邻并且它们所在的肽链均指向结构核,156位氨基酸与IFNAR2受体结合部位较近,突变后可能影响IFN与IFNAR2受体结合结构,从而改变干扰素生物活性活性,对干扰素基因序列研究还需要进一步深入研究。
试验通过对猪干扰素基因进行突变改造,筛选较高生物活性的重组蛋白,为进一步研究和利用基因工程猪α干扰素奠定基础。
[1]Haller O,Kochs G,Weber F.The interferon response circuit:induction and suppression by pathogenic viruses[J].Virology,2006,344(1):119-130.
[2]Buddaert W,Van Reeth K,Pensaert M.In vivoandin vitrointerferon(IFN)studies with the porcine reproductive and respiratory syndrome virus(PRRSV)[J].Advances in experimental medicine and biology,1998,440:461-467.
[3]Pol J M,Broekhuysen-Davies J M,Wagenaar F,et al.The influence of porcine recombinant interferon-alpha 1 on pseudorabies virus infection of porcine nasal mucosain vitro[J].The Journal of general virology,1991,72(4):933-938.
[4]Xia C,Dan W,Wen-Xue W,et al.Cloning and expression of interferon-α/γ from a domestic porcine breed and its effect on classical swine fever virus[J].Veterinary immunology and immunopathology,2005,104(1-2):81-89.
[5]张 杏,李 爽,崔 诩,等.猪α-干扰素表达系统及其应用的研究进展[J].中国兽药杂志,2014,48(10):60-62.
[6]Lefevre F,La Bonnardiere C.Molecular cloning and sequencing of a gene encoding biologically active porcine α-interferon[J].Journal of interferon research,1986,6(4):349-360.
[7]曹瑞兵,徐学清,周 斌,等.猪α1-干扰素的基因改造与高效原核表达 [J].生物工程学报,2004,20(2):291-294.
[8]陈 涛,于瑞嵩,刘惠莉,等.重组猪α干扰素基因定点突变及在大肠杆菌中的表达 [J].生物工程学报,2002,18(3):339-342.
[9]Huang L,Cao R B,Wang N,et al.The design and recombinant protein expression of a consensus porcine interferon:CoPoIFN-alpha[J].Cytokine,2012,57(1):37-45
[10]Hagihara Y,Tan Y,Goto Y.Comparison of the conformational stability of the molten globule and Native States of horse cytoch rome c: Effects of acetylation, heat, urea and guanidinehydrochloride[J].Journal of molecular biology,1994,237(3):336-348.
[11]Brierley M M,Fish E N.Review:IFN-alpha/beta receptor interactions to biologic outcomes: understanding the circuitry[J].J Interferon Cytokine Res 2002,22(8):835-845.
[12]Wang W,Hou Y D.Construction of an interferon mutant(IFN-α1/86D)and its biological activities[J].Chinese Journal of Virology,1990,6(4):322-325.
[13]Piehler J,Schreiber G.Biophysical analysis of the interaction of human ifnar2 expressed inE.coliwith IFN alpha2.[J]Journal of molecular biology,1999,289(1):57-67.
(编 辑:陈 希)
The Mutations,Expression and Antiviral Activity Screening of Porcine Interferon-α
LI Shuang1,2,ZHANG Xing1,CUI Xu1,LIU Hai-yan1,SU Jing-liang2,JIN Zhong-hui1,2∗
(1.Innovation Research Institute,Beijing Vica Group,Beijing100085,China;2.College of Veterinary Medicine,China Agricultural University,Beijing100193,China)
The aim of this study is to obtain porcine interferon-α with high antiviral activity.Total RNA extracted from swine liver was used for the generation of the porcine interferon-α cDNA.Here we optimized the codon usage of the gene forE.coli.Then the reconstructed fragments were cloned into vector pET21a to obtain the different genotypes of interferon-α,and expressed inE.coliBL21(DE3).The results showed that the protein was expressed as inclusion body.After dissolution,re-naturation and purification,we gained the pure protein.The effect of the reconstructed porcine interferon-α on reduction of viral cytopathic effect(CPE)was detected in MDBK cells infected with vesicular stomatitis virus(VSV).As a result,the protein PoIFN-M6 was verified to have a high antivital activity by CPE inhibition test,which was about 2.97×108U/mg.The research laid the foundation for the genetic expression of porcine interferon-α and the clinical use of it.
porcine interferon-α;expression;genotype;antiviral activity
2014-12-25
A
1002-1280(2015)04-0012-05
S859.79
李 爽,博士后,从事动物疾病诊断方面研究。
金忠辉。E-mail:jzh@vicagroup.com.cn
