胡杨和灰叶胡杨不同器官寄藏的可培养微生物种类研究
2015-04-25谷思辰王玉丽李志军李健强
李 倩 谷思辰 王玉丽 李志军 李健强*
(1中国农业大学植物病理学系/农业部植物病理学重点开放实验室, 北京 100193)(2 种苗健康北京市工程研究中心/种子病害检验与防控北京市重点实验室, 北京 100193)(3 塔里木大学植物科学学院/新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
胡杨和灰叶胡杨不同器官寄藏的可培养微生物种类研究
李 倩1, 2谷思辰1, 2王玉丽3李志军3李健强1, 2*
(1中国农业大学植物病理学系/农业部植物病理学重点开放实验室, 北京 100193)(2 种苗健康北京市工程研究中心/种子病害检验与防控北京市重点实验室, 北京 100193)(3 塔里木大学植物科学学院/新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
采用洗涤法和平皿检测等方法,研究了胡杨和灰叶胡杨不同器官寄藏的可培养微生物种类。结果显示,胡杨种子内部和外部带菌量显著高于灰叶胡杨;灰叶胡杨的芽、叶柄及枝条带菌量均高于胡杨,其中叶柄、枝条上部和中部带菌量显著高于胡杨;胡杨和灰叶胡杨枝条带菌率由低到高依次为:上部<中部<下部,且两个物种枝条下部带菌率均达100 %。从胡杨及灰叶胡杨种子、芽、叶柄及枝条各器官分离到可培养的真菌7株、细菌2株;经形态学及分子生物学方法鉴定,分别为Alternaripp.(链格孢属,3种)、Aspergillusspp.(曲霉属,2种)、Nigrosporasp.(黑孢霉属)、Epicoccumsp.(附球菌属)、Stenotrophomonasspp.(嗜麦芽窄食单胞菌属,2种),其中黑孢霉属和附球菌属真菌系胡杨和灰叶胡杨内生菌首次报道;链格孢属、曲霉属真菌及嗜麦芽窄食单胞菌属细菌为胡杨和灰叶胡杨种子外部携带可培养微生物首次报道。
胡杨 灰叶胡杨;种子;器官;可培养微生物
胡杨(PopuluseuphraticaOliv.)和灰叶胡杨(P.pruinosaSchrenk.)是珍稀和濒危的珍贵物种,属杨柳科(Salicaceae)杨属(Populus)胡杨亚属落叶乔木[1-2]。近年来由于人为采伐、过度放牧、生存条件恶化等原因,胡杨和灰叶胡杨林大面积锐减[2]。胡杨和灰叶胡杨种子个体微小,种皮薄,种子活力极难保持[3];且苗期易受粉被栅锈菌(MelampsorapruinosaeTranz.)侵染引起锈病[4-5],上述两方面已成为胡杨和灰叶胡杨人工育苗造林的瓶颈问题。胡杨和灰叶胡杨抗逆性强[6],具有防风固沙、涵养水源、调节地方气候等一系列重要的生态价值和功能[7],其内生微生物种类及其在与胡杨和灰叶胡杨极端的荒漠沙漠环境共进化过程中形成特殊的生物学特征、潜在的风险、应用价值以及生物资源挖掘等,是值得高度关注和深入研究的问题。
植物内生菌(endophyte)是指那些在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部,又不引起植物明显病害的微生物[8]。植物体内普遍存在着内生菌[9],通常情况下大多数为条件致病菌,长期寄生于植物体内,与寄主植物协同进化,已经成为一种新的微生物资源,得到了研究者的广泛关注。研究表明,植物内生菌能够产生抗生素和植物生长调节物质[9],因此具有植物病虫害生物防治、促进植物生长等功能,是宝贵的生防资源。研究植物微生态组成是保护植物健康和挖掘植物内生微生物资源的重要途径。植物内生菌能够产生抗生素类物质,发挥抗菌防病作用[10]。内生附球菌(Epicoccumnigrum)孢子悬浮液可以防治桃褐腐病[11];来自于桂树的内生真菌Muscodoralbus产生的挥发性气体物质能够抑制或杀死多种植物病原真菌[12]、细菌[12]、线虫[13]及害虫[14],该菌已成功开发为生物熏蒸剂广泛应用于粮食作物、蔬菜及水果上的土传病害、种传病害及采后病害防治。目前国内外仅见对分离自胡杨树皮的内生菌链格孢属(Alternaria)、曲霉属(Aspergillus)真菌菌株生理特性[15]、胡杨树干内存液内生细菌[16]和酵母菌[17]以及胡杨根际[18]和土壤微生物多样性[19-20]的研究,国内外有关胡杨和灰叶胡杨主要繁殖材料种子及枝条等器官携带的可培养微生物种类及数量的研究鲜有报道。基于此,本文选择采自新疆塔里木地区的胡杨和灰叶胡杨种子、芽、叶柄和枝条等为试验材料,开展了不同器官寄藏的可培养微生物的分离培养、种类鉴定及数量比较研究,旨在探明胡杨及灰叶胡杨各器官携带微生物的种类,为后续开展寄藏微生物的致病致害性、微生物资源开发与利用以及胡杨和灰叶胡杨种子和苗木的药剂消毒处理,指导人工育苗造林生产实践提供理论依据。研究结果报道如下。
1 材料与方法
1.1 供试材料
1.1.1 植物材料
2010年8月于新疆阿拉尔地区(海拔904m,东经81° 10.303',北纬40° 33.434')采集胡杨(Populuseuphratica)、灰叶胡杨(P.pruinosa)的芽、叶柄、枝条和成熟的蒴果,将蒴果置于室内使其自然开裂,随后将其置于纱网上轻轻揉搓,使冠毛和种子分离,收集去冠毛的种子样品备用。
1.1.2 供试试剂
CTAB(北京奇华盛生物技术发展中心),Tris饱和酚(北京鼎国生物技术发展中心),氯仿(北京北化精细化学品有限责任公司),次氯酸钠、异戊醇、异丙醇、乙醇(北京化学试剂公司),均为市售。
1.2 试验方法
1.2.1 可培养微生物的分离和纯化
1.2.1.1 胡杨和灰叶胡杨种子外部携带可培养微生物检测:称取胡杨种子0. 35g、灰叶胡杨种子0. 25g(胡杨种子千粒重0. 07g、灰叶胡杨种子千粒重0. 05g,估算得两种待测种子数各5000粒)分别置于10mL灭菌水中,充分震荡后单层纱布过滤,将滤液离心10min(5000r/min),弃上清,分别加入灭菌水1. 5mL,充分悬浮后,将两种菌悬液分别稀释101、102、103倍,吸取各浓度菌悬液100μL涂布在PDA平板上,每个浓度3次重复,相同操作条件下设无菌水空白对照,将各处理置于25 ℃黑暗培养,3d后观察各浓度条件下菌落形态特征,记录菌落数量,计算孢子负荷量及各分离物的分离频率。
孢子负荷量(个孢子/粒种子)=(孢子总数/被检测的种子总数)
分离频率(%)=(某一分离物出现次数/分离物出现总次数)×100 %
1.2.1.2 胡杨和灰叶胡杨种子内部携带可培养微生物检测:称取胡杨和灰叶胡杨种子各0. 5g,分别置于1 %NaClO溶液中表面消毒5min,无菌水冲洗3次后晾干,有序摆放在PDA平板上,每皿60粒,5次重复,置于25 ℃黑暗培养,3d后观察种子内部携带可培养微生物菌落形态特征,记录种子带菌数量,计算种子带菌率及各分离物的分离频率。
带菌率(%)=(带菌种子数/检测种子总数)×100 %
1.2.1.3 胡杨和灰叶胡杨枝条、芽和叶柄携带可培养微生物检测:用消毒的剪刀将胡杨和灰叶胡杨的芽和叶柄轻轻剥下,并将枝条的上部、中部和下部分别剪切成长约1cm的组织块,分别置于1 %NaClO溶液中表面消毒5min,无菌水冲洗3次后晾干,芽和叶柄有序摆放在PDA平板上(每皿8个),枝条的上部、中部和下部组织块分别平放(每皿8个)和直插(每皿12个)在PDA平板上,各处理3次重复,置于25 ℃黑暗培养,3d后观察枝条上部、中部和下部、芽、叶柄携带可培养微生物菌落形态特征,记录带菌数量,计算带菌率及各分离物的分离频率。
带菌率(%)=(带菌植物组织数/检测植物组织总数)×100 %
1.2.1.4 可培养微生物的纯化:将上述(1)-(3)步骤中分离到的微生物进行编号,挑取菌落边缘,将真菌和细菌分别接种于PDA(马铃薯200g,葡萄糖20g,琼脂粉16g,去离子水1000mL)和LB(胰蛋白胨10g,氯化钠5g,酵母粉5g,琼脂粉16g,去离子水1000mL)平板上,真菌置于25 ℃黑暗培养,细菌28 ℃黑暗培养,保存菌株备用。
1.2.2 可培养微生物的鉴定
形态鉴定方法:借助光学显微镜(LeicaDFC420CCD,控制软件LeicaApplicationSuiteV3.8),分别在培养皿水平和显微结构水平观察各微生物的菌落特征、菌丝及孢子形态结构,拍照记录,并初步确定各菌株的分类地位。
分子鉴定方法:(1)DNA的提取。真菌采用CTAB法。细菌采用煮沸裂解法。(2)PCR扩增。采用真菌通用引物ITS1、ITS4,细菌通用引物27F、1492R进行PCR扩增(引物信息见表1)。其反应体系为(25μL):10×PCRbuffer2. 5μL(含Mg2+),10mmol/LdNTPs2μL,TaqDNApolymerase0. 3μL,10mmol/L引物对2μL,模板DNA1μL,无菌ddH2O17.2μL,总体系25μL。真菌扩增条件:94 ℃变性5min,94 ℃变性30s,54 ℃退火30s,72 ℃延伸1min,共设35个循环,最终72 ℃延伸10min。细菌扩增条件:94 ℃变性5min,94 ℃变性30s,54 ℃退火60s,72 ℃延伸90s,共设35个循环,最终72 ℃延伸7min。(3)测序与比对:将扩增的PCR产物进行测序(送北京博迈德科技发展有限公司完成),将获得的序列在NCBI核酸序列库中已知真菌rDNAITS和细菌16SrDNA序列进行比对,结合形态学观察结果,最终确定各菌株的分类地位。
1.2.3 数据分析
利用SPSS16.0数据分析软件,对获得的有关数据进行单因素方差分析,比较胡杨和灰叶胡杨各器官带菌率的差异显著性。
2 结果与分析
2.1 胡杨和灰叶胡杨各器官寄藏可培养微生物检测
2.1.1 种子外部
如表2所示,胡杨和灰叶胡杨种子外部携带一定数量的真菌和细菌等可培养微生物,但种子带菌率较低,胡杨种子孢子负荷量为0. 0264,显著高于灰叶胡杨种子孢子负荷量(0. 0072)。胡杨和灰叶胡杨种子携带微生物的种类较为一致,均包括真菌Alternaria(链格孢属,菌株HF1)和Aspergillus(曲霉属,菌株HF4)以及细菌Stenotrophomonas(嗜麦芽窄食单胞菌,菌株HB2);而嗜麦芽窄食单胞菌(Stenotrophomonas)菌株HB1仅寄藏于胡杨种子外部。胡杨和灰叶胡杨种子外部携带可培养微生物分离频率最高的是曲霉属,随后依次为链格孢属及嗜麦芽窄食单胞菌属。
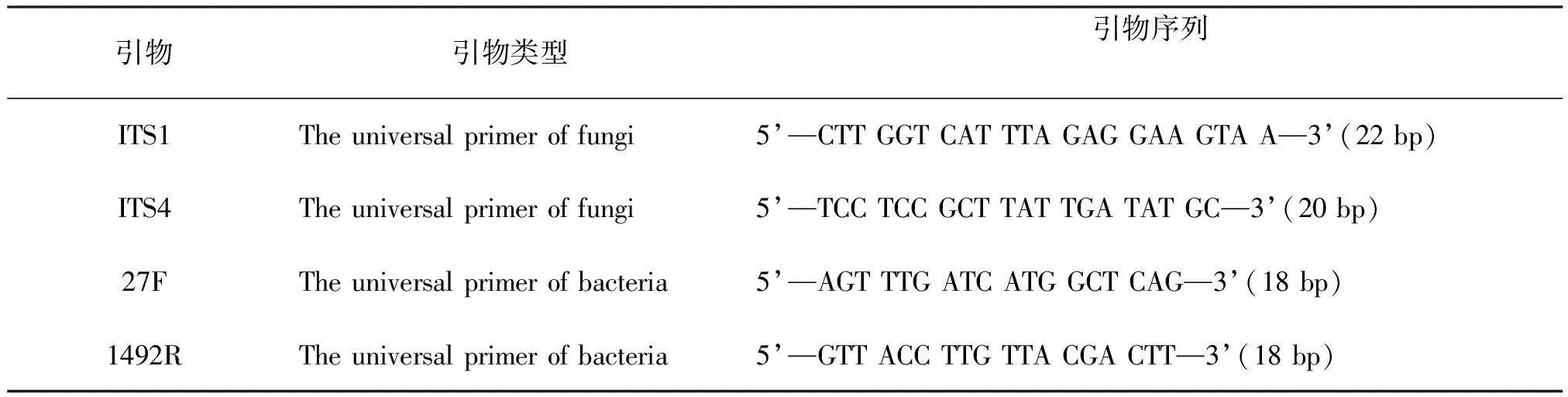
表1 引物及序列
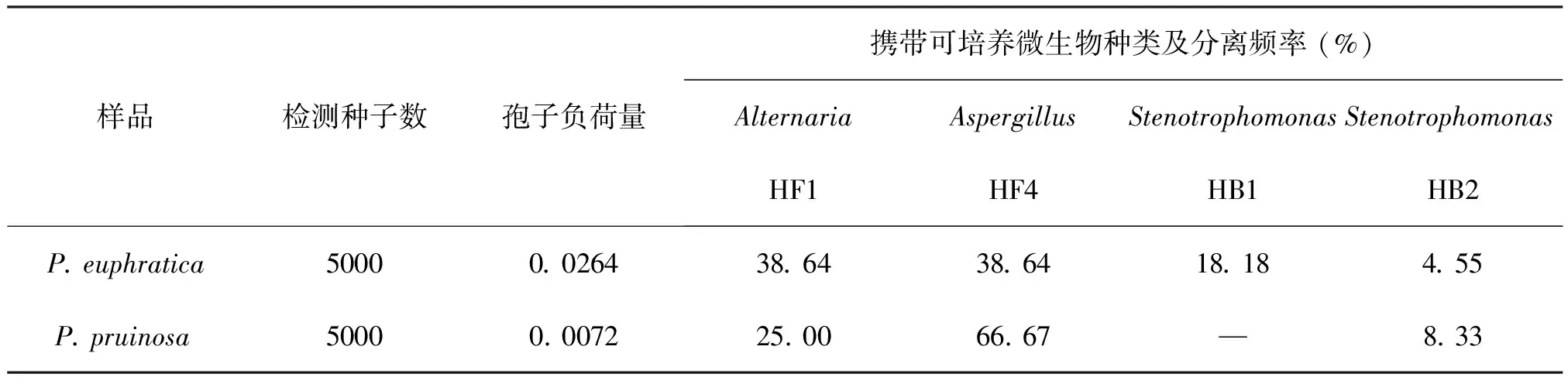
表2 胡杨和灰叶胡杨种子外部携带可培养微生物情况
2.1.2 种子内部
结果表明(表3),胡杨和灰叶胡杨种子内部带菌率较低,胡杨种子带菌率为7.33%,而灰叶胡杨种子为3.00%,二者差异显著。经鉴定,胡杨和灰叶胡杨种子内部携带的可培养微生物主要为真菌,包括Aspergillus(曲霉属,菌株HF5)、Nigrospora(黑孢霉属,菌株HF10)、Epicoccum(附球菌属,菌株HF11)和Alternaria(链格孢属,菌株HF12、HF13)。其中链格孢属分离频率最高。
2.1.3 芽、叶柄、枝条
如表3所示,胡杨和灰叶胡杨的芽带菌率较高,其中胡杨芽带菌率为50. 00 %,灰叶胡杨芽带菌率为75. 00 %,稍高于胡杨。二者携带的微生物类群为Nigrospora(黑孢霉属,菌株HF10)、Alternaria(链格孢属,菌株HF12、HF13),未分离到可培养细菌。其中链格孢属分离频率最高。胡杨叶柄带菌率为20. 83 %,灰叶胡杨芽带菌率为75. 00 %,显著高于胡杨。二者携带的微生物类群为Nigrospora(黑孢霉属,菌株HF10)、Alternaria(链格孢属,菌株HF12、HF13),未分离到可培养细菌。其中链格孢属分离频率最高。平放和直插两种检测方法的试验结果表明,胡杨和灰叶胡杨枝条上部、中部和下部带菌量不一,二者枝条下部带菌率最高,达100 %,中部次之,上部最低。而两个物种枝条中部和上部的带菌率有较为明显的差异,灰叶胡杨显著高于胡杨。二者共同携带的微生物类群为Nigrospora(黑孢霉属,菌株HF10)、Alternaria(链格孢属,菌株HF12、HF13),此外,灰叶胡杨枝条下部还分离到Epicoccum(附球菌属,菌株HF11),未分离到可培养细菌。枝条上部附球菌属分离频率最高,而枝条中部和下部链格孢属分离频率最高。
洋山港四期码头位于小洋山岛链最西端的大、小乌龟岛与颗珠山岛之间的填筑区,与洋山港二期工程相隔颗珠山汊道。洋山港四期工程设计水深为14.5 m,占用岸线2 800 m,码头走向106°~286°,设计年集装箱吞吐量400万TEU。拟建工作船码头和7个5万~7万吨级泊位、并考虑为远期发展适当留有余地,将15万吨级集装箱船作为水工结构兼靠船型。[2]预计开港后挂靠洋山港区四期集装箱泊位的远洋集装箱船型将以5万吨级、7万吨级和10万吨级的船舶为主。洋山港水域平面布置见图1。
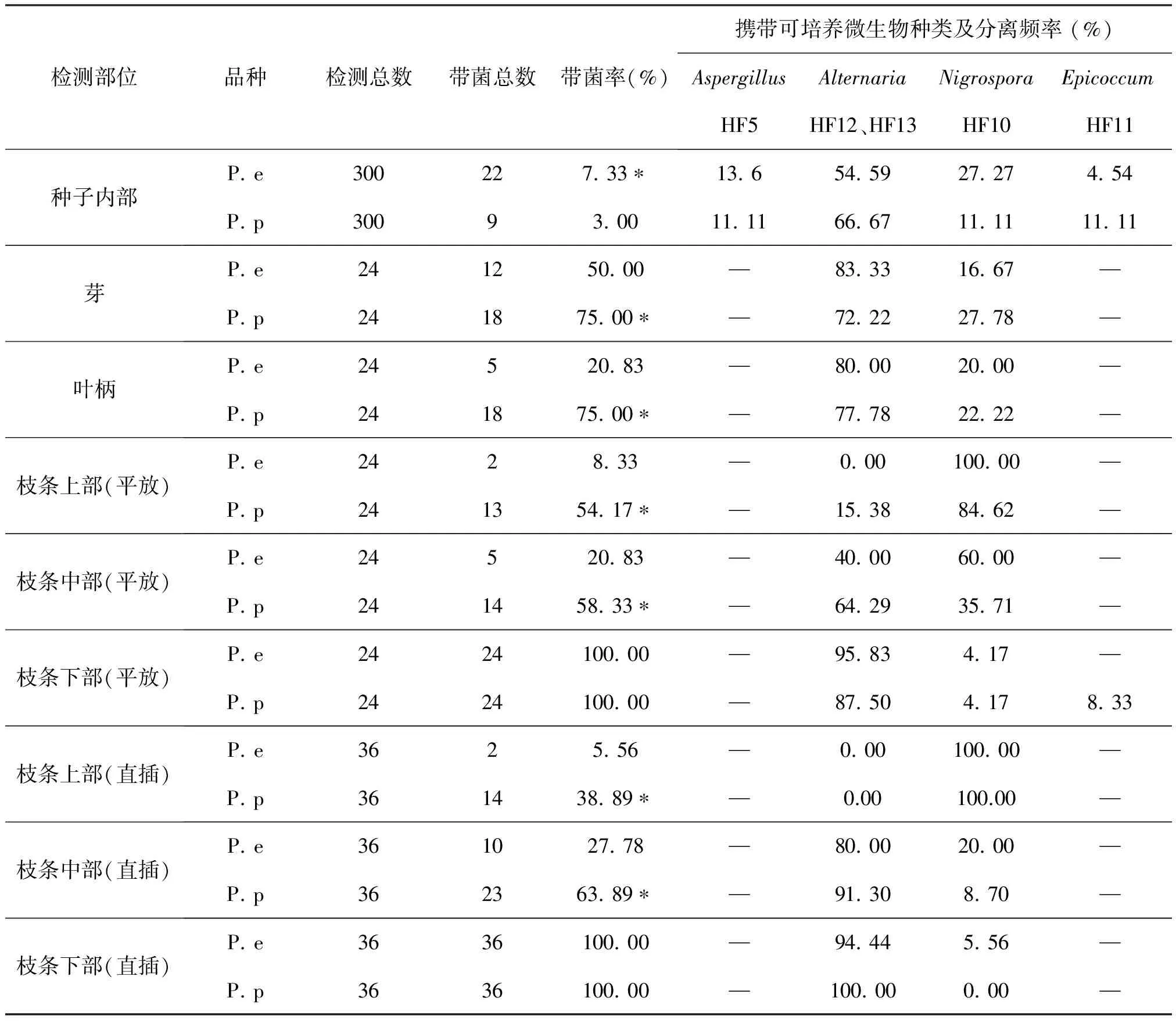
表3 胡杨和灰叶胡杨不同器官携带可培养微生物情况
注:*为单因素方差分析(P<0.05)。
2.2 胡杨和灰叶胡杨不同器官寄藏的可培养微生物鉴定
2.2.1 形态学鉴定结果
将分离自胡杨及灰叶胡杨不同器官寄藏的可培养微生物纯化后编号为:真菌菌株7株:HF1、HF4、HF5、HF10、HF11、HF12、HF13;细菌菌株2株:HB1、HB2。其形态结构特征分别描述如下(图1)。
真菌菌株HF1:Alternaria,链格孢属。分离自胡杨和灰叶胡杨种子外部。菌落正面灰白色,背面灰褐色,边缘较为齐整,近圆形,菌丝生长茂密(见图1-A1)。光学显微镜下可见,菌丝淡色或透明,细长、有分支、具隔膜,分生孢子深褐色,卵形或倒梨形,有隔膜(见图1-A2)。
真菌菌株HF4:Aspergillus,曲霉属。分离自胡杨和灰叶胡杨种子外部。菌落生长迅速,正面灰色,边缘不整齐,背面灰白色,有明显的花瓣形轮纹,卷毛状菌丝生长茂密,易从培养基剥离(见图1-B1)。其分生孢子梗无色、细长、直立、壁光滑,未见隔膜,顶端膨大形成顶囊,圆形,表面着生一层分生孢子(见图1-B2)。分生孢子卵圆形或圆形,壁光滑,淡黄色。该菌菌丝发达,产孢量较小,分生孢子梗及顶囊遇水时会释放出分生孢子。
真菌菌株HF5:Aspergillus,曲霉属。分离自胡杨和灰叶胡杨种子内部。菌落生长迅速,正面黄绿色,背面浅黄绿色,边缘较为整齐,圆形,可观察到大量的粉状分生孢子(见图1-C1)。分生孢子梗无色、细长、直立或弯曲,壁粗糙、有褶皱,分生孢子头辐射状,近球形,顶端着生大量的串珠状排列的分生孢子(见图1-C2)。分生孢子卵圆形或圆形,无色透明,在PDA平板培养过程中易弹射,遇水时大量释放。
真菌菌株HF10:Nigrospora,黑孢霉属。分离自胡杨和灰叶胡杨种子内部、芽、叶柄、枝条。菌落生长快速,灰白色,边缘放射状,气生菌丝发达,细长、无色透明(见图1-D1)。分生孢子黑色、圆形、边缘光滑(见图1-D2)。
真菌菌株HF12:Alternaria,链格孢属。分离自胡杨和灰叶胡杨种子内部、芽、叶柄、枝条。菌落正面灰白色,背面深褐色,边缘较为齐整,近圆形,菌丝生长茂密,无轮纹(见图1-F1)。菌丝淡色或透明,细长、有分支、具隔膜,分生孢子深褐色,长棒形,有隔膜(见图1-F2)。
真菌菌株HF13:Alternaria,链格孢属。分离自胡杨和灰叶胡杨种子内部、芽、叶柄、枝条。菌落正面灰绿色,背面绿褐色,边缘齐整,近圆形,菌丝生长茂密,有轮纹(见图1-G1)。光学显微镜下可见,菌丝单色或透明,细长、有分支、具隔膜,分生孢子深褐色,卵形或倒梨形,有隔膜(见图1-G2)。
细菌菌株HB1:Stenotrophomonas,嗜麦芽窄食单胞菌。分离自胡杨和灰叶胡杨种子外部。菌落圆形,粉色或橙色,边缘整齐,光滑(见图1-H)。
细菌菌株HB2:Stenotrophomonas,嗜麦芽窄食单胞菌。分离自胡杨种子外部。菌落圆形,白色或乳白色,边缘整齐,光滑(见图1-I)。
2.2.2 分子鉴定结果
采用真菌通用引物ITS1、ITS4对待测真菌rDNAITS区域进行扩增,细菌通用引物27F、1492R对待测细菌16SrDNA进行扩增,分别得到了约550bp和1300bp的特异性条带,测序后同NCBI核酸序列库中已知序列进行比对,结果如表4所示。根据扩增条带与已知序列的同源性,结合2.2.1形态学观察结果,确定胡杨和灰叶胡杨各器官寄藏的7株可培养真菌分别为:HF1:Alternaria(链格孢属)、HF4:Aspergillus(曲霉属)、HF5:Aspergillus(曲霉属)、HF10:Nigrospora(黑孢霉属)、HF11:Epicoccum(附球菌属)、HF12:Alternaria(链格孢属)、HF13:Alternaria(链格孢属);2株可培养细菌为:HB1:Stenotrophomonas(嗜麦芽窄食单胞菌属,菌落橙色)、HB2:Stenotrophomonas(嗜麦芽窄食单胞菌属,菌落白色)。
3 结论与讨论
3.1 结论
本文首次对胡杨和灰叶胡杨的种子、芽、叶柄和枝条中寄藏的可培养微生物进行了系统研究。胡杨及灰叶胡杨的种子外部、内部,芽、叶柄及枝条共分离纯化到可培养的7株真菌和2株细菌,种子外部携带的真菌为Alternaria、Aspergillus,细菌为Stenotrophomonas;种子内部、芽、叶柄和枝条上寄藏真菌(内生真菌)为Alternaria、Aspergillus、Nigrospora、Epicoccum。胡杨和灰叶胡杨不同器官携带的可培养微生物量具有差异性,表现为:1)种子内部和外部带菌表现为胡杨显著高于灰叶胡杨;2)灰叶胡杨芽和叶柄携带的微生物量高于胡杨,叶柄带菌量差异显著;3)胡杨和灰叶胡杨枝条带菌量均表现为:上部<中部<下部,两个物种枝条下部带菌率均达100 %;就两个物种间带菌量比较而言,灰叶胡杨枝条上部和中部带菌量显著高于胡杨。
国内外对胡杨和灰叶胡杨内生菌有记载报道[21-22]。本文研究结论与报道的杨树上分离到Alternaria(链格孢属)、Nigrospora(黑孢霉属)和Epicoccum(附球菌属)等6种植物内生真菌[23]相吻合,也包含了袁秀英等报2004年道了胡杨树皮中内生真菌曲霉(Aspergillussp.)和链格孢(Alternariasp.)属真菌。胡杨和灰叶胡杨同为杨属植物,本研究证实胡杨和灰叶胡杨是内生真菌Nigrospora(黑孢霉属)和Epicoccum(附球菌属)和Stenotrophomonas内生细菌的新寄主。
由于99 %的微生物都是非可培养的[24],因此本研究利用平皿培养法检测胡杨和灰叶胡杨各器官携带的微生物具有一定局限性,深入的研究需要用基因组学或蛋白组学等方法进一步探明胡杨和灰叶胡杨不同器官寄藏的微生物种类,以全面科学解析这些微生物的风险性和开发利用的价值。
3.2 胡杨及灰叶胡杨不同器官携带的可培养微生物的安全性
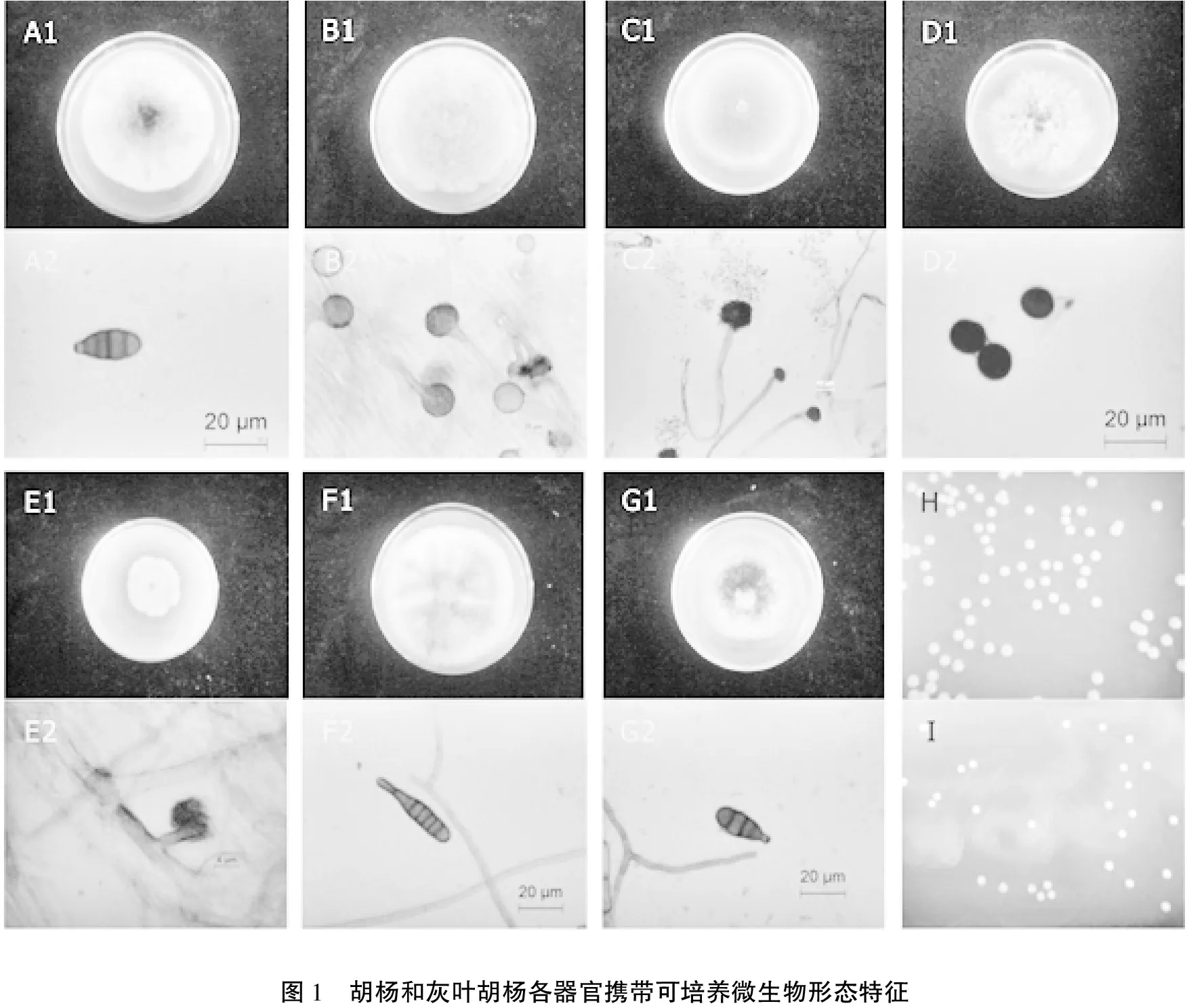
图1 胡杨和灰叶胡杨各器官携带可培养微生物形态特征
A1:真菌菌株HF1菌落特征;A2:真菌菌株HF1分生孢子形态特征(×20);B1:真菌菌株HF4菌落特征;B2:真菌菌株HF4分生孢子梗顶囊及分生孢子形态特征(×20);C1:真菌菌株HF5菌落特征;C2:真菌菌株HF5分生孢子梗顶囊及分生孢子形态特征(×10);D1:真菌菌株HF10菌落特征;D2:真菌菌株HF10分生孢子形态特征(×20);E1:真菌菌株HF11菌落特征;E2:真菌菌株HF11分生孢子形态特征(×100);F1:真菌菌株HF12菌落特征;F2:真菌菌株HF12分生孢子形态特征(×20);G1:真菌菌株HF13菌落特征;G2:真菌菌株HF13分生孢子形态特征(×20);

表4 胡杨和灰叶胡杨各器官携带可培养微生物的鉴定
本文分离得到的真菌Alternaria(链格孢属)、Aspergillus(曲霉属)、Nigrospora(黑孢霉属)和细菌细菌Stenotrophomonas,在其它作物生产系统中具有致病致害性或者潜在危害性。Alternaria,链格孢属,可以引起番茄、马铃薯早疫病,瓜类叶斑病,十字花科蔬菜黑斑病等病害[5];Aspergillus,曲霉属,大多数腐生于土壤及动植物残体,少数引起洋葱等鳞茎部位的腐烂病;Nigrospora,黑孢霉属,引起水稻、玉米和高粱等的黑霉病[5]。Stenotrophomonas,嗜麦芽窄食单胞菌属,广泛存在于水,土壤,动物体内,为条件致病菌,能够感染人类上呼吸道[5]。在一定的环境条件下,胡杨和灰叶胡杨种子表面和内部、不同器官均携带这些微生物可能会干扰种子正常的萌发生长,造成烂种、病苗、死苗或者生长中期的多种病害,胡杨和灰叶胡杨不同器官寄藏的可培养微生物对种子发芽和树苗生长发育的影响以及潜在的致病性等,值得深入研究。因此需要筛选合适的药剂对种子进行消毒处理,以提高其发芽率,为胡杨及灰叶胡杨育苗造林提供指导,相关工作正在进行中。
3.3 胡杨及灰叶胡杨各器官携带的可培养微生物的开发与利用
本研究中从胡杨和灰叶胡杨各器官分离到的内生真菌中有附球菌属真菌(Epicoccum),该菌多数无致病性[5,25],已有用于植物病害生物防治的先例[11]。附球菌能够在衰老的或刚死亡的植物组织表面迅速产生分生孢子,并能产生抗真菌的化合物,是一种防治农作物病害较为理想的生防菌[25]。因此,以来自胡杨和灰叶胡杨不同器官的附球菌属植物内生真菌为材料,尝试开展其对胡杨和灰叶胡杨种子萌发和苗期生长的影响,以及对胡杨锈病等病害的生物防治效果等相关研究具有积极的意义。
[1] 李志军,刘建平,于军,等.胡杨、灰叶胡杨生物生态学特性调查[J].西北植物学报,2003,23(7):1292-1296.
[2] 牛攀新,楚光明,宋于洋,等.濒危植物灰叶胡杨研究进展[J].湖南农业科学,2010,9:126-129.
[3] 刘亚萍,计巧灵,周小云.胡杨种子萌发过程中几种相关酶的活性变化[J].种子,2005,41(5):607-609.
[4] 田乃祥,马占鸿.胡杨锈病病原与防治对策[J].植物保护,1990,(3):17-18.
[5] 陆家云.植物病原真菌学[M].北京:中国农业出版社,2001:1-542.
[6] 王根绪,程国栋,徐中民. 中国西北干旱区水资源利用及其生态环境问题[J].自然资源学报,1999, 14(2):109-116.
[7] 高润宏,张巍,郭晓红.额济纳胡杨林生态效益评价及保护对策探讨[J].干旱区资源与环境,2000, 14(5):74-77.
[8] 史应武,娄恺,李春.植物内生菌在生物防治中的应用[J].微生物学杂志,2009,29(6):61-64.
[9] 石晶盈,陈维信,刘爱媛.植物内生菌及其防治植物病害的研究进展[J].生态学报,2006,26(7):2395-2401.
[10]MaurhferM,KeelC.InfluenceofplantspeciesondiseasesuppressionbyPseudomonasfluorescensstrainCHAOwithenhancedantibioticproduction[J].PlantPathology, 1998, 45: 126-129.
[11]MadrigalC,PascualS,MelgarejoP.Biologicalcontrolofpeachtwigblight(Monilinialaxa)withEpicoccumnigrum[J].PlantPathology,1994,43:554-561.
[12]StrobelGA,DirkseE,SearsJ,etal.VolatileantimicrobialsfromMuscodoralbus,anovelendophyticfungus[J].Microbiology,2001,147(11):2943-2950.
[13]GrimmeE,ZidackNK,SikoraRA,etal.ComparisonofMuscodoralbusvolatileswithabiorationalmixtureforcontrolofseedlingdiseasesofsugarbeetandroot-knotnematodeontomato[J].PlantDisease,2007,91(2):220-225.
[14]LaceyLA,NevenLG.Thepotentialofthefungus,Muscodoralbus,asamicrobialcontrolagentofpotatotubermoth(Lepidoptera:Gelechiidae)instoredpotatoes[J].JournalofInvertebratePathology,2006,91(3):195-198.
[15] 袁秀英,韩艳洁,姜海燕,等.胡杨内生真菌曲霉(Aspergillussp.)链格孢(Alternariasp.)的生理特性[J].干旱区资源与环境,2009,18(6):170-173.
[16] 卡依尔·玉素甫,谢仁娜依·甫拉提,马丽帕·吐达洪,等.Ugan古河道胡杨可培养内生细菌的多样性[J].微生物学报,2011,51(2):178-188.
[17] 祖母拉提·阿布都热依木,程刚,布阿依夏木·阿木提,等.一株分离自胡杨树杆液的内生酵母菌初步鉴定[J].新疆农业科学,2012,49(8):1483-1488.
[18] 袁秀英,石林,胡达古拉,等. 胡杨根际真菌与内生真菌多样性研究[J].西北林学院学报,2007, 22(6):85-88.
[19] 乔海莉,田呈明,骆有庆,等.新疆天然胡杨林土壤微生物多样性的研究[J].北京林业大学学报,2007, 29(5): 127-131.
[20] 刘慧,姜海燕,袁秀英,等.胡杨林土壤微生物[J].东北林业大学学报,2009,37(11): 80-81.
[21] 戴芳澜.中国真菌总汇[M].北京:科学出版社,1979:1-1527.
[22] 魏景超.真菌鉴定手册[M].上海:科学技术出版社,1979:1-779.
[23] 赵桂华,石立岩,杨怀光,等.杨树内生真菌的分离和鉴定[J].南京林业大学学报:自然科学版,2008, 32(2):76-78.
[24] 胡桂萍,郑雪芳,尤民生,等.植物内生菌的研究进展[J].福建农业学报,2010,25(2):226-234.
[15] 李扬,王亚南,胡同乐,等.黑附球菌在植物病害生物防治中的研究与应用进展[J].安徽农业科学,2010,38(6):2988-2990.
Study on the Culturable Microbes from Different Organs ofPopuluseuphraticaandP.pruinosa
Li Qian1, 2Gu Sichen1,2Wang Yuli3Li Zhijun3Li Jianqiang1, 2*
(1 Department of Plant Pathology, China Agricultural University / Key Laboratory of Plant Pathology, Ministry of Agriculture P. R. China, Beijing 100193)
(2 Beijing Engineering Research Center of Seed and Plant Health (BERC-SPH) / Beijing Key Laboratory of Seed Disease Testing and Control (BKL-SDTC), Beijing 100193)
(3 College of Plant Science, Tarim University / Xinjiang Production &Construction Corps Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Alar, Xinjiang 843300)
The culturable microbes from different organs ofPopuluseuphraticaandP.pruinosawerestudiedbyusingwashingandplatingtests.TheresultsshowedthatthequantityofmicrobesassociatedwithseedsofP.euphraticawassignificantlyhigherthanthatofP.pruinosa.ComparedwithP.pruinosa,theratesoffungiassociatedwiththeorganismsofbuds,petioles,andbranchesofP.euphraticawerelower,andsignificanthigherinthatofpetioles,upperandcentralbranches.Forthebothkindsoftreespecies,theratesoffungiassociatedwithlowerbrancheswereupto100 %,followedbythatofcentralandupperbranches.Sevenfungalstrainsandtwobacterialstrainswereisolatedfromseeds,buds,petiolesandbranchesofbothP.euphraticaandP.pruinos.Basedonthemethodsofmorphologyandmolecularbiology,Alternariaspp. (3strains),Aspergillusspp. (2strains),Nigrosporasp.,Epicoccumsp.andStenotrophomonasspp. (2strains)weredetermined.ItwasfirstreportedthatNigrosporaandEpicoccumwereendophyticfungi,Alternaria,AspergillusandStenotrophomonaswereseedassociatedfungiandbacteriaofP.euphraticaandP.pruinosa.
Populuseuphratica,P.pruinosa,seed,organ,culturablemicrobes
2014-10-16
新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室开放基金重点项目(BRZD1001)
李倩(1984-),女,博士研究生,主要研究方向为种子病理学。 E-mail:liq@cau.edu.cn
*为通讯作者 E-mail:lijq231@cau.edu.cn
1009-0568(2015)01-0009-09
S
ADOI:10.3969/j.issn.1009-0568.2015.01.002
