2种棘豆种子硬实破除方法研究
2015-04-25杨丽聪黄文娟李志军
杨丽聪 黄文娟 李志军*
(1 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)(2 塔里木大学植物科学学院,新疆 阿拉尔 843300)
2种棘豆种子硬实破除方法研究
杨丽聪1, 2黄文娟1, 2李志军1, 2*
(1 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)(2 塔里木大学植物科学学院,新疆 阿拉尔 843300)
研究了砂磨赤霉素浸种、浓硫酸酸蚀和热水浸种3种硬实破除方法对悬岩棘豆和米尔克棘豆种子萌发率、萌发进程及平均萌发时间的影响。结果表明:砂磨赤霉素(200 mg/L)浸种和浓硫酸酸蚀2种方法均可以显著提高(p<0. 05) 2种棘豆的萌发率,加快种子萌发进程,缩短平均萌发时间。与对照组相比,悬岩棘豆和米尔克棘豆的萌发率分别从27. 0%和4. 0%提高至97. 0%和86. 0%;平均萌发时间分别由8. 9d和8. 1d缩短至1. 6d和2. 1d。时间长短的控制是处理时的关键问题,2种棘豆砂磨赤霉素处理均以24h为最佳,浓硫酸处理分别以5min和10min为最佳。热水浸种虽在一定程度上提高了2种棘豆的萌发率,但对萌发进程和平均萌发时间几无影响。悬岩棘豆在砂磨后用200mg/L的赤霉素处理24h时萌发最好,而米尔克豆种子在浓硫酸处理种子10min时萌发最好。
棘豆;种子萌发;种子休眠
种子萌发是植物生活史中最脆弱而又极其重要的环节之一,它关系到幼苗的建成、个体的存活和竞争,并且影响植被分布和生物多样性水平[1]。种子的萌发和休眠特征影响着幼苗存活能力[2]、个体适合度[3]及植物生活史的表达[4]。种子的发芽率和发芽速率影响着种群在自然群落中的动态,种间的萌发差异则影响着物种在植被中的作用及分布,并且影响着群落结构[5]。在植物的生活周期中,植物死亡至少有95%发生在种子阶段[6]。因此植物在种子萌发阶段的形态学、生理学及分子生物学等规律研究,早已成为学者们研究和探讨的热门领域。
豆科植物种子多为硬实种子,具有物理休眠的特点。其主要原因是由于种子具有致密的种皮或果皮,阻碍了水分吸收从而抑制种子萌发[7]。关于豆科种子物理性休眠破除方法的报道很多,其主要原理就是利用物理或化学的手段增强种皮透性,促使种子吸水,从而打破休眠[8],具体方法有机械法擦破种皮、热水浸种、强酸酸蚀或野外层积等[9-12]。机械方法是破除物理性休眠最有效的方法;对种子进行高温/低温处理或二者相结合的方法改变种皮透性亦可有效破除休眠[13];用硫酸或硝酸等可以腐蚀局部种皮,打破栅栏组织的屏障,使种壳变薄并消除珠孔等部位的堵塞物,增大种皮的透性[14]。此外,碱液、盐溶液、有机溶剂以及一些生物酶、激素类物质亦经常用于豆科植物种子休眠的破除[15]。
悬岩棘豆(Oxytropis rupifraga Bunge.)和米尔克棘豆(Oxytropis merkensis Bunge.)均为豆科棘豆属(Oxytropis DC.)多年生草本植物[16-17],花期6~7月,果期7~8月。二者具有较为相似的生物学特性,在海拔4000 m以上的塔什库尔干高山草甸均有分布,就其分布区环境特点分析具有一定的耐寒性和耐旱性,二者种皮较厚[18],属硬实种子,同样具有明显的物理休眠现象,未经处理的种子在人工气候箱内萌发率极低,甚至不萌发。针对这2种棘豆存在物理休眠的现象,拟采用沙磨赤霉素浸种[19-20]、浓硫酸酸蚀和热水浸种[21]3种方法开展打破2个物种种子休眠的方法研究,旨在探讨提高棘豆种子萌发率的方法,为进一步研究这2个物种萌发特性和种子萌发期的抗逆性奠定基础。
1 材料与方法
1.1 材料
供试的2种棘豆种子均于2012年7月种子自然成熟期采于塔什库尔干县(N75°27′05. 3″E37°12′06. 6″,海拔3 451),该县地处高寒山区,属暖温带大陆型干旱性气候。年均温3. 3 ℃,极端最高气温32. 5 ℃,最低气温-39. 1℃;多年平均降雨量68. 9 mm。高原气候寒冷,冬季漫长,无夏季。空气稀薄,紫外辐射强烈。将采集的种子除杂后自然阴干,并于4 ℃种子保存箱中保存备用。
1.2 方法
1.2.1 砂磨赤霉素浸种处理 挑选籽实饱满的种子放入研钵,加少许石英砂研磨以擦破种皮(研磨时避免研坏种子),至种子表面粗糙无光泽,用放大镜观察种子表面有明显的划痕为止。将已消毒的种子浸泡于200 mg/L的赤霉素中,分别浸泡4、8、12、24、36 h。每个处理25粒种子,4次重复。浸泡处理后的种子用蒸馏水冲洗5次,均匀放置于铺有双层湿滤纸的培养皿中,在30℃恒温培养箱内进行发芽培养。每天定时补充水分,并统计种子萌发情况(种子萌发以胚根露出种皮,肉眼可见为标准)。以连续3天不发芽的萌发种子数计算发芽率。
1.2.2 浓硫酸处理 将已消毒的种子分别用98%浓硫酸浸泡5、10、15、20、30 min,后用蒸馏水冲洗5次。培养方法同上。
1.2.3 热水浸种处理 将已消毒的种子分别浸泡于80 ℃的灭菌水中,分别浸泡5、10、20、30 min。培养方法同上。
1.3 数据分析
萌发率(GF)的计算公式为:GF(%)=一定时间内总萌发种子数/供试种子总数。平均萌发时间(MGT)计算公式为:MGT=Σ(Dn)/Σn。其中,n是在时间D的种子萌发数,D是从萌发开始的天数。萌发率数据采用DPS软件统计分析,在95%的置信度水平上,通过单因素方差分析检验差异显著性。
2 结果与分析
2.1 不同处理方法对2种棘豆种子萌发率的影响
从图1-A和图1-B可以看出,悬岩棘豆和米尔克棘豆的种子经砂磨赤霉素(200 mg/L)处理后,种子的萌发率均得到显著提高(p<0. 05),前者从对照组的27. 0%提高至77. 0%~97. 0%,后者从对照组的14. 0%提高至80. 0%~83. 3%。在4~36 h的处理时间范围内,米尔克棘豆种子随处理时间的延长,种子的萌发率无显著差异(p>0. 05),而悬岩棘豆在浸种时间延长至36 h时,种子萌发率较其他处理出现了显著降低(p<0. 05),说明砂磨赤霉素浸种处理虽能显著提高悬岩棘豆种子的萌发率,但并非处理时间越长越好,时间过长反而会降低种子萌发率。
图1-C和1-D显示,用浓硫酸处理悬岩棘豆、米尔克棘豆种子,其萌发率较对照均有明显变化,且随浓硫酸处理时间的延长种子萌发率呈现逐渐下降的趋势。悬岩棘豆处理5 min时萌发率最高,达89. 0%,米尔克棘豆以浸泡10 min时萌发率最高,达86. 0%。在处理5 min~15 min时悬岩棘豆的萌发率几乎无差异(p>0. 05),但米尔克棘豆浸泡时间增至15 min时,萌发率显著下降(p<0. 05),为46. 0%。当处理时间达到30 min时,2种棘豆种子萌发率都极低,仅为4. 0%和3. 3%。说明浓硫酸处理能够有效打破2种悬岩棘豆的种子休眠,但处理时间不宜过长,分别以5 min和10 min为最佳。
由图1-E和1-F可知,用80 ℃热水浸泡处理2种棘豆种子,其萌发率均较对照组有所提高,但仅悬岩棘豆种子的萌发率提高显著(p<0. 05),浸泡5 min时,种子萌发率可提高至42. 0%。随着热水浸泡时间的延长,2种棘豆种子的萌发率均有所下降,但不同浸泡时间的萌发率之间并无显著差异(p>0. 05)。
由图1-A、1-C、1-E比较来看,3种处理均使悬岩棘豆种子萌发率较对照组显著提高,但以经砂磨赤霉素(200 mg/L)处理为最佳,最高可使种子萌发率提高至97. 0%,浓硫酸酸蚀次之,可使萌发率提高至89. 0%,热水处理效果不甚理想,萌发率仅提高至42. 0%。图1-B、1-D、1-F比较分析,砂磨赤霉素或浓硫酸处理后,米尔克棘豆种子萌发率均较对照组有显著提高,最终萌发率分别提高至83. 3%和86. 0%,热水处理对其最终萌发率几无影响。
2.2 不同处理方法对2种棘豆种子萌发进程的影响
图2-A表明,砂磨赤霉素浸种处理后,悬岩棘豆种子萌发进程与对照相比表现出明显不同:(1)处理后种子的初始萌发时间有所提前,各种处理均是从培养的第1 d起即有大量种子萌发,比对照种子的初始萌发时间提前了1 d;(2)处理后种子初始萌发率(第1 d的统计值)很高,且随赤霉素浸种时间的延长,接初始萌发率呈逐渐升高后又下降的趋势,初始萌发率从浸种4 h的9. 0%逐渐上升至浸种24 h的86. 0%后,又下降至浸种36 h的25. 0%;(3)处理后种子萌发时间有所缩短,种子萌发进程加快,种子萌发所需要时间从5 d至16 d不等,且均短于对照种子萌发所需的18 d。砂磨赤霉素浸泡处理后米尔克棘豆种子萌发情况(图2-B)与悬岩棘豆相似,亦表现出初始萌发率提高,发芽所需要时间缩短,萌发进程加快等特点,但各处理间差异不大。
从图2-C可以看出,用浓硫酸对悬岩棘豆处理5~15 min时,与对照相比,其种子萌发比较集中,初始萌发率较高,完成萌发所需时间短,仅6 d即可完成整个萌发进程;处理20 min以上时,种子萌发进程变慢,完成萌发所需要时间有所延长,最终萌发率亦显著降低,处理30 min时几无种子萌发。浓硫酸处理米尔克棘豆种子后,种子的萌发进程与对照亦出现明显差异(图2-D),主要表现为种子萌发更为集中,完成萌发所需时间缩短,最多只需要7 d即完成整个萌发进程。同时,不同浓硫酸处理时间相比,米尔克棘豆种子萌发进程亦有较大差异,以处理10min条件下,种子萌发进程最快,累积萌发率最高;处理30 min时,虽累积萌发率极大下降,但完成萌发所需要时间很短,仅需3 d。
从图2-E和图2-F可以看出,热水浸种处理后,2种棘豆种子的萌发进程与对照组相比,略有不同,但初始萌发时间、初始萌发率和萌发进程与对照差异不大。总体来说,各处理均表现为萌发较缓慢,萌发进程和萌发所需要时间较长等特点。
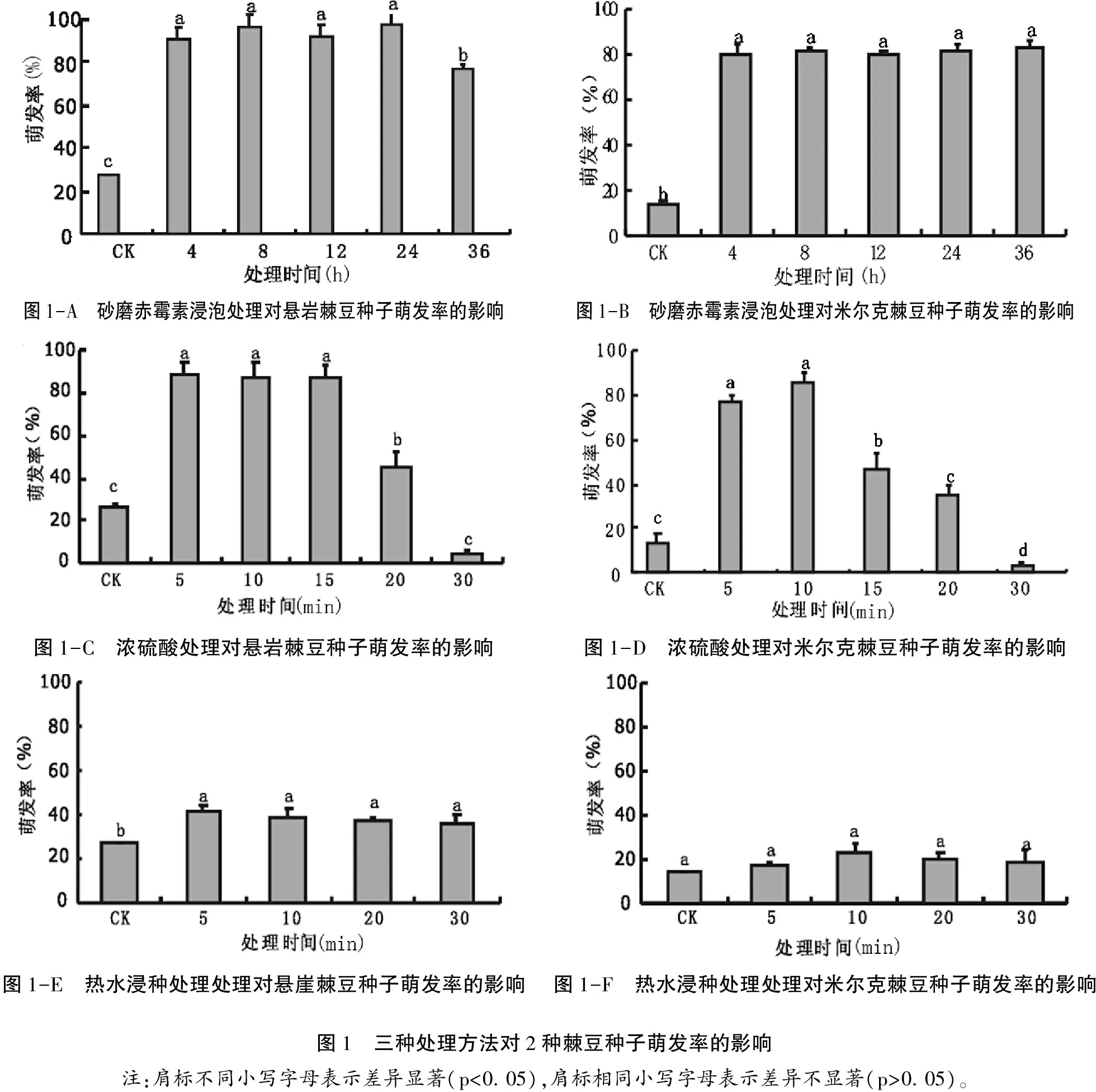
图1-A 砂磨赤霉素浸泡处理对悬岩棘豆种子萌发率的影响 图1-B 砂磨赤霉素浸泡处理对米尔克棘豆种子萌发率的影响
由图2-A、2-C、2-E和2-B、2-D、2-F纵向比较来看,在合理控制处理时间的前提下,砂磨赤霉素和浓硫酸处理均可使2种棘豆种子萌发进程显著增快,而热水处理对其萌发进程影响不大。
2.3 不同处理方法对2种棘豆种子平均萌发时间的影响
从图3-A和图3-B可以看出,2种棘豆种子经砂磨赤霉素处理后,种子的平均萌发时间均显著缩短(p<0. 05),前者从对照组的8. 9 d缩短至1. 6 d ~ 4. 9 d不等,后者从对照组的8. 1 d缩短至2. 1 d ~ 3. 6 d不等;同时,4 ~ 36 h不同浸种时间处理,米尔克棘豆的平均萌发时间无显著差异,而悬岩棘豆浸种时间延长至36 h时,种子平均萌发时间较其他处理出现了显著延长(p<0. 05),说明砂磨赤霉素浸种处理能显著缩短悬岩棘豆种子平均萌发时间,但并非浸种时间越长越好,时间过长反而会延长种子的平均萌发时间。
从图3-C和3-F来看,浓硫酸处理后,2种棘豆种子的平均萌发时间均较对照显著缩短,在处理5~30 min时,米尔克棘豆种子所需平均萌发时间无显著差异;而悬岩棘豆以处理30 min时平均萌发时间最短,但此时萌发率极低,说明浓硫酸处理能够有效缩短平均萌发时间,但处理时间不宜过长,以5 min ~10 min为最佳,且不可超过15 min。
由图3-E可知,用80 ℃热水浸泡处理悬岩棘豆种子,其种子平均萌发时间与对照相比呈先延长后有缩短趋势,因为浸泡5 min时,种子萌发率最高,为42. 0%,而浸泡30 min时,萌发率下降至36. 0%,出现了处理5 min时种子平均萌发时间最长为11. 5 d,10 min~30 min之间种子平均萌发时间无差异(p>0. 05),表明热水浸种的方法对种子的平均萌发时间影响不大。由图3-F可知,用80℃热水浸泡处理米尔克棘豆种子,其平均种子萌发时间与对照相比无差异,以处理5 min时平均萌发时间最短为为9. 3 d,处理20 min时平均萌发时间最长为7. 7 d,但不同处理均与对照组8. 1 d无差异(p>0. 05),表明热水浸种处理并不能显著缩短米尔克棘豆种子的平均萌发时间。
由图3-A、3-C、3-E来看,砂磨赤霉素和浓硫酸处理均能显著缩短悬岩棘豆种子平均萌发时间,且以砂磨赤霉素处理悬岩棘豆种子24 h种子平均萌发时间最短,浓硫酸处理次之,热水浸种处理对悬岩棘豆种子平均萌发时间的影响不显著。由图3-B、3-D、3-F来看,砂磨赤霉素和浓硫酸处理亦均能显著缩短米尔克棘豆种子平均萌发时间,热水处理对平均萌发时间无显著影响。
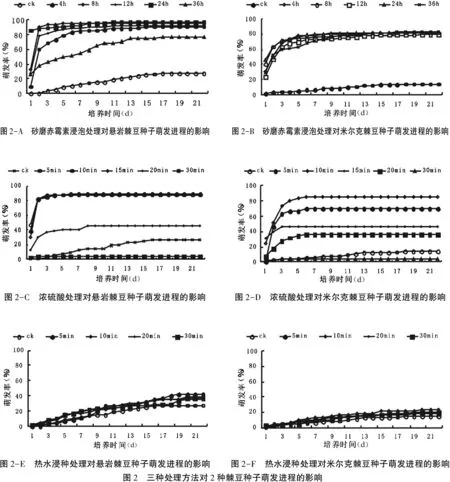
图2-A 砂磨赤霉素浸泡处理对悬岩棘豆种子萌发进程的影响 图2-B 砂磨赤霉素浸泡处理对米尔克棘豆种子萌发进程的影响
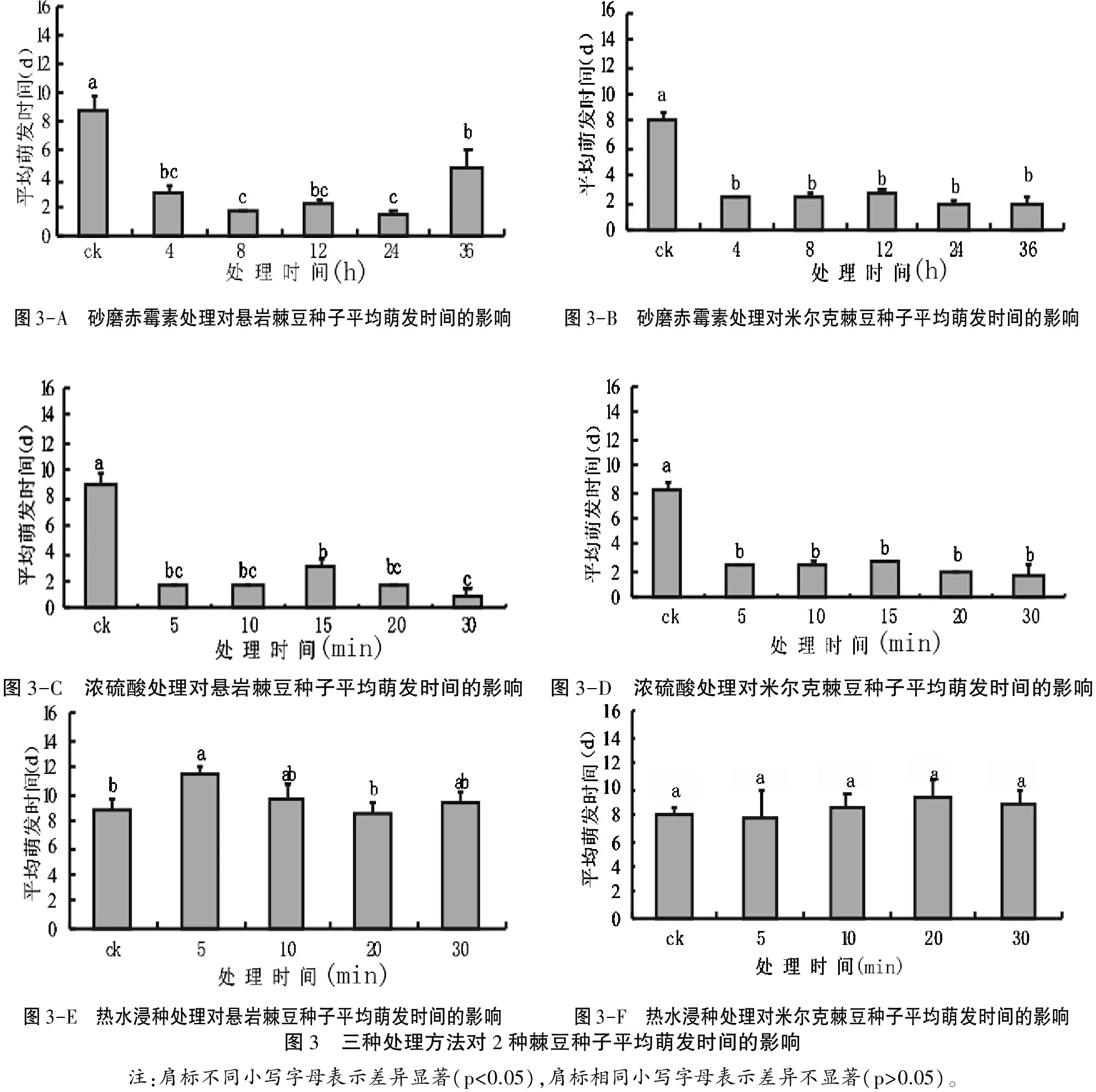
图3-A 砂磨赤霉素处理对悬岩棘豆种子平均萌发时间的影响 图3-B 砂磨赤霉素处理对米尔克棘豆种子平均萌发时间的影响
3 结论与讨论
3.1 砂磨赤霉素处理对2种棘豆种子萌发的影响
机械损伤种皮是处理硬实种子有效的方法之一[22-23],砂纸磨擦盐肤木种皮破除硬实效果显著[24], 某些植物激素,如赤霉素、乙烯利、细胞分裂素、短壮素、萘乙酸、多效唑、吲哚乙酸、吲哚丁酸等,均能破除种子硬实。有研究报道,用 10 mg/L 的赤霉素处理紫花苜蓿,有破除硬实、促进萌发的作用,对胚根、胚芽的伸长有一定的刺激作用,且能够提高种子发芽的整齐度[25]。本研究用砂磨结合赤霉素浸种处理后可以显著提高2种棘豆种子的萌发率,加快萌发进程,并缩短种子完成萌发所需要时间,是较为理想的破除种子休眠的方法。这与前人研究相一致,但赤霉素浓度和浸泡时间因植物物种而异。砂磨后用200 mg/L的赤霉素处理时,悬岩棘豆以不超过24 h为宜(此时种子萌发率可达97%,萌发进程快,完成萌发所需平均时间仅为1. 6 d),时间过长会反而会抑制种子萌发。高浓度赤霉素处理可以使麻山药淀粉酶活性在短时间内大幅度的提升,随后又有大幅度的下降,主要的原因淀粉降解较快,造成产物的积累,抑制了酶的活性,从而导致休眠期的延长[26],高浓度赤霉素也对2种棘都种子萌发有影响。米尔克棘豆种子在砂磨赤霉素浸种4~36 h 内萌发率和萌发进程几无差异,平均萌发时间在36 h时略有延长,因此亦以处理不超过24 h为最佳。
3.2 浓硫酸处理对2种棘豆种子萌发的影响
处理硬实种子是最常用的化学方法就是用浓硫酸浸种以腐蚀局部种皮,使种壳变薄并消除珠孔等部位的堵塞物,增大种皮的透性[27]。虽然硫酸处理硬实效果显著,但操作时需谨慎。其处理时间较难控制,尤其对于种皮较薄的种子,更难以掌握准确时间;处理后要充分洗净,否则易造成酸害[23-24]。按不同种类植物种子可处理15~30 min[23]。刘红等对美丽胡枝子的研究表明,浓硫酸20 min效果最佳[28],王琼等对盐肤木种子研究发现,浓硫酸处理30 min为最佳时间[24]。本实验结果显示:浓硫酸酸蚀均可以显著提高2种棘豆种子的萌发率,加快萌发进程,并缩短种子完成萌发所需要时间,亦为理想的破除种子休眠的方法,悬岩棘豆种子以处理时间不超过15 min为宜,且以5 min为最佳,此时种子具有最高的萌发率,需要最短的平均萌发时间。米尔克豆最高萌发率出现在浓硫酸处理种子10 min时,此时萌发率最高,种子初始萌发时间早,平均萌发时间最短。由此可见浓硫酸处理能大大提高硬实种子萌发率,但需要特别注意处理时间,时间过短,对种皮腐蚀不够;时间过长,则会造成种子的损伤。
3.3 热水浸种对2种棘豆种子萌发的影响
高温浸种可以软化种皮,去掉种皮表层的蜡质和油脂,提高透性和浸出种子内发芽抑制物,但不同种子破除硬实的适宜温度不一,浸种时间应视种子大小、种皮厚薄及水温而定[23]。长萼鸡眼草种子进行50 ℃保温15 min或60 ℃保温10 min为最佳处理方式,可大大提高其萌发率[29];美丽胡枝子种子则在100 ℃种子萌发最佳[28]。本研究用80 ℃热水浸种对2种棘豆种子进行处理后,虽在一定程度上提高了2种棘豆种子的萌发率,但提高幅度不大,且萌发进程与对照几无差异,平均萌发时间反而有所延长,出现这种现象的原因可能是热水温度选择不适而造成的,亦可能热水浸种本身对这2种棘豆而言不是理想的破除休眠方法,具体还有待进一步研究。
综上所述,本研究摸索出2种破除悬岩棘豆和米尔克棘豆种子硬实的有效方法,即砂磨赤霉素浸种和浓硫酸酸蚀。对悬岩棘豆而言,砂磨后以200 mg/L的赤霉素处理4~24 h为宜,最佳处理时间为24 h;浓硫酸处理以5 min为最佳,切不可超过15 min,否则萌发率将大大降低。米尔克棘豆用砂磨赤霉素(200 mg/L)处理时间限制在36 h时内均可,但以24 h为最佳;浓硫酸处理以10 min为最佳。热水浸种处理该2种棘豆种子并未得到良好的效果,有待进一步研究。
[1] 古丽娜尔·阿不来提. 大赖草结实格局及种子萌发特性研究[D]. 新疆农业大学, 2013.
[2] Gross K L, Smith A D. Seed mass and emergence time effects on performance of Panicum dichotomiflorum Michx. across environments[J]. Oecologia, 1991, 87(2): 270-278.
[3] Donohue K, Dorn L, Griffith C, et al. The evolutionary ecology of seed germination of Arabidopsis thaliana: variable natural selection on germination timing[J]. Evolution, 2005, 59(4): 758-770.
[4] Venable D L. The evolutionary ecology of seed heteromorphism[J]. American Naturalist, 1985: 577-595.
[5] Araki S, Washitani I. Seed dormancy/germination traits of seven Persicaria species and their implication in soil seed‐bank strategy[J]. Ecological Research, 2000, 15(1): 33-46.
[6] 班勇.植物生活史对策的进化[J].生态学杂志,1995(03):33-39.
[7] 王娜. 紫堇种子生物学特性及萌发条件研究[D]. 南京林业大学, 2013.
[8] 宋彬, 苗昊翠, 胡珍珠, 等. 新疆2种锦鸡儿种子休眠原因及破除方法的研究[J]. 石河子大学学报(自然科学版), 2013, 05: 575-581.
[9] Wang Y R, Hanson J, Mariam Y W. Effect of sulfuric acid pretreatment on breaking hard seed dormancy in diverse accessions of five wild Vigna species[J]. Seed Science and Technology, 2007, 35(3): 550-559.
[10] Bewley J D, Black M. Physiology and biochemistry of seeds in relation to germination. Vol. 2. Viability, dormancy and environmental control[M]. Springer-Verlag, 1982.
[11] THANos C A, Georghiou K, Kadis C, et al. Cistaceae: a plant family with hard seeds[J]. Israel Journal of Botany, 1992, 41(4-6): 251-263.
[12] 李廷山. 窄叶野豌豆种子休眠与萌发特性的研究[D]. 兰州大学, 2013.
[13] Clemens J, Jones P G, Gilbert N H. Effect of seed treatments on germination in Acacia[J]. Australian Journal of Botany, 1977, 25(3): 269-276.
[14] 贾娟, 刘芳, 苏红田, 等. 不同处理方法对5种豆科牧草种子萌发特性的影响[J]. 草地学报, 2012(02): 342-347.
[15] Barton L V. Special studies on seed coat impermeability[J]. Contr. Boyce Thompson Inst, 1947, 355.
[16] 高木木.新疆棘豆属植物研究[D].石河子大学学报, 2008.
[17] 高利霞,卢萍,金凤,等. 10种棘豆属植物的trnL-F序列及其分子系统学研究[J]. 西北植物学报,2013,02:266-271.
[18] Finch‐Savage W E, Leubner‐Metzger G. Seed dormancy and the control of germination[J]. New Phytologist, 2006, 171(3): 501-523.
[19] Finch‐Savage W E, Cadman C S C, Toorop P E, et al. Seed dormancy release in Arabidopsis Cvi by dry after‐ripening, low temperature, nitrate and light shows common quantitative patterns of gene expression directed by environmentally specific sensing[J]. The Plant Journal, 2007, 51(1):60-78.
[20] Ali-Rachedi S, Bouinot D, Wagner M H, et al. Changes in endogenous abscisic acid levels during dormancy release and maintenance of mature seeds: studies with the Cape Verde Islands ecotype, the dormant model of Arabidopsis thaliana[J]. Planta, 2004, 219(3):479-488.
[21] 赵清梅,余永涛,赵明生, 等. 宁夏黄花棘豆种子萌发特性研究[J].农业科学研究,2012(04):13-17.
[22] 张立峰, 吴兴文, 佘跃辉. 两型豆种子硬实特性及其休眠破除方法[J]. 安徽农业科学, 2012, 28: 13698-13701.
[23] 连洁琼. 三种豆科树种硬实形成机制及破除方法的初步研究[D]. 山东农业大学, 2013.
[24] 王琼,宋桂龙. 盐肤木种子硬实与萌发特性研究[J]. 种子,2008(04): 59-61.
[25] 鱼小军,王芳,龙瑞军. 破除种子休眠方法研究进展[J]. 种子,2005(07): 46-49.
[26] 孙树杰. 麻山药春季贮藏技术[J].现代农村科技, 2012, 1(1): 55.
[27] 徐本美,顾增辉. 硫酸处理硬实种子的效果[J]. 植物生理学通讯,1985(02):22-25.
[28] 刘红,刘庆华,刘庆超,等. 美丽胡枝子种子硬实破除方法探讨[J]. 山东林业科技,2006(06):1-3.
[29] 孙阳,王奎玲,刘庆华,等. 长萼鸡眼草种子硬实破除方法探讨[J]. 中国农学通报,2008,11:294-296.
Research Seeds Break Methods of Two Kinds of Hard Seed Oxytropis
Yang Licong1,2Huang Wenjuan1,2Li Zhijun1,2*
(1 Key Laboratory of Biological Resource Protection and Utilization of Tarim Basin, Xinjiang Production & Construction Group, Alar, Xinjiang 843300)
(2 College of Plant Science, Tarim University, Alar, Xinjiang 843300)
Three different hard break methods which were sanding GA3soaking, sulfuric acid pickling and soaked with hot water were used to investigate the effects of on the Oxytropis rupifraga and Oxytropis merkensis seed germination rate, germination process and mean germination time. The results showed that: both sanding GA3(200 mg/L) soaking and sulfuric acid pickling could significantly improve the Oxytropis’ germination rate (p<0. 05) accelerate the process of seed germination and reduce the average germination time. Compared with control group, Oxytropis rupifraga germination rate increased from 27.0% to 97. 0%, Oxytropis merkensis germination rate increased significantly from 14. 0% to 86. 0%; the average germination time of two kinds of Oxytropis was shortened from 8. 9 d to 1. 6 d and 8. 1 d to 2. 1 d respectively. The key lied on the processing time. 24 hours of GA3soaking treatment on 2 Oxytropis were the best. For Sulfuric acid pickling, the 5 min and 10 min treatments were the best. Soaking in hot water treatments, could improve the two Oxytropis’ germination rate, but had little influence on the germination process and mean germination time. The GA3soaking treatment with 24 hours was the best in seed germination, and treated 10 min with Sulfuric acid pickling was also available.
Oxytropis; seed germination; seed dormancy
2014-09-16
新疆生产建设兵团“十二五”种质资源创新与功能基因发掘及利用专项课题(2012BB045)
杨丽聪(1990-),女,2012级在读硕士,研究方向为干旱地区植物生物多样性保育。 E-mail:18231131957@163.com
*为通讯作者 E-mail:lizhijun0202@126.com
1009-0568(2015)01-0001-08
S
ADOI:10.3969/j.issn.1009-0568.2015.01.001
