UHPLC-Q-TOF/MS分析黑顺片的化学成分*
2015-04-24徐凤莲张启云彭国梅姚蓉李冰涛徐国良江西中医药大学中医基础理论分化发展研究中心南昌330004
★ 徐凤莲 张启云 彭国梅 姚蓉 李冰涛 徐国良 (江西中医药大学中医基础理论分化发展研究中心 南昌330004)
附子为毛茛科植物乌头(Aconitum carmichaeliDebx.)的子根的加工品。性大热,味辛;入心经、脾经、肾经;具有回阳救逆、补火助阳,散寒除湿之功效等[1]。临床用于治疗阴盛格阳,大汗亡阳,风寒湿痹等疾病。附子属于毒性药材,临床常用其炮制品,炮制过程中双酯型生物碱水解成单酯型生物碱,毒性显著降低等[2]。
目前,国内外对附子成分的研究已相当的成熟,但是全面解析黑顺片化学成分的研究鲜有报道。本试验采用UHPLC-Q-TOF/MS技术对黑顺片的化学成分进行全面的分析。该技术结合了超高效超高效液相的高分离度和四级杆串联飞行时间质谱的高分辨率、高灵敏度。UHPLC能为复杂的样品提供快速有效的色谱分离;Q-TOF/MS提供精确的分子量和同位素峰度等相关信息,拟合出最适元素组成(误差控制在5ppm以内),结合二级质谱裂解碎片信息,比对相关数据库和文献,推测其可能的结构,确定峰归属。
1 仪器与试药
1.1 仪器 1290系列超高效液相色谱仪(Agilent),6538A四级杆飞行时间串联质谱仪(Agilent),Milli-Q Advantage A10(Millipore);旋转蒸发仪(厦门精艺兴业科技有限公司);KDM型调温电热套(鄄城华鲁电热仪器有限公司)。
1.2 试药 本实验所用标准品均来自四川省维克奇生物科技有限公司:乌头碱标准品(批号:130723),新乌头碱标准品(批号:130402),次乌头碱标准品(批号:130509),苯甲酰乌头碱标准品(批号:130316),苯甲酰新乌头碱标准品(批号:130505),苯甲酰次乌头碱标准品(批号:130401),黑顺片(原产地四川;产品批号:1201001);甲醇(色谱纯,Tedia);乙腈(色谱准,Tedia);甲酸(色谱纯,Sigma);水为超纯水。
2 试验方法
2.1 溶液的制备
2.1.1 混标溶液的制备 分别称取乌头碱、新乌头碱、次乌头碱、苯甲酰乌头碱、苯甲酰新乌头碱、苯甲酰次乌头碱对照品约5mg,精密称定,加甲醇定容到10mL容量瓶中,作为混标溶液储备液。将上述储备液稀释100倍,即得混标溶液。
2.1.2 供试品溶液的制备 黑顺片500g,置1000mL圆底烧瓶中,加入8倍量(m/v)水回流提取3次,每次1.5h,提取液浓缩至每1mL相当于2g黑顺片原药材。将上述的黑顺片提取液用纯水稀释50倍,即得黑顺片供试品溶液。
2.2 液质联用条件
2.2.1 色谱条件 色谱柱:Poroshell 120 EC-C18柱(3.0mm×100mm,2.7μm);柱温:30℃;流动相A:0.1%甲酸水溶液,流动相B:乙腈,梯度洗脱程序为0~4min,5%B;4~6min,5%~8%B;6~15min,8%~18%B;15~20min,18%~26%B;20~28 min,26%~45%B;28~35min,45%~95%B;流速:0.4mL/min;进样量:2μL。

表1 黑顺片水提液中各成分MS2碎片的相关信息

注:S经标准品验证。
2.2.2 质谱条件 正离子扫描;扫描范围:100~1000Da;离子源:双电喷雾离子源;干燥气温度:350℃;干燥气流速:10L/min;喷雾室压力:40psig;毛细管电压:4 000V;毛细管出口电压:120V;锥孔电压:65V。
2.3 方法学考察
2.3.1 精密度试验 取同一供试品溶液,连续进样6次,每次进样2μL,计算五个主要色谱峰面积的RSD值,分别为2.91%、2.92%、1.23%、2.41%、1.50 %。
2.3.2 稳定性试验 取同一供试品溶液,分别于0,4,8,12,24h进样检测,每次进样2μL,计算五个主要色谱峰面积的RSD值分别为3.43%、3.41%、1.78%、4.05%、0.97%。结果表明样品在24 h内稳定性良好。
2.3.3 重现性试验 黑顺片水提液按照"2.1"项目下稀释方法平行6个样本,依次进样,每次进样2μL,计算五个主要色谱峰面积的RSD值,分别为1.51%、2.07%、1.88%、1.53%、1.44%。表明,方法的重复性较好。
3 结果与讨论
3.1 黑顺片成分的快速鉴定 黑顺片中生物碱类成分在Duel ESI正离子模式下获得了良好的响应,其总离子流图见图1,在35 min内各个成分得到良好的分离。本实验采用Masshunter工作站分析处理数据,对比PCDL数据库、Chemspider等网站和相关文献,鉴定了黑顺片中70种成分,包括双酯型生物碱(DDAs)4种,单酯型生物碱(MDAs)22种,醇胺型生物碱(ADAs)23种,脂型生物碱(LDAs)4种,其他类型17种(见表1)。

图1 黑顺片提取液总离子流图
3.2 确认峰归属 C19-二萜类生物碱根据C-8和C-14位取代基的不同主要分为双酯型生物碱、单酯型生物碱、醇胺型生物碱和脂型生物碱。
P64的一级质谱数据表明[M+H]+为m/z 616.311 0,Masshunter工作站拟合其化学组成为C33H45NO10,误差为-0.81 ppm,初步推断P64为次乌头碱(Hypaconitine,HAC)。二级图谱中碎片离子有m/z 584.289 5[MH-CH3OH〛+,m/z 556.289 5[MH-CH3COOH]+,m/z 524.263 6[MHCH3COOH-CH3OH]+,m/z 496.267 8[MHCH3COOH-CH3OH-CO]+,m/z 492.237 0[MHCH3COOH-2CH3OH]+,m/z 464.242 2[MHCH3COOH-2CH3OH-CO]+,m/z 460.210 8[MH-CH3COOH-3CH3OH]+,m/z 432.217 0[MHCH3COOH-3CH3OH-CO]+,m/z 402.226 9[MH-CH3COOH-CH3OH-BzOH]+,m/z 370.200 5[MH-CH3COOH-2CH3OH-BzOH]+,m/z 338.174 6[MH-CH3COOH-3CH3OH-BzOH]+,其裂解途径见图2。参照标准品及相关数据库和文献等[5-6]鉴定该化合物为HA。

图2 次乌头碱裂解途径
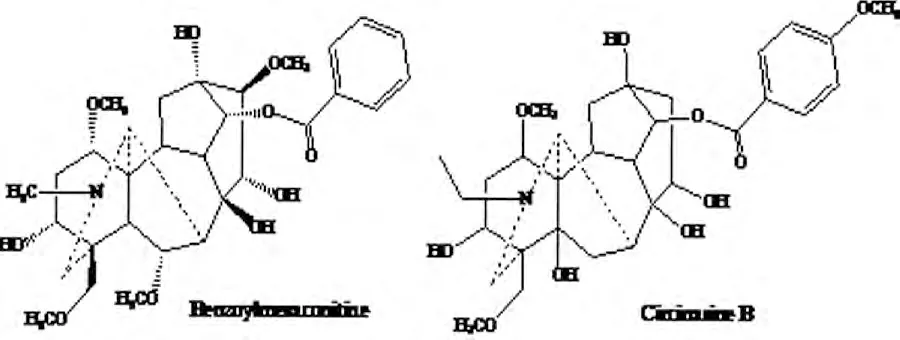
图3 Benzoylmesaconitine和Circinasine B结构式

图4 苯甲酰新乌头碱裂解途径
LDAs和DDAs的区别在C-8位取代基不同,前者为脂肪酰基取代,后者为乙酰基取代。因此,其裂解规律类似等[3-4]。同理,共鉴定出4个DDAs型和4个LDAs型化合物。
P42的一级质谱数据表明[M+H]+为m/z 590.295 9,Masshunter工作站拟合其化学组成为C31H43NO10,误差为-0.17 ppm,初步推断P42为苯甲酰新乌头原碱或Circinasine B(见图3)。二级图谱中碎片离子有m/z 572.284 6[MH-H2O]+,m/z 558.269 3[MH-CH3OH]+,m/z 540.259 0[MHCH3OH- H2O]+,m/z 526.243 0[MH -2CH3OH]+,m/z 508.232 5[MH-2CH3OHH2O]+,m/z 494.216 6[MH-3CH3OH]+,m/z 476.206 1[MH-3CH3OH-H2O]+,其裂解途径见图4。参照标准品及相关数据库鉴定该化合物为BMA。同理,共鉴定出22个MDAs型化合物。
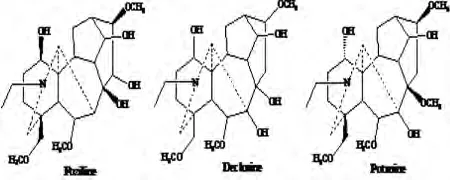
图5 Fuziline、Delcosine和Potanine结构式
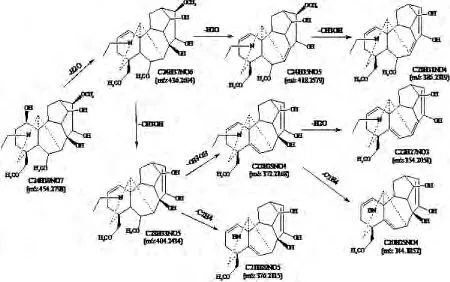
图6 附子灵裂解途径
P20的一级质谱数据表明[M+H]+为m/z 454.279 8,Masshunter工作站拟合其化学组成为C24H39NO7,误差为0.66 ppm,初步推断P20为Fuziline/Delcosine/Potanine(见图5)。二级图谱中碎片离子有m/z 436.269 4[MH-H2O]+,m/z 418.257 9[MH-2H2O]+,m/z 404.243 4[MH-CH3OHH2O]+,m/z 386.231 9[MH-CH3OH-2H2O]+,m/z 376.211 5[MH-CH3OH-H2O-C2H4]+,m/z 372.216 8[MH-2CH3OH-H2O]+,m/z 358.201 0[MH-3CH3OH]+,m/z 354.205 1[MH-2CH3OH-2H2O〛+,m/z 344.185 2[MH-2CH3OH-H2O-C2H4]+,其裂解途径见图6。参照相关数据库和文献[5]鉴定该化合物为Fuziline。同理,可鉴定出ADAs型化合物23个。
4 结论
本实验运用UHPLC-Q-TOF-MS技术全面解析黑顺片中生物碱类化学成分,初步鉴定出黑顺片提取液中70个化合物。此外,在全扫描模式中检测到了乌头碱和新乌头碱,由于含量少,并未打出二级质谱图。通过对照品对比,RT与m/z均一致,故初步推测黑顺片药材中存在极微量的乌头碱和新乌头碱。本实验较全面的解析了黑顺片的化学成分,丰富了对黑顺片中化学物质的认识,为黑顺片药效物质研究奠定基础。
[1]中华人民共和国药典委员会.中国药典·一部[M].北京:中国医药科技出版社,2010.
[2]郭志勇,吕永磊,许晓嘉,等.炮制对乌头各部位水煎液中生物碱的影响[J].中华中医药学刊,2014,32(08):1 867-1 870.
[3]Wang Y,Shi L,Song F,et al.Exploring the ester-exchange reactions of diester-diterpenoid alkaloids in the aconite decoction process by electrospray ionization tandem mass spectrometry[J].Rapid Communications in Mass Spectrometry,2003,17(4):279-284.
[4]Liu W,Pi Z,Wang X,et al.HPLC/ESI-MSn and ESI-MSstudies on the Aconitum alkaloids in three Chinese medicinal herbs[J].J Sep Sci,2010,33(17-18):2 898-2 906.
[5]Hu R,Zhao J,Qi L,et al.Structural characterization and identification of C19-and C20-diterpenoid alkaloids in roots ofAconitum carmichaeliby rapid-resolution liquid chromatography coupled with time-of-flight mass spectrometry[J].Rapid Communications in Mass Spectrometry,2009,23(11):1 619-1 635.
[6]Wang Y,Liu Z,Song F,et al.Electrospray ionization tandem mass spectrometric study of the aconitines in the roots of aconite[J].Rapid Commun Mass Spectrom,2002,16(22):2 075-2 082.
