大肠杆菌重组几丁质酶的表达、包涵体复性及酶学性质研究
2015-04-24吕梦圆吕永玲林建国王常高
吕梦圆,吕永玲,夏 祥,林建国,王常高,蔡 俊,胡 瑛
(湖北工业大学轻工学部生物工程学院,发酵工程教育部重点实验室/工业发酵湖北省协同创新中心,湖北武汉430068)
大肠杆菌重组几丁质酶的表达、包涵体复性及酶学性质研究
吕梦圆,吕永玲,夏 祥,林建国,王常高,蔡 俊,胡 瑛*
(湖北工业大学轻工学部生物工程学院,发酵工程教育部重点实验室/工业发酵湖北省协同创新中心,湖北武汉430068)
通过研究重组几丁质酶在大肠杆菌表达系统中诱导表达的浓度、时间和温度,获得表达的最佳条件。表达产物除了可溶性目的蛋白以外,仍存在于包涵体中。采用透析复性和Ni-NTA亲和层析柱上复性两种方法对包涵体中的目的蛋白进行复性,并比较对目的蛋白产率和比酶活的影响。并考察了亲和层析柱上复性时的上样量、洗脱速率和温度对酶活的影响。结果发现,表达的几丁质酶可以采用透析和亲和层析柱上复性,亲和层析柱上复性的比酶活为1347.7 U/mg,明显高于透析复性,但产率明显低于透析复性。对1 mL的Ni-NTA亲和层析柱,较低浓度的蛋白复性液在0.4 mL·min-1洗脱速率下,降低上样量和温度,可以提高复性效率。复性后的几丁质酶对荧光底物具有较高活性,反应的最适温度为37℃,最适pH为3.8。
几丁质酶,重组蛋白,包涵体,复性
几丁质(Chitin),又可称为甲壳素,广泛存在于自然界中,主要来源于真菌类的细胞壁、节肢动物(虾、蟹)的外骨骼、软体动物的器官和昆虫等[1]。估计每年自然界生物的生产量可达1×1011t[2]。几丁质能被几丁质酶降解产生几丁二糖和几丁寡糖,在食品、医药、农业以及化妆品等行业具有独特的使用价值[3]。几丁质酶(Chitinase,EC 3.2.1.14)是一类能降解N-乙酰氨基-D-葡萄糖胺β-1,4-糖苷键的酶。目前从多种微生物、植物及动物中分离出多种几丁质酶[4]。目前为了获得更有效更稳定的几丁质酶,常利用现代生物技术增强几丁质酶的表达,但重组酶在大肠杆菌的表达中会形成包涵体。鉴于包涵体蛋白无活性及复性困难的缺点,目前采用较多的复性方法有稀释复性、透析复性、柱上复性、超滤复性等[5]。本文运用大肠杆菌表达系统,表达Lactococus lactis ssp. lactis IL1403菌株中的几丁质酶基因,优化表达的最佳条件。采用透析复性和亲和层析柱上复性两种方法对包涵体中的目的蛋白进行复性,并比较对目的蛋白的产率和比酶活的影响,并初步研究了几丁质酶的酶学性质。
1 材料与方法
1.1 材料与仪器
含Lactococus lactis ssp.lactis IL1403菌株几丁质酶的重组质粒pETM11-LlChi18A 由加拿大Alberta大学食品微生物实验室提供;E.coli BL21(DE3) Invitrogen公司;考马氏亮蓝G-250和4MU-(GlcNAc)3Sigma公司;低分子量标准蛋白 Takara公司产品;E.coli BL21(DE3) Invitrogen公司;Ni-NTA柱(3 cm×5 cm) 上海生工生物工程有限公司。
Y92-11型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;蛋白电泳仪 北京六一仪器;LS-45/55型荧光分光光度计 美国Perkin Elme公司。
1.2 实验方法
1.2.1 重组几丁质酶的诱导表达 重组质粒pETM11-LlChi18A采用化学法转化到表达载体E.coli BL21 DE3中[9]。接种隔夜培养的E.coli到50 mL Luria-Bertani培养基(含50 μg·mL-1卡那霉素),将过夜培养的重组E.coli按1%的接种量接入50 mL Luria-Bertani培养基(含50 μg·mL-1卡那霉素),在37℃和250 r/min下培养至OD600达到0.6时,添加异丙基硫代-β-D-半乳糖苷(IPTG)最终浓度为0.05 mmol·L-1,在37℃继续培养6 h,并对诱导剂浓度、培养温度和培养时间进行优化。
1.2.2 裂解菌体 将培养液4℃离心10 min(8,000 r/min)收集菌体,用PBS缓冲溶液(pH7.5)洗涤菌体。以十倍体积浓缩加入PBS,进行超声波破碎。功率40 W,超声4 s,间歇6 s,超声时间15 min。破碎后的菌液于4℃离心10 min(10,000 r/min),使包涵体沉淀与可溶性蛋白分离,分别收集沉淀与上清液。
1.2.3 重组蛋白纯化及包涵体溶解 将上清液用Ni-NTA柱进行亲和层析纯化,收集含有几丁质酶的流出液,用Amicon®Ultra-15 10 ku离心过滤器去除收集液中的咪唑并浓缩酶液,得到纯化后的几丁质酶可溶性蛋白,将纯化液进行SDS-PAGE电泳分析。将上述破碎沉淀加入2 mL变性溶解液(20 mmol·L-1Tris-HCl,pH=8.0,500 mmol·L-1NaCl,1 mmol·L-1β-巯基乙醇,6 mol·L-1尿素,20 mmol·L-1咪唑),充分振荡溶解,4℃过夜得包涵体溶解液。
1.2.4 包涵体的透析复性 将9倍体积的复性液(50 mmol·L-1KH2PO4,1 mmol·L-1EDTA,50 mmol·L-1NaCl,2 mmol·L-1氧化型谷胱甘肽、1 mmol·L-1还原型谷胱甘肽,pH10.7)加入包涵体溶解液,室温放置30 min,用KOH调pH至10.7;用HCl调pH至8.0室温放置30 min,离心15 min(8 000 r/min),取上清用透析液(0.8 mol·L-1尿素,50 mmol·L-1KH2PO4,50 mmol·L-1NaCl)进行透析,透析后用荧光法测酶活。
1.2.5 包涵体的亲和层析柱上复性[10]及条件优化 变性上样缓冲液(20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,8 mol·L-1尿素,pH=8.0)平衡Ni-NTA柱,流速为0.5 mL·min-1。将2 mL包涵体溶解液经0.45 μm滤膜过滤后,上样,流速为0.5 mL·min-1。以含20 mmol·L-1咪唑洗脱缓冲液洗柱,直至OD280不再变化,流速为0.5 mL·min-1。依次以含有5、4、3、2、1、0 mol·L-1尿素的复性缓冲液(20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,0.1 mmol·L-1氧化型谷胱甘肽,1 mmol·L-1还原型谷胱甘肽,pH8.0)洗柱,每个梯度10 mL,流速为0.2 mL·min-1。再以含有100 mmol·L-1咪唑的复性缓冲液洗脱,流速为0.5 mL·min-1,复性过程中OD值随时间的变化,并收集各阶段洗脱液,4℃离心10 min(10 000 r/min),取上清液进行SDS-PAGE电泳分析。将不含尿素的洗脱液用荧光法测酶活。
1.2.5.1 蛋白上样量对复性的影响 分别将50、100、150、200 mL培养液,在同样条件下破碎离心后取沉淀,复性后用100 mmol·L-1咪唑的缓冲液进行洗脱,用Bradford法测定复性后的蛋白溶液中蛋白质的浓度,然后用荧光法测酶活。比较不同上样量对蛋白比酶活的差异。三组平行,数据方差通过SPSS软件计算。
1.2.5.2 温度对复性的影响 取亲和层析柱上复性后的重组蛋白,分别在4、25、35、45、55、65℃条件下保温30 min,用荧光法测酶活,比较其蛋白比酶活的差异。三组平行,数据方差通过SPSS软件计算。
1.2.5.3 尿素脱除速率对复性的影响 取变性蛋白溶液上样,使复性液的流速分别为0.6、0.4、0.2、0.1 mL·min-1。柱上复性后用100 mmol·L-1咪唑的缓冲液进行洗脱,用Bradford法测定复性后的蛋白溶液中蛋白质的浓度,然后用荧光法测酶活。比较尿素脱除速度对复性的影响。三组平行,数据方差通过SPSS软件计算。
1.2.6 重组几丁质酶酶学性质研究
1.2.6.1 pH对酶活的影响 反应体系:200 μmol·L-14-MU-(GlcNAc)3,2.0 nmol·L-1重组几丁质酶,2.0 mg·mL-1牛血清白蛋白和不同pH(3.0、3.4、3.8、4.2、4.6、5.0、6.0、7.0、8.0)的50 mmol·L-1柠檬酸-磷酸缓冲液。37℃下反应20 min后添加1.95 mL Na2CO3(0.2 mol·L-1)试剂停止反应。通过荧光分光光度计测定荧光强度,三组平行,考察酶反应的最适反应pH,数据方差通过SPSS软件计算。
1.2.6.2 温度对酶活的影响 反应体系:200 μmol·L-14-MU-(GlcNAc)3,2.0 nmol·L-1重组几丁质酶,2.0 mg·mL-1牛血清白蛋白和50 mmol·L-1柠檬酸-磷酸缓冲液。分别在不同温度(28、31、34、37、40、43、46、49、52、55℃)下反应20 min后添加1.95 mL Na2CO3(0.2 mol·L-1)试剂停止反应。通过荧光分光光度计测定荧光强度,三组平行,考察酶反应的最适反应温度,数据方差通过SPSS软件计算。
1.2.6.3 金属离子对酶活的影响 反应体系:200 μmol·L-14-MU-(GlcNAc)3,2.0 nmol·L-1重组几丁质酶,2.0 mg·mL-1牛血清白蛋白和50 mmol·L-1柠檬酸-磷酸缓冲液。在基本反应体系中分别加入1、5、10 mmol·L-1的CoCl2、KCl、MgCl2、CaCl2、LiCl、BaCl2、NiSO4、MnSO4、ZnCl2、CuSO4、NaCl、EDTA不同离子化合物。37℃下反应20 min后添加1.95 mL Na2CO3(0.2 mol·L-1)试剂停止反应。通过荧光分光光度计测定荧光强度,三组平行,考察不同浓度下的不同金属离子对酶活的影响,数据方差通过SPSS软件计算。
1.2.7 测定方法
1.2.7.1 SDS-PAGE 采用垂直板状电泳,SDSPAGE按标准方法进行[6]。
1.2.7.2 Bradford法测定蛋白质的浓度[7]以牛血清白蛋白(BSA)作为标准品测定其蛋白质浓度的标准曲线Y=0.7537X-0.03812(R2=0.993;X为蛋白质浓度,Y为吸光度)。根据标准曲线和OD595吸光度值换算几丁质酶液的蛋白质含量。
1.2.7.3 几丁质酶活性检测[8]以荧光物质4-甲基伞形酮(4-MU)为标准物质,采用荧光分光光度计得到标准曲线Y=0.6398X+2.4484(R2=0.991;X为4-MU浓度,Y为荧光值)。以不同浓度的4-MU-(GlcNAc)3为底物,反应液还包含2.0 nmol·L-1几丁质酶,2.0 mg·mL-1牛血清白蛋白和200 μL 50 mmol·L-1柠檬酸-磷酸缓冲液。37℃下反应不同时间,取50 μL样液,加入1.95 mL Na2CO3(0.2 mol·L-1)停止反应,采用荧光分光光度计(激发波长380 nm、发射波长460 nm)测定荧光强度,根据标准曲线计算酶活和比酶活,3次平行的结果取平均值。1个酶活力单位是指在37℃下,每分钟释放1 μmol荧光物质的酶量,而比酶活为1 mg几丁质酶所具有的酶活力单位。
2 结果与讨论
2.1 重组几丁质酶的发酵条件优化
2.1.1 诱导剂浓度的确定 从图1中可以看出,IPTG添加终浓度为0.01、0.05、0.1、0.5、1 mmol·L-1下培养12 h后,在相同菌体量的情况下,所得目的蛋白的含量差异。通过分光光度计检测换算知,0 mmol·L-1时菌体的OD600=5.943,0.01 mmol·L-1时菌体的OD600= 6.150,0.05 mmol·L-1时菌体的OD600=5.886,0.1 mmol·L-1时菌体的OD600=5.967,0.5 mmol·L-1时菌体的OD600= 5.466,1 mmol·L-1时菌体的OD600=5.766。当诱导剂最终浓度为0.05 mmol·L-1(S3)时,所获得目的蛋白的含量达到最高,且在相同的培养时间下大肠杆菌生长不受IPTG的影响,菌体量大致一样。因此选取最适IPTG添加终浓度为0.05mmol·L-1。
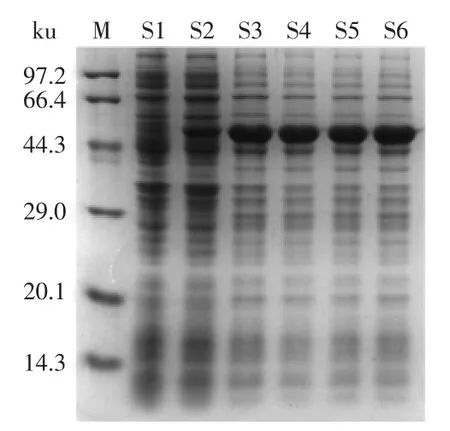
图1 IPTG浓度对IPTG诱导表达的影响Fig.1 The effect of concentration of IPTG on expression of recombinant induced by IPTG
2.1.2 诱导温度的确定 从图2中可以看出,表达的蛋白当诱导温度在25℃以下时重组蛋白的可溶性表达量较高。这说明在较低的温度下,该重组菌的菌体生长速度和重组蛋白的表达速度都会变低,使得表达重组蛋白慢慢的可溶,减少包涵体的形成。所以25℃是重组蛋白的最适表达温度。
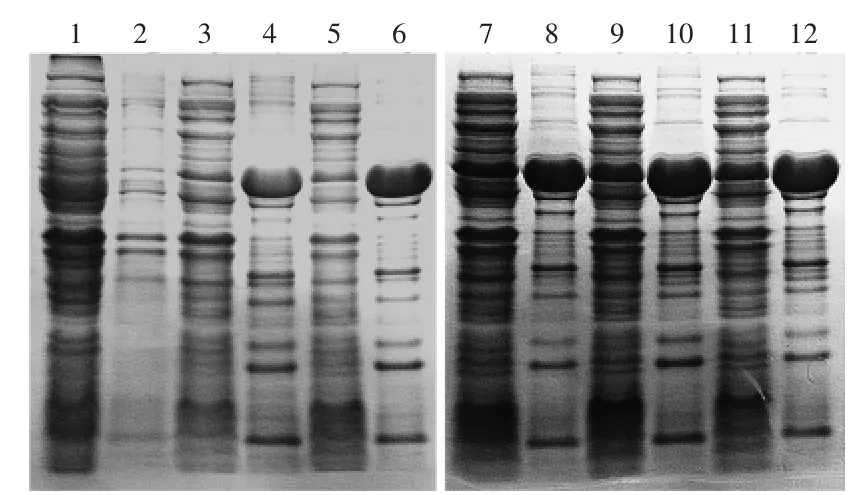
图2 温度对IPTG诱导表达的影响Fig.2 The effect of temperature on expression of recombinant induced by IPTG
2.1.3 诱导时间的确定 从图3中可以看出,IPTG添加终浓度为0.05 mmol·L-1下培养3、6、9、12、24 h后,在相同菌体量的情况下,所得目的蛋白的含量差异并不是很明显。但随着诱导时间的延长,OD600明显增加。因此,最适培养时间为12 h,此时菌体量已达到需求且对于超声破碎效率较高。
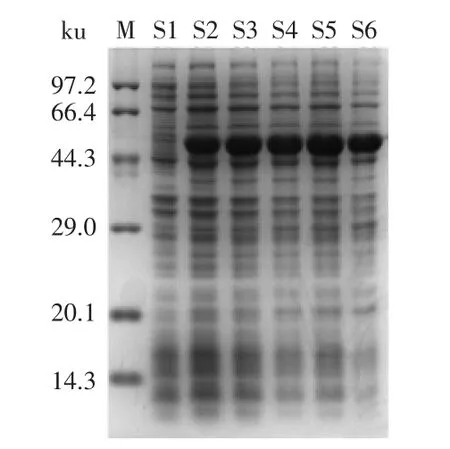
图3 培养时间对IPTG诱导表达的影响Fig.3 The effect of culture time on expression of recombinant induced by IPTG
2.2 重组几丁质酶的分离纯化
表达后的几丁质酶蛋白经超声破碎和Ni-NTA柱亲和层析纯化后在SDS-PAGE上呈现一条谱带,纯度较高,相对分子质量约为54 ku。从图4中还可以看出,重组大肠杆菌表达的几丁质酶经细胞破碎后,存在于上清液中,还有一部分以包涵体的形式存在于沉淀中,但包涵体形式的几丁质酶不具有酶活。通过前期优化产酶条件,在IPTG浓度为0.05 mmol·L-1,温度25℃培养12h,可使上清液中目的基因的量增加,而包涵体中的含量相对减少,但并不能完全消除包涵体的形成。
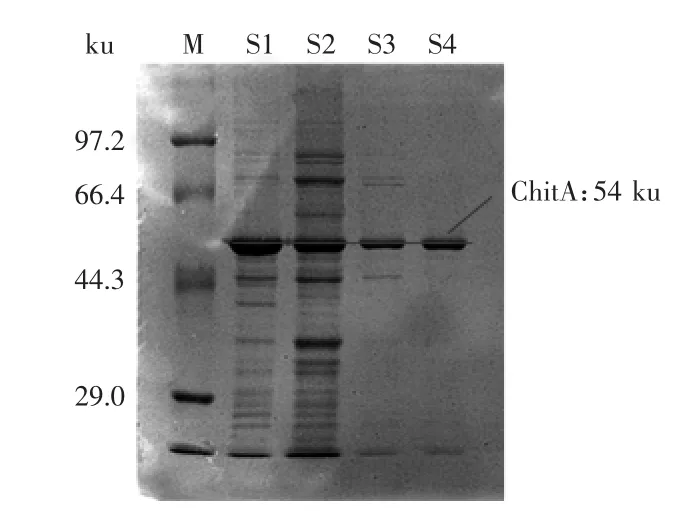
图4 甲壳素酶分离纯化SDS-PAGE图Fig.4 SDS-PAGE analysis of chitinase purification
2.3 透析复性与亲和层析柱上复性
通过透析复性与亲和层析柱上复性对包涵体进行处理后,得到具有酶活的重组几丁质酶。从图5中,可以看出透析复性的蛋白质含量比亲和层析的高,但在蛋白纯度上,亲和层析比透析复性有优势,通过表1中的数据可以看出,亲和层析柱上复性所得的几丁质酶的活性远远高于透析复性所得。
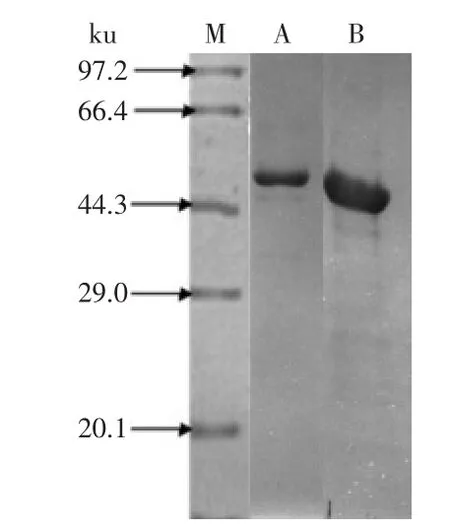
图5 透析复性与亲和层析柱上复性的SDS-PAGE比较Fig.5 Compared with two kinds of refolding method by SDS-PAGE

表1 透析复性与亲和层析柱上复性的比酶活和蛋白含量的比较Table 1 Compared with two kinds of refolding methods by specific activity and content of protein
2.4 亲和层析柱上复性影响酶活的因素
2.4.1 温度对复性的影响 将纯化后的复性蛋白,分别在4、25、35、45、55、65℃条件下保温30 min,用荧光法测定其酶活。由图6可以看出,复性后的几丁质酶在4~35℃温度范围内活性较为稳定,温度高于35℃后,其稳定性开始急剧下降,温度为65℃时酶活几乎降为0,因此几丁质酶包涵体在4℃下复性处理较为合理。
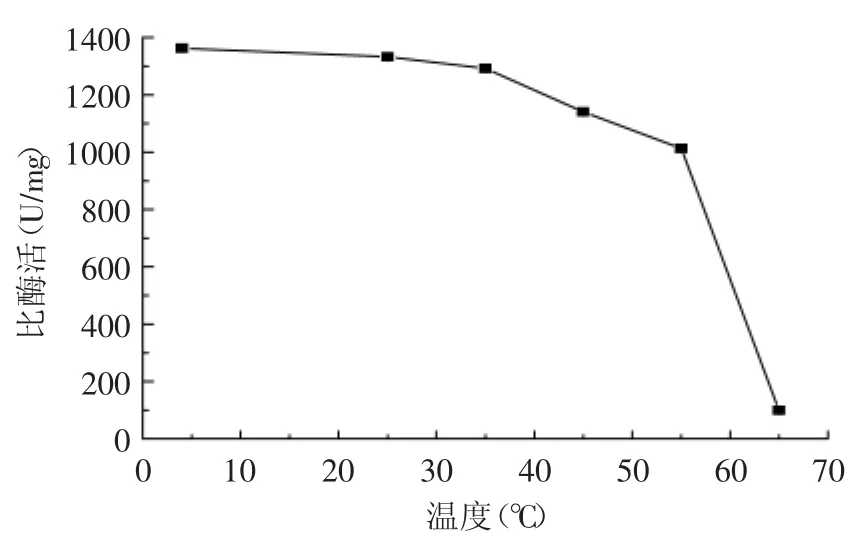
图6 复性几丁质酶的热稳定性(p<0.05)Fig.6 Thermal stability of refolded chitinase(p<0.05)
2.4.2 蛋白上样量对复性的影响 从图7中可以看出,随着上样量的增加,其复性效率会逐渐降低。增加上样量后不仅不能提高目的蛋白的浓度和活性,还会增加杂蛋白的浓度。这主要是因为吸附在镍柱上的蛋白,在复性过程中分子间会形成聚集体,且随着蛋白浓度的增加,其形成聚集体的机会增大,因此复性效率会降低。由此可知,亲和层析柱上复性只能进行小剂量的实验分析。
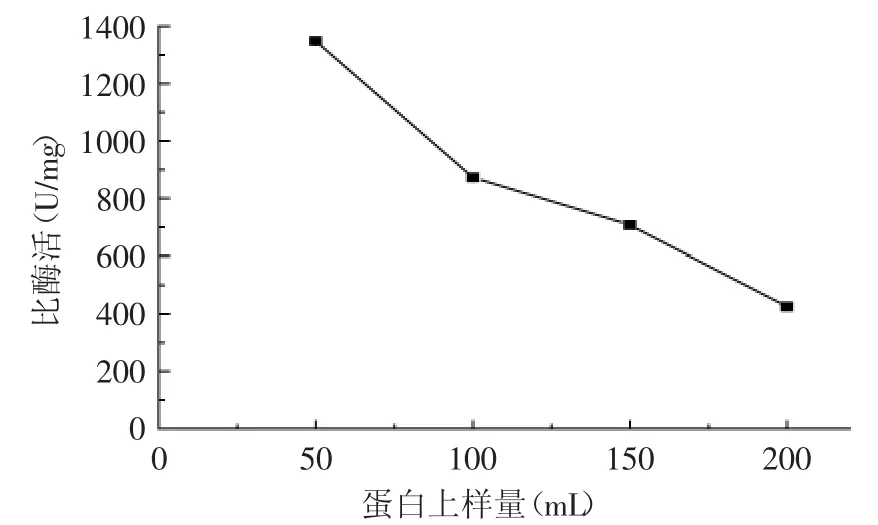
图7 蛋白上样量对复性几丁质酶比酶活的影响(p<0.05)Fig.7 The effect of loading amount of protein on the specific activity of refolded chitinase(p<0.05)
2.4.3 尿素脱除速率对复性的影响 从图8中可以看出,尿素复性液的线性梯度形成时的溶液流速对复性酶活的影响。当其速率为0.1~0.4 mL·min-1时,复性的包涵体酶活随着洗脱速率的增加而提高,但当洗脱速率增加到0.6 mL·min-1时,酶活下降。由于尿素的线性变化是一定的,因此流速越快,尿素的脱除速度也越快。尿素是蛋白变性剂,其脱除速度慢,蛋白复性过程长,可反复进行折叠和变性,复性效率就高;相反,尿素脱除速度快,蛋白很难进行反复折叠,复性效率就低。
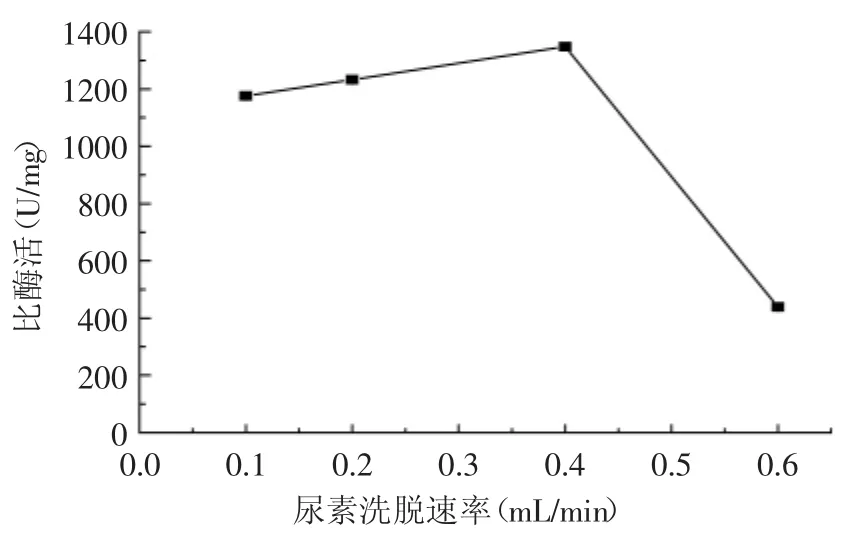
图8 尿素脱除速率对复性几丁质酶比酶活的影响(p<0.05)Fig.8 The effect of urea elution rate on the specific activity of refolded chitinase(p<0.05)
2.5 重组几丁质酶酶学性质研究
2.5.1 pH及温度对重组蛋白酶活的影响 通过荧光底物4-MU-(GlcNAc)3测定重组几丁质酶在不同pH的缓冲液体系中的酶活力,结果如图9(A)所示,说明几丁质酶在pH3.0~3.8时,荧光强度逐渐增加,说明酶降解底物释放出更多的(GlcNAc)2,随着pH的继续增加,荧光强度逐渐下降,说明随着pH的增加,酶的活性逐渐下降,当pH为8时酶的活性几乎为零。通过荧光底物4-MU-(GlcNAc)3测定重组几丁质酶LlChi18A在不同温度下的酶活力,结果如图9(B)所示。当反应温度在28~37℃之间,酶活力呈上升的趋势,37℃为酶反应最佳温度,这可能是由于该酶来源于Lactococcus lactis ssp.lactis IL1403,其最适生长温度为37℃。当反应温度在37℃以上时,酶活力逐渐下降,温度的升高改变了酶的空间结构以至于酶失去活性。
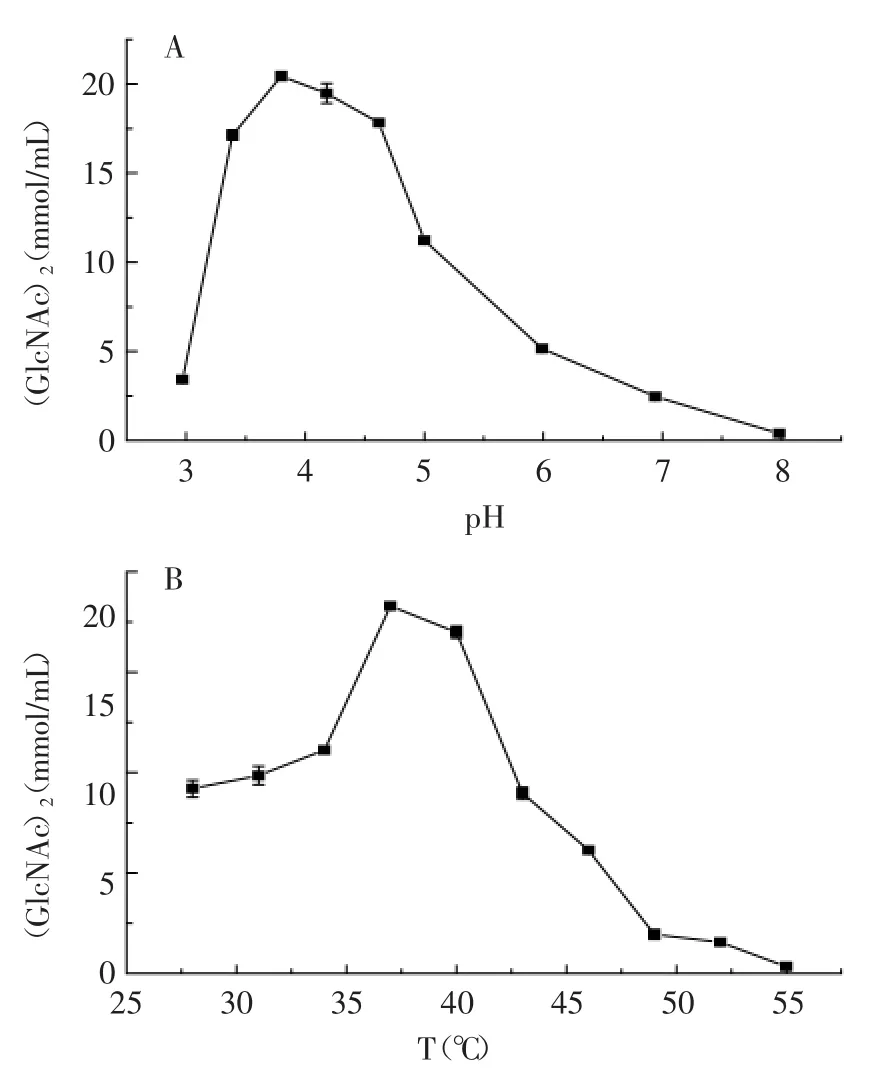
图9 pH(A)和温度(B)与对重组几丁质酶酶活的影响(p<0.05)Fig.9 The Effect of pH(A)and temperature(B)on the activity of recombinant chitinase(p<0.05)
2.5.2 金属离子对酶活的影响 从表2中可以看出,金属离子Co2+、K+、Mg2+、Ca2+、Li+、Ba2+、Ni2+、Mn2+、Zn2+、Cu2+、Na+和EDTA,当在反应混合物的最终浓度为1、5或10 mmol·L-1时,金属离子对重组几丁质酶酶活的影响。当浓度为10 mmol·L-1时,金属离子Zn2+、Cu2+、Co2+和Mn2+强烈抑制几丁质酶的活性。同时,Cu2+、Ni2+的浓度在5和10 mmol·L-1时强烈抑制几丁质酶的活性。随浓度的增加,EDTA对几丁质酶的活性呈负效应;1 mmol·L-1Na+、Mg2+和5 mmol·L-1Ba2+、Li+对几丁质酶的活性有促进作用。其他金属离子(Ca2+、K+)对酶活性的影响的较弱。

表2 不同金属离子在不同浓度下对重组蛋白相对酶活的影响(p<0.05)Table 2 The effect of various metal ions on the relative activity of recombinant chitinase(p<0.05)
3 结论
几丁质酶在大肠杆菌表达系统中,可溶性蛋白和包涵体均有表达。经含有8 mol·L-1尿素的溶解缓冲液处理后,包涵体变性溶解。通过比较透析复性法和亲和层析柱上复性法对包涵体复性产率的影响,结果发现,亲和层析柱上复性在酶活上明显优于透析复性,但产率上透析复性要明显高于亲和层析柱上复性。通过优化亲和层析柱上复性的条件,结果表明,较低浓度的蛋白复性液在0.4 mL·min-1洗脱速率下,降低上样量并降低环境温度,能有效提高复性效率。亲和层析柱上复性得到高纯度、可溶的重组几丁质酶蛋白的最适pH为3.8,最适温度为37℃。当浓度为10 mmol·L-1时,金属离子Zn2+、Cu2+、Co2+和Mn2+强烈抑制几丁质酶的活性。同时,Ni2+的浓度在5和10 mmol·L-1时强烈抑制几丁质酶的活性;随浓度的增加,EDTA对几丁质酶的活性呈负效应;1 mmol·L-1Na+、Mg2+和5 mmol·L-1Ba2+、Li+对几丁质酶的活性有促进作用。其他金属离子(Ca2+、K+)对酶活性的影响的较弱。实验结果为进一步研究和开发几丁质酶的应用奠定基础。
[1]韩宝芹,余长缨,刘万顺,等.几丁质酶的研究现状与展望[J].中国海洋药物,2001(5):41-43.
[2]张文博,陈盛.甲壳素/壳聚糖的提取及其应用研究新进展[J].福建师范大学福清分校学报,2008(1):18-25.
[3]夏文水,吴焱楠.甲壳素/壳聚糖水解酶的研究进展[J].中国海洋药物,1997,16(2):31-35.
[4]陈三风,李季伦.几丁质酶研究历史和发展前景[J].微生物学通报,1993,20(3):156-160.
[5]高永贵,关怡新,姚善泾.包涵体蛋白的变复性研究[J].科技通报,2003,19(1):10-15.
[6]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227: 680-685.
[7]Bradford MM.A rapid and sensitivemethod forthe quantization of microgram quantities of protein utilizing the principle of protein-dye binging[J].Anal Biochem,1976,72:248-254.
[8]Vaaje-Kolstad G,Bunæs AC,Mathiesen G,et al.The chitinolytic system of Lactococcus lactis ssp.lactis comprises a nonprocessive chitinase and a chitin-binding protein that promotes the degradation of α-and β-chitin[J].FEBS J,2009,276:2402-2415.
[9]李明才,何韶衡.一种高效、快速的大肠杆菌感受态细胞制备及质粒转化方法[J].汕头大学医学院学报,2005,18(4):228-230.
[10]张少恩,孙晗笑,张光,等.大肠杆菌表达的vMIP-Ⅱ包涵体的纯化与复性研究[J].中国生物制品学杂志,2005,18(3):247-251.
Expression and inclusion body renaturation of recombinant chitinase in E.coli and its enzymology properties
LV Meng-yuan,LV Yong-ling,XIA Xiang,LIN Jian-guo,WANG Chang-gao,CAI Jun,HU Ying*
(Department of Bioengineering,Hubei University of Technology,Key Laboratory of Fermentation Engineering(Ministry of Education)/Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,Wuhan 430068,China)
This study aimed to use E.Coli BL21(DE3)to overexpress recombinant chitinase and study the concentration of inducer,time and temperature of expression to optimize the expression.The recombinant chitinase was not only in the soluble protein but also in the inclusion body.The refolding methods by dialysis and Ni-NTA column were used to renature the chitinase and were compared by the content of protein and specific enzyme activity.The effects of the loading protein amount,the flow rate of refolding buffer and the temperature on the refolded chitinase were investigated.The results show that chitinase could be refolded by dialysis and Ni-NTA column.The enzyme activity of chitinase by the affinity chromatography which was 1347.7 U/mg was higher than by the dialysis method,but its yield by the affinity chromatography was lower than by the dialysis method.The enzyme activity of refloding increased when the chitinase sample with lower concentration was loaded to the column under lower temperture at the optimal elution rate of 0.4 mL·min-1.The chitinase from the affinity chromatography refolding possessed higher activities to degrade fluorescent substrate. The optimal temperature was 37℃and the optimal pH value was 3.8.
chitinase;recombinant protein;inclusion body;refold
TS201.2
A
1002-0306(2015)22-0168-06
10.13386/j.issn1002-0306.2015.22.027
2015-04-14
吕梦圆(1989-),女,在读硕士研究生,研究方向:生物可再生资源的微生物利用,E-mail:lvmengyuan315@163.com。
*通讯作者:胡瑛(1975-),女,副教授,研究方向:再生资源生物利用和生物活性物质的转化,E-mail:huying@mail.hbut.edu.cn。
国家自然科学基金青年科学基金项目(31201425)。
