金属Sc修饰C70富勒烯储氢性能的第一性原理研究
2015-04-24武雯雯董顺乐
武雯雯,董顺乐
随着能源和环境问题的日益严重,开发可再生的绿色能源已成为当务之急.氢气具有清洁、高效、可持续等优点,作为一种潜在的新型能源,目前受到广泛的关注和研究.然而氢能源在存储上面临着许多问题,传统的储氢方法不能满足氢气的大规模应用,因此开发新型储氢材料也成为近年来的研究热点[1,2].
自1985年,Kroto和Smalley等人制备得到富勒烯后,对该结构的研究相继在物理、化学、医学等各个领域展开[35].富勒烯是一种碳的同素异形体,由多个五边形和六边形组合而成,由于其结构上的对称性,使得电子能级具有较高的简并度和电负性,能够发生各种电化学加氢反应[6,7],生成的加氢化合物非常稳定.因此可作为储存氢气的材料,广泛应用于氢的纯化、吸收及新型燃料电池中.富勒烯自大量制备以来,一直被看作是潜在的储氢载体,国内外也对其作了大量的研究实验[8-12].
纯净的富勒烯在常温常压下,储氢能力有限且通过微弱的范德华力作用吸附氢气,不能满足实际生活中大规模的应用需求.近年来,人们对掺杂各种金属的富勒烯化合物的研究发现,通过金属的掺杂改性可大大提高富勒烯纳米材料的储氢能力[13-16].本文选取了C70富勒烯及过渡金属Sc元素作为研究对象,运用基于密度泛函理论的第一性原理,研究了在进行金属Sc掺杂后,体系的储氢性能及吸附本质.
1 计算方法
本文中所有的计算由基于密度泛函理论(DFT)[17]的软件包SIESTA(Spanish Initiative for Electronic Simulation with Thousands of Atoms)来实现.模拟计算中电子的交换关联能采用广义梯度近似(GGA)和PBE(Perdew-Burke-Ernzerhof)[18]泛函方法.初始状态下,超晶格参数设定为20Å×20Å×20Å,这个正四方晶格保证足够大,避免各个方向上周期性映像之间的相互作用.平面波展开截断能设定为200 Ry,在计算过程中,选取Г点代表布里渊区,自洽场的收敛标准设定为0.03 e V/Å.
2 结果和讨论
2.1 金属Sc原子在C70上的吸附
C70富勒烯由12个五元环和25个六元环组成,优化后的结构如图1a所示,图中所标的P和H分别代表五元环正上方和六元环正上方.在接下来的分析中,将重点讨论P、H吸附位对氢分子的吸附作用.金属Sc原子在C70富勒烯上的吸附能计算如下:

其中,E C70Sc( )、E C70( )和E(Sc)分别代表吸附一个Sc原子后体系的总能量、纯净C70富勒烯的总能量和单个金属Sc原子的总能量.

图1 C70及掺杂Sc原子后的优化结构图

表1 单个Sc原子吸附在C70表面五元环和六元环上方时的吸附能、Sc-C键长、重叠布局数及密立根电荷_
优化结果显示,Sc原子均可吸附于五元环和六元环的上方,并能够与碳环上所有碳原子成键.从表1可知,Sc原子吸附在六元环上方时的吸附能较大,为-3.28 e V.在五元环上方的吸附能较小,为-1.20 e V,由此可以判断Sc原子在C70的六元环上的吸附最稳定.计算发现,Sc-C的平均键长分别为2.451Å和2.357Å,表明在六元环上的强吸附作用使得Sc-C之间的距离更近,这与表1中所列出的Sc-C之间的重叠布局数分析一致.分析吸附体系中的密立根电荷数可知,吸附后Sc原子失去电子带正电荷,说明Sc原子与周围碳原子发生相互作用,电子从Sc原子转移到了邻近碳原子上.金属原子与富勒烯之间的这种相互作用为下一步的储氢提供了条件.
许多研究表明,一些金属原子易在纳米材料表面发生团簇作用,使得金属原子的储氢能力降低或丧失.因此,研究了多个金属Sc吸附到富勒烯表面时可能的团簇现象及系统的稳定性.如图2所示,在C70表面分别吸附8(六元环)、12(五元环)个Sc原子,优化后的结构仍能保持稳定性而不发生团簇现象,这也证明了纳米材料基底与金属选取的可行性.
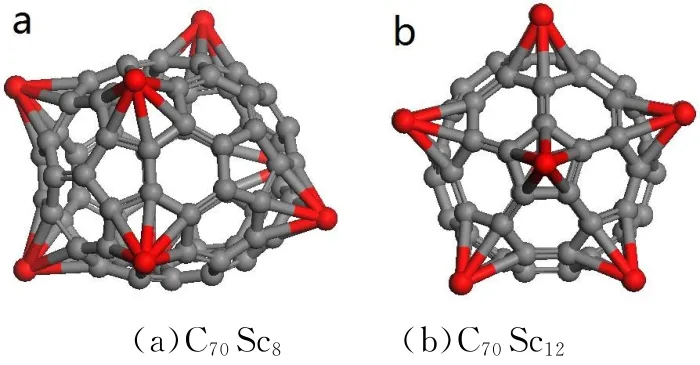
图2 C70在六元环和五元环上分别掺杂8个、12个Sc原子结构图
2.2 氢分子在C70 Sc体系上的吸附
下面,将详细讨论C70Sc体系与氢分子的相互作用及多个Sc掺杂后系统总的储氢能力.如图3所示,在五元环和六元环上Sc原子均能吸附四个氢分子,且呈一定的对称分布.氢分子在C70Sc上的平均吸附能计算如下:

其中,E( C70Sc+n H2)、E( C70Sc)和E( H2)分别代表吸附了n个氢分子后C70Sc体系的总能量、C70Sc体系的总能量和单个氢分子的总能量,n代表吸附氢气分子的个数.

图3 Sc原子掺杂在五元环和六元环上时,分别吸附1~4个氢分子的结构图
由表2可知,吸附第一个氢分子后,氢分子以分子形式吸附在金属Sc上,吸附能分别为-0.79 e V(五元环)和-1.05 e V(六元环),此时H-H键长、Sc-H键长差别不大.同时计算得到Sc-C键长为2.443Å和2.388Å,这个值相比未吸附氢气前有了轻微的变化,表明氢分子的吸附对金属Sc原子与富勒烯的相互作用产生了影响.经计算,Sc原子在五元环带有0.365e的正电荷,较吸附氢气前有了明显增加,表明电子从Sc原子转移到了氢分子上,使氢分子带负电,Sc原子带正电.当第二个氢分子吸附到C70Sc H2后,氢分子在Sc原子上趋向于对称分布,形成的Sc-C键有一定程度的拉伸,H-H键与Sc-H键键长变化不大,从重叠布局数上也可以证明这一点.为了研究C70Sc体系中金属原子能够吸附的最大氢分子数,接着讨论了更多的氢分子连续吸附到金属Sc原子上的储氢性质.Sc原子吸附在五元环和六元环上的情况类似,因此这里只讨论五元环上的情况.第三、四个氢分子加到金属原子周围后,计算结果显示吸附能分别为-0.88 e V和-0.80 e V,这表明随着氢分子吸附数目的增多,吸附作用开始减弱,对应于Sc-H键的持续拉长.由以上分析可知,C70Sc体系通过“Dewar-Chatt-Duncanson”作用不断将氢分子吸附到Sc原子上,最终结果显示,四个氢分子对称分布于Sc原子周围.当第五个氢分子靠近时,体系达到饱和无法吸附多余的氢分子.
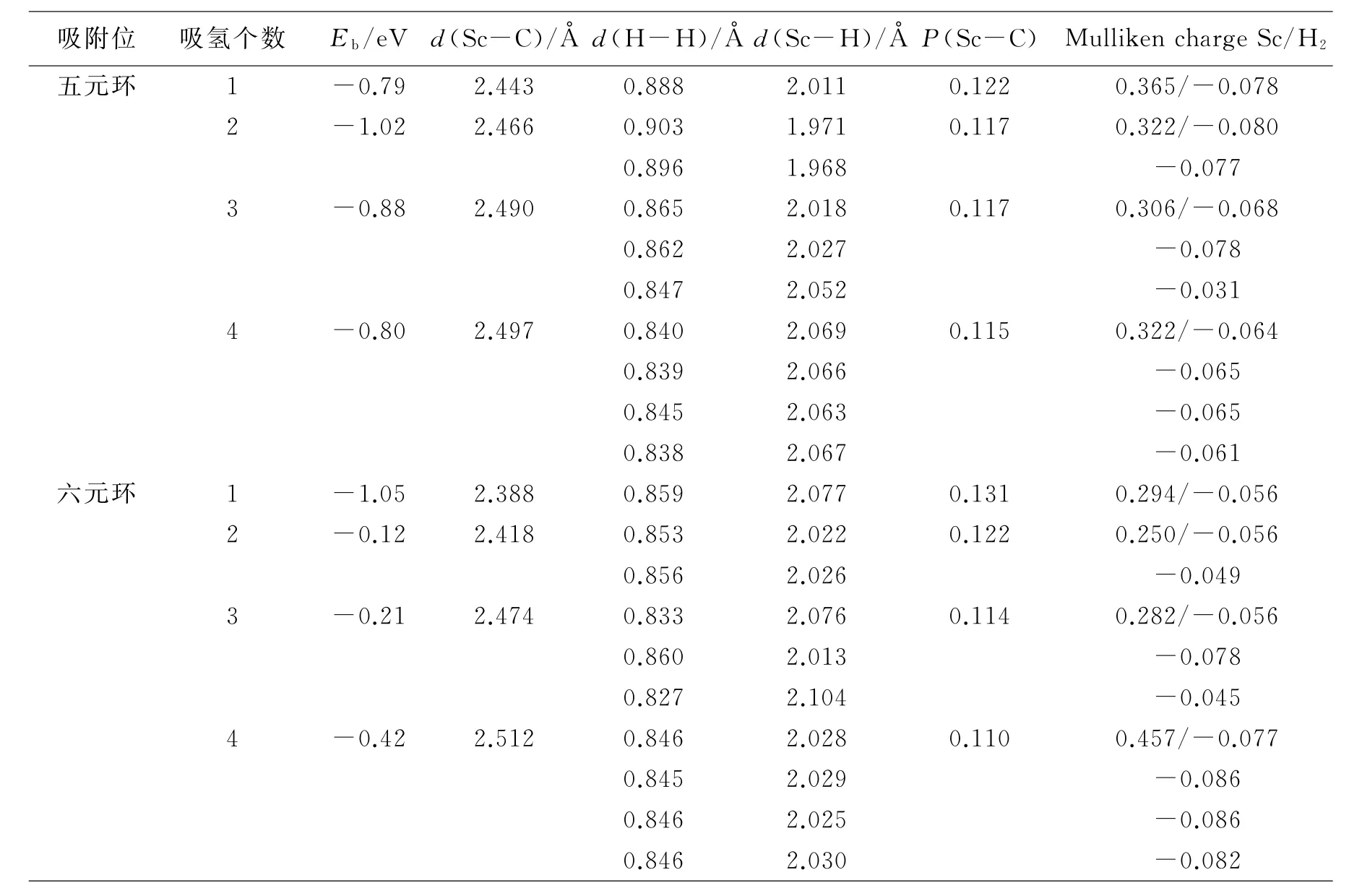
表2 Sc原子在C70不同位置吸附时,氢分子的吸附能、Sc-C键长、H-H键长、Sc-H键长、布局数及密立根电荷分析
2.3 C70富勒烯多位置掺杂Sc原子储氢率的计算
由以上讨论可知,单个金属Sc原子在五元环和六元环上最大可吸附四个氢分子.为了研究整个体系的储氢性能,讨论了多个位置的吸附情况.如图4所示,C70表面不相邻六元环吸附位共有8个,当全部Sc吸附位吸附满四个氢分子后,该体系的最大储氢率仅为5.06%,不能满足美国能源部公布的储氢最低标准(6.50%).而C70表面五元环吸附位共有12个,当全部Sc吸附位均吸附上四个氢分子后,该体系的最大储氢率可达6.50%.
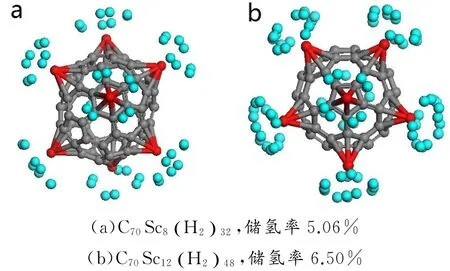
图4 C70富勒烯表面掺杂不同数目的Sc原子后,体系吸附氢分子的结构图
3 总结
综上所述,本文采用第一性原理的方法比较分析了C70富勒烯表面过渡金属Sc不同掺杂位置对氢气的吸附情况.过渡金属Sc原子能够吸附于C70的五元环和六元环正上方,且与邻近碳原子发生强相互作用,显著提高了富勒烯的储氢性能.计算发现,每个金属可通过“Dewar-Chatt-Duncanson”作用稳定吸附四个氢分子.当多个金属Sc原子掺杂后,在六元环上的储氢效果不够理想,而在所有12个五元环上掺杂金属Sc的储氢能力较大,体系的储氢率可达6.50%.
参考文献:
[1]马冬梅,蔡艳华,彭汝芳,等.富勒烯储氢技术研究进展[J].现代化工,2008,28(12):33-37.
[2]王锦川.C60及碳纳米管研究现状及发展前景[D].吉林:东北师范大学,2009:1-47.
[3]高健,林中祥,邓慧敏,等.微波辐射下C60富勒烯与脱氢枞胺的加成反应[J].现代化工,2007,27(S1):266-268.
[4]涂江平.含无机类富勒烯(IF)过渡族金属硫化物纳米复合涂层的环境摩擦磨损特性[J].机械工程学报,2007,43(1):77-82.
[5]乔新歌,黄成,银亚冰,等.几种不同结构富勒烯衍生物对HeLa细胞的光诱导毒性[J].北京理工大学学报,2007,27(6):556-559.
[6]Carravetta M,Murata Y,Murata M.Solid-state NMR spectroscopy of molecular hydrogen trapped inside an open-cage fullerene[J].J.Am.Chem.Soc.,2004,126:4092-4093.
[7]Iwamatsu S,Murata S,Andoh Y,et al.Open-cage fullerene derivatives suitable for the encap sublation of a hydrogen molecule[J].J.Org.Chem.,2005,70:4820-4825.
[8]Yoon M,Yang S Y,Hicke C,et al.Calcium as the superior coating metal in functionalization of carbon fullerenes for high-capacity hydrogen storage[J].Phys.Rev.Lett.,2008,100(20):206806(1)-206806(4).
[9]Sun Q,Jena P,Wang Q,et al.First-principles study of hydrogen storage in Li12C60[J].J.Am.Chem.Soc.,2006,128(30):9741-9745.
[10]Shin W H,Yang S H,GoddardⅢW A,et al.Nidispersed fullerenes:hydrogen storage and desorption properties[J].Appl.Phys.Lett.,2006,88(5):053111(1)-053111(3).
[11]Yang S Y,Yoon M,Wang E,et al.Energetics and kinetics of Ti clustering on neutral and charged C60surfaces[J].J.Chem.Phys.,2008,129(13):134707(1)-134707(7).
[12]Chandrakumar K R S,Ghosh S K.Alkali-metal-induced enhancement of hydrogen adsorption in C60fullerene:an ab initio study[J].Nano.Lett.,2008,8(1):13-19.
[13]Wang Q,Sun Q,Jena P,et al.Theoretical study of hydrogen storage in Ca-coated fullerenes[J].J.Chem.Theory Comput.,2009,5(2):374-379.
[14]Sun Q,Wang Q,Jena P,et al.Clustering of Ti on a C60 surface and its effect on hydrogen storage[J].J.Am.Chem.Soc.,2005,127(42):14582-14583.
[15]Yildirim T,Iniguez J,Ciraci S.Molecular and dissociative adsorption of multiple hydrogen molecules on transition metal decorated C60[J].Phys.Rev.B,2005,72(15):153403(1)-153403(4).
[16]Peng Q,Chen G,Mizuseki H,et al.Hydrogen storage capcacity of C60(OM)12(M=Li and Na)clusters[J].J.Chem.Phys.,2009,131(21):214505-214512.
[17]Soler J M,Artacho E,Gale J D,et al.The SIESTA method for ab initio order-N materials simulation[J].J.Phys.Condens.Matter,2002,14:2745-2779.
[18]Perdew J P,Chevary J A,Vosko S H,et al.Atoms,molecules,solids,and surfaces:Applications of the generalized gradient approximation for exchange and correlation[J].Phys.Rev.B,1992,46(11):6671-6687.
