八月桂花籽的化学成分研究
2015-04-23乔春林秦玉琴张春燕白雪梅周奋进李珊忆
乔春林,秦玉琴,张春燕,张 旭,白雪梅,周奋进,李珊忆,黄 静
(四川大学华西药学院,四川 成都 610041)
桂花,亦称木犀、山桂、岩桂,属木犀科(Oleaceae)木犀属植物,是主要分布于中国大陆长江流域及其以南地区的特有植物,资源十分丰富[1]。八月桂(Osmanthus fragrans‘Bayuegui’)为桂花种下的一个类群,包括金桂、银桂、丹桂。
桂花植物的花、果实、籽、枝干、根或根皮均具有药用价值[2-3]。其中关于桂花籽的药用情况,如《本草纲目》中记载为:桂花籽,味甘、辛,性温,能暖胃、平肝、益胃、散寒;《植物名实图考长编》中记载为能治心痛以及《江苏药材志》中记载“暖胃,平肝,益肾,散寒,止哕”。
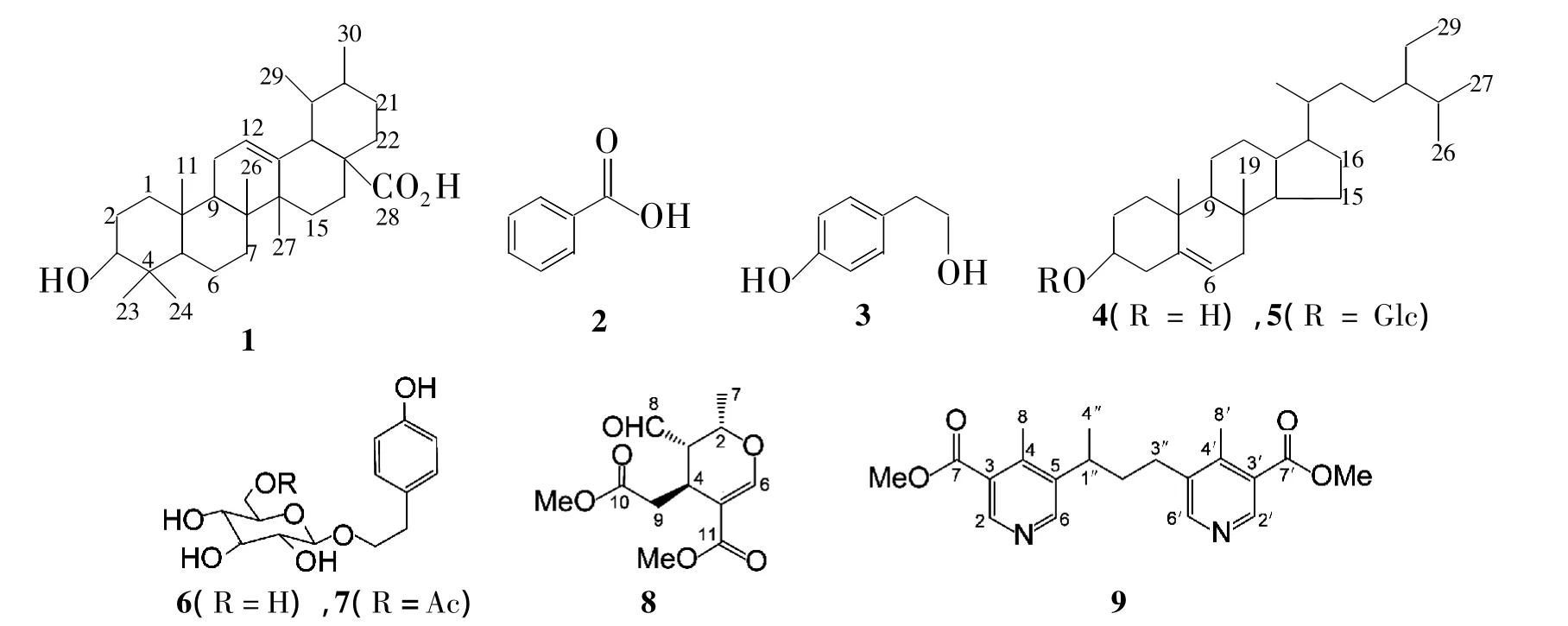
Chart 1
目前,有关桂花植物的化学成分有一定研究,康文艺等[4]总结了截止2008年,从桂花植物中已发现的化合物约有45种,分别属于环烯醚萜类、木脂素类、酚类、苯乙醇类、苯丙素类等,主要来自于金桂、银桂的树皮或树叶。有关桂花籽的化学成分研究,仅见李异政[5]报道的从桂花籽中分离出6个化合物,但该文中未注明桂花品种。
鉴于桂花植物资源的丰富和药用价值,本课题组开展了对桂花植物的系统研究。在前期,本课题组首先对桂花家族中的一新变种日香桂的花和根进行了研究[6-9],发现了一些有意义的化合物。为了更多地了解桂花植物的化学成分以及为阐明桂花植物的药用物质,本文以八月桂花籽为研究对象,开展了系统的化学成分研究。利用多种柱层析法(硅胶,RP-18反相,MCI,Sephadex LH-20)和重结晶法从八月桂花籽的95%乙醇提取物中分离出9个单体化合物[熊果酸(1),苯甲酸(2),对羟基苯乙醇(3),β-谷甾醇(4),β-胡萝卜苷(5),红景天苷(6),红景天苷酯(7),(-)-methylelenolate(8)和 4,4'-二甲基-3,3'-二甲氧羰基-5,5'-(1″-甲基-1,3″-丙基)-二吡啶(9)](Chart 1),其结构经1H NMR,13C NMR,DEPT,HMQC和HMBC确证。1~9均为首次从八月桂花籽中分离得到;7~9为首次以天然产物形式分离得到。
1 实验部分
1.1 仪器与试剂
ACE200型和Varian INO-VA400/54型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Sephadex LH-20凝胶柱(MCI树脂,RP-18反相硅胶),薄层层析硅胶GF254和柱层析用硅胶G(100目~200目和200目~300目),青岛海洋化工有限公司。
八月桂花籽,2012年采自四川省江油市,由黄静教授鉴定为八月桂花(Osmanthus fragrans‘Bayuegui’)籽;其余所用试剂为分析纯。
1.2 提取与分离
将干燥八月桂籽粗粉16 kg用石油醚(60℃ ~90℃)脱脂后,再用95%乙醇回流提取(5×2 h)。过滤,滤液减压浓缩得粗浸膏2.9 kg。粗浸膏用2%盐酸溶解,过滤,滤液用乙酸乙酯萃取,合并乙酸乙酯层,减压脱溶得浸膏A 646.6 g。乙酸乙酯萃取后的酸水层用5%氢氧化钠溶液调至pH 9~11,用乙酸乙酯萃取,合并乙酸乙酯层,脱溶得浸膏 B 103.5 g。
浸膏A 646.6 g经硅胶柱层析[梯度洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=1 ∶0~0 ∶1]洗脱得7个部分(A1~A7)。A3经硅胶柱层析(梯度洗脱剂:A=30∶1~4∶1)洗脱得4个部分(A3-1~A3-4)。A3-2经减压浓缩,放置析晶,过滤,滤饼用甲醇重结晶得2 19 mg。A3-3经硅胶柱层析[梯度洗脱剂:B=V(二氯甲烷)∶V(甲醇)=1 ∶0~1 ∶1]分离得1 8 mg。A3-4减压浓缩,放置折晶,过滤,滤饼用甲醇重结晶得4 87 mg。A7经硅胶柱层析(梯度洗脱剂:A=20∶1~1∶1)分离得白色粉末,用甲醇重结晶得5 102 mg。
浸膏B 103.5 g经硅胶柱层析(梯度洗脱剂:B=1∶0~0∶1)分享得 5个部分(B1~B5)。B1经多次硅胶柱层析[梯度洗脱剂:C=V(石油醚)∶V(丙酮)=50 ∶1~10 ∶1]分离得8 228 mg。B2减压浓缩后,放置析晶,过滤,滤饼干燥后用甲醇重结晶得3 851 mg。滤液经多次硅胶柱层析(梯度洗脱剂:C=30∶1~5∶1)分离得9 26 mg。B3经多次硅胶柱层析(梯度洗脱剂:B=50∶1~20∶1)分离,用甲醇重结晶得7 43 mg。B5经硅胶柱层析(梯度洗脱剂:B=30∶1~1∶1)分离,甲醇重结晶得 6 2.7 g。
2 结构鉴定
1:白色无定形粉末(10%硫酸/乙醇显紫红色);1H NMR δ:0.67(s,3H,25-H),0.73(d,J=13.2 Hz,3H,29-H),0.81(d,J=6.0 Hz,3H,30-H),0.85(s,3H,23-H),0.87(s,3H,24-H),0.89(s,3H,26-H),1.04(s,3H,27-H),4.29(brs,1H,3-H),5.15(s,1H,12-H);13C NMR δ:38.4(C1),27.1(C2),77.0(C3),39.1(C4),54.9(C5),18.1(C6),32.8(C7),38.5(C8),47.1(C9),36.4(C10),23.9(C11),124.7(C12),138.3(C13),41.8(C14),27.7(C15),23.0(C16),47.0(C17),52.5(C18),38.7(C19),38.6(C20),30.3(C21),36.7(C22),28.4(C23),15.2(C24),15.4(C25),17.0(C26),23.4(C27),178.4(C28),16.4(C29),21.2(C30)。NMR 数据与文献[10-11]数据吻合,故鉴定1为熊果酸。
2:无色针晶(重结晶溶剂甲醇);1H NMR(CDCl3)δ:8.14(d,J=7.5 Hz,2H,2,6-H),7.49(t,J=7.5 Hz,2H,3,5-H),7.63(m,1H,4-H)。上述NMR数据与文献[12]数据吻合,故鉴定2为苯甲酸。
3:无色针晶(三氯化铁/铁氰化钾显色反应呈阳性示存在酚羟基);1H NMR δ:2.59(t,J=7.2 Hz,2H,7-H),3.52(dt,J=7.2 Hz,5.4 Hz,2H,8-H),4.56(t,J=5.4 Hz,1H,CH2OH),6.65(d,J=8.4 Hz,2H,3,5-H),6.98(d,J=8.4 Hz,2H,2,6-H),9.11(s,1H,OH);13C NMR δ:155.7(C4),129.9(C2,6),129.7(C1),115.2(C3,5),62.9(C8),39.6(C7)。上述数据与文献[13]数据吻合,故鉴定3为对羟基苯乙醇。
4:无色针晶(甲醇);Liebermann-Burchard反应呈阳性,显示该化合物为三萜或甾体类化合物。将4与β-谷甾醇对照品薄层色谱对照,多种溶剂系统展开,两者的Rf值均一致,斑点颜色相同故鉴定为β-谷甾醇。
5:白色粉末(甲醇);Libermann-Burchard反应阳性,Molish反应阳性;1H NMR δ:谱图在高场区显示6个CH3信号[δ:0.65(s,3H,18-H),0.79 ~0.84(m,9H,26,27,29-H),0.91(d,J=6.4 Hz,3H,21-H),0.96(s,3H,19-H)],一个烯氢信号[δ:5.33(brs,1H,6-H],一组糖的端基信号[4.22(d,J=7.6 Hz,1H,1'-H)]以及一个含氧取代氢信号[δ:3.43(m,1H,3-H]。其NMR数据与文献[8]数据吻合。与 β-胡萝卜苷对照品共薄层,多种溶剂系统实验,Rf值一致,且斑点颜色相同,故确定5为β-胡萝卜苷。
6:无色方晶(甲醇);1H NMR δ:9.16(s,1H,p-OH),7.04(d,J=8.1 Hz,2H,2,6-H),6.66(d,J=8.1 Hz,2H,3,5-H),4.80 ~ 5.00(m,3H,2',3',4'-OH),4.48(t,J=5.7 Hz,1H,6'-OH),4.16(d,J=7.8 Hz,1H,1'-H),2.90~3.90(m,8H,2'~6'-H),2.73(m,2H,7-H);13C NMR δ:128.8(C1),130.0(C2,6),115.2(C3,5),155.8(C4),35.1(C7),70.3(C8),Glc:103.0(C1'),73.7(C2'),77.0(C3'),70.2(C4'),77.1(C5'),61.3(C6')。以上数据与文献[14]数据吻合,故鉴定6为红景天苷。
7:白色粉末(重结晶溶剂甲醇);1H NMR δ:9.16(s,1H,p-OH),7.03(d,J=8.4 Hz,2H,2,6-H),6.66(d,J=8.4 Hz,2H,3,5-H),5.14(d,J=5.2 Hz,1H,1'-H),5.03(m,2H,8-H),4.24(m,2H,7-H),3.28 ~4.14(m,4H,2'~5'-H),2.90 ~3.26(m,3H,2'~4'-OH),2.73(t,J=6.4 Hz,2H,6'-H),2.00(s,3H,CH3CO);13C NMR δ:129.0(C1),130.1(C2,6),115.4(C3,5),155.9(C4),35.2(C7),70.4(C8),170.7(CO),21.1(CH3),Glc:103.3(C1'),73.9(C2'),76.8(C3'),70.4(C4'),73.7(C5'),64.1(C6')。上述数据与文献[15]数据吻合,故鉴定7为红景天苷酯。
8:无色油状液体,[α]20D- 94.3°(c 0.698,CHCl3);1H NMR(CDCl3)δ:9.65(s,1H,8-H),7.64(s,1H,6-H),4.21(q,J=6.0 Hz,1H,2-H),3.73(s,3H,13-H),3.70(s,3H,12-H),3.39(m,1H,4-H),2.93(dd,J=16.4 Hz,3.0 Hz,1H,9a-H),2.27(dd,J=16.4 Hz,11.1 Hz,1H,9b-H),2.65(s,1H,3-H),1.58(d,J=6.0 Hz,3H,7-H);13C NMR(CDCl3)δ:199.5(C8),156.6(C6),106.5(C5),28.0(C4),38.3(C9),171.6(C10),69.4(C2),50.8(C3),166.9(C11),17.9(C7),51.4(C12),51.8(C13)。上述数据与文献[16]数据吻合,故鉴定8为(-)-methylelenolate。
9:白色无定形粉末;碘化铋钾试剂检测呈橙红色,示该化合物为生物碱类;1HNMR:谱图显示了3个甲基信号[δ:1.29(d,J=6.6 Hz,3H,4″-H),2.44,2.38(s,each,3H,8,8'-H)],2 个甲氧基信号[δ:3.88,3.87(s,3H each,9,9'-H)],4个脂肪族氢信号[δ:3.17,2.69,2.54(m,1H each,1″,3a″,3b″-H),1.89(m,2H,2″-H)],以及 4 个芳氢信号[δ:8.69,8.67,8.66,8.42(s,1H each,2,2',6,6'-H)];13CNMR(DMSO-d6)谱图显示了20个碳信号。HMBC谱图显示了各种氢信号与碳信号的远程相关关系,其中主要的相关为3个甲基氢信号[δ 1.29,2.44和2.38 分别与 δ 32.7(C1″),37.2(C2″)和 141.3(C5);δ 127.0(C3),141.3(C5)和145.0(C4);δ 127.2(C3'),137.0(C5')和 145.8(C4')等碳信号之间存在远程相关;以及2个甲氧基氢信号δ 3.88,3.87则分别与 δ 167.4(C7)和 167.1(C7')存在远程相关。进一步结合1H,13C NMR,DEPT,HMQC和 HMBC谱图进行分析,并将NMR数据与文献[17]数据比较,确认两者基本一致,故鉴定9 为 4,4'-二甲基-3,3'-二甲氧羰基-5,5'-(1″-甲基-1,3″-丙基)-二吡啶。
[1]中国科学院中国植物杂志编辑委员会.中国植物志[M].北京:科学出版社,1992.
[2] 汤庚国.中国桂花资源及其利用与开发(上)[J].资源节约和综合利用,1994,9(3):32-36.
[3]任全进,朱洪武,于金平.桂花资源的利用价值[J].中国野生植物资源,1999,18(4):32 -33.
[4]康文艺,王金梅,苑鹏飞.木犀属植物化学成分及药理作用研究进展[J].河南大学学报(医学版),2008,27(3):8 -13.
[5]李异政.桂花种子和酸浆全草的化学成分研究[D].桂林:广西师范大学,2007.
[6]唐敏,谭小燕,钟雪梅,等.日香桂花的化学成分研究[J].华西药学杂志,2009,24(1):10 -13.
[7]席贞,唐敏,王文静,等.日香桂花的化学成分研究(II)[J].华西药学杂志,2011,26(3):216 -220.
[8]刘淼,杨晓燕,彭晓姣,等.日香桂根的化学成分研究[J].合成化学,2013,21(3):306 -308.
[9]黄冕,刘淼,许浩然,等.日香桂根的化学成分研究(II)[J].合成化学,2013,21(6):689 -691.
[10]王宁辉,马养民,康永祥,等.白檀化学成分的研究[J].时珍国医国药,2014,25(11):2624 -2626.
[11]吴月霞,张伟,李继成,等.尾叶香茶菜化学成分的研究[J].中草药,2011,42(12):2402 -2406.
[12]尹伟,刘金旗,张国升.桂花果实的化学成分研究[J].中国中药杂志,2013,38(24):4329 -4334.
[13]苑艳光,王录全,吴立军,等.刺五加茎的化学成分苑[J].沈阳药科大学学报,2002,19(5):325 -327.
[14]倪付勇,陈重许,琼明,等.高山红景天化学成分研究[J].中草药,2013,44(7):798 -802.
[15]Huilei Y,Jianhe X,Jinhuan S,et al.Synthesis of novel salidroside esters by lipase-mediated acylation with various functional acyl groups[J].Journal of Bioscience and Bioengineering,2008,106(1):65 -68.
[16]Gariboldi P,Jommi G,Verotta L.Secoiridoids from Ole aeuropaea[J].Phytochemistry,1986,25(4):865 -869.
[17]Yvonne R,Prokopios M,Alexios L S,et al.Selective amination of secoiridoid glycosides to give monomeric pyridine,dimeric pyridine,and naphthyridine alkaloids[J].Natural Product Letters,2000,15(2):131-137.
