2014至2015年流感季节H7N9的新威胁
2015-04-21朱启镕
沈 军 俞 蕙 朱启镕
·综述·
2014至2015年流感季节H7N9的新威胁
沈 军 俞 蕙 朱启镕
在H7N9禽流感病毒成功进化并开始感染人类后,在已经发现的第一波和第二波病毒流行攻击后[1],H7N9尚未能获得在人际传播的能力,最近的研究发现,H7N9仍在快速的不断进化中[2~14],在人类中有较高致病性的H7N9病毒一旦获得人传人的能力后,必将在整个人群中大流行,对人类造成不可预测的冲击[3,14~20]。
在2003年2月H7N9是第一个流感季节,实验室确诊134例。至2014年10月2日,全球有453例人感染H7N9禽流感发生,死亡175例。WHO汇总数据表明,中国大陆报告438例,中国台湾报告4例,中国香港报告10例,马来西亚报告1例(中国大陆输入病例)。2014年10月29日至2015年1月8日本文成稿时,中国大陆又报告了16例,其中有活禽市场暴露史13例[1]。H7N9被发现后的22个月内,中国大陆H7N9感染病死率为38.8%(182/469),从北方至南方、从东部至西部地区均有检出,且在连续2个夏秋季节均呈散发流行,冬季局部暴发流行[1];在刚刚开始的2014至2015年流感季节中,H7N9有可能再次在中国大陆流行。
1 禽流感、猪流感、人流感及H7N9禽流感病毒
根据流感病毒核蛋白(NP)和基质蛋白(MP)的不同特性分为甲、乙、丙型(或称A、B、C型)。病毒株的命名按照抗原型别/宿主/发现地/毒株标号/分离年份/血凝素亚型/神经氨酸酶亚型原则,如A/duck/Zhejiang/12/2011(H7N3)。根据包膜糖蛋白血凝素(HA)和神经氨酸酶(NA)抗原性差异,甲型流感病毒可分为若干亚型,目前已经公认主要有16个HA亚型(H1~H16),9个NA亚型(N1~N9),HA及NA可任意组合为不同的亚型。根据宿主不同,甲型流感病毒可分为人流感病毒、禽流感病毒(AIV)、猪流感病毒(SIV)、马流感病毒及鲸流感病毒等。H17N10 和H18N11在2012年和2013年从蝙蝠中被发现,未在其他物种中发现[21,22]。在人类中流行的主要有H1N1、H2N2和H3N2亚型,也是人类季节性流感的主要流感病毒。在猪中流行的主要有H1N1、H4N6和H9N2亚型,偶尔也感染人,同时由于猪常能从鸟类、人类等其他物种感染流感病毒,使得猪成为不同病毒进行重组的重要载体或者“混合器”,使新的流感病毒产生并感染其他物种[23]。禽类可以感染除了H17N10 和H18N11外的其他HA及NA亚型,尤其是水禽为甲型流感病毒的天然宿主和基因储存库,其中H5N1、H9N2、H7N7、H5N2和H10N7等都有感染人类的报道。禽类感染流感病毒主要通过粪口途径传播,而哺乳类动物则主要通过呼吸道感染传播。乙、丙流感病毒主要在人类流行。
2013年2月在中国上海新发现的H7N9流感病毒是第1次在人类发现的新病毒[2]。对病毒基因序列的分析证明H7N9流感病毒是一种新重组产生的能感染人类、猪和禽类跨物种传播的病毒。
2013年4月17日, 世界粮农组织、世界动物卫生组织和WHO共同将新发现的H7N9流感病毒命名为甲型H7N9禽流感病毒。对不同物种感染这种病毒后采用不同表述,如人感染甲型H7N9禽流感病毒或甲型H7N9禽流感病毒造成的疾病、鸡(猪)感染甲型H7N9禽流感病毒或甲型H7N9禽流感病毒造成的鸡(猪)发病。
2 人类流感流行及暴发
流感病毒持续的抗原漂移导致人体对既往感染过的流感病毒HA及NA产生的中和抗体不能有效避免机体感染新的病毒,使得人群中持续存在一定水平的流感病毒流行或者局部地区的小规模暴发流行。当病毒包膜糖蛋白NA和HA发生较大的抗原特性改变即抗原转变时,导致较大范围的人群流感流行,甚至全球流感大流行。在人类历史上,比较明确的甲型流感病毒暴发流行见表1,真正意义上的全球大流行有7次。
3 流感病毒跨物种传播
有些流感病毒尤其是甲型流感病毒是人畜共患病原体,但并非所有的动物界流感病毒都能传播至人类。之所以有严格的种属特异性,在于病毒HA序列受体结合位点

表1 甲型流感病毒暴发流行年
能否与宿主上皮细胞(主要是呼吸道和消化道上皮细胞)的特异性受体相结合。人流感病毒能与人类呼吸道上皮细胞流感病毒受体唾液酸α-2,6半乳糖苷(SA α-2,6-Gal)结合,禽类流感病毒能与禽类呼吸道上皮细胞病毒受体唾液酸α-2,3半乳糖苷(SA α-3,6-Gal )结合,而猪的上呼吸道上皮细胞同时存在上述2种受体,故人及禽类流感病毒都能感染猪。2种受体在人类、猪、鸡的呼吸道和消化道的分布见图1。
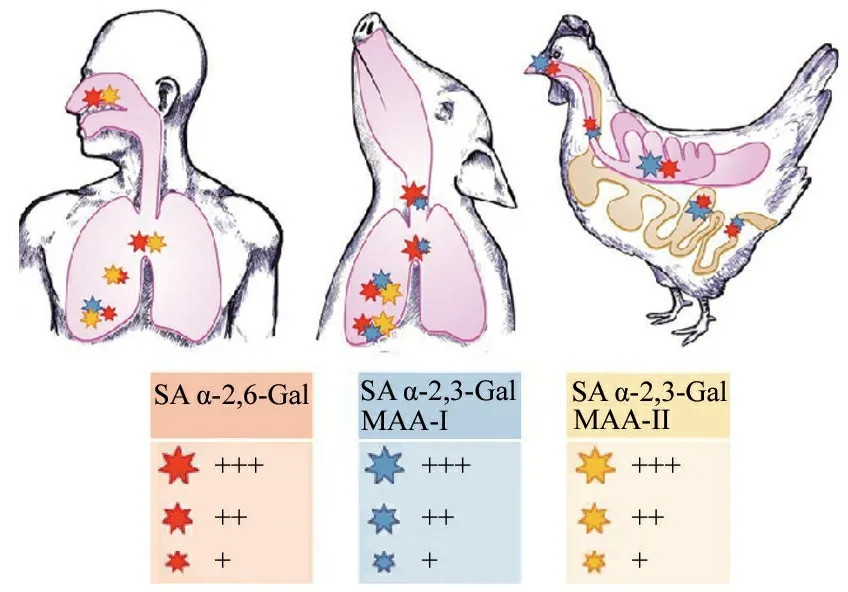
图1 SA α-2,6-Gal和SA α-2,3-Gal在人类、猪呼吸道及鸡呼吸道和消化道的分布示意图
注 MAA-Ⅰ/Ⅱ:怀槐凝集素染色-Ⅰ/Ⅱ;星的大小代表富集度(MAA在人类呼吸道和猪鼻腔未进行研究;MAA-Ⅰ在鸡组织内未进行研究)。图片引自文献[24],本文作者略有改动
流感病毒结构由外而内可以分为囊膜、基质蛋白及核心三部分。甲型和乙型流感病毒的遗传物质单股负链RNA(ssRNA)由8个节段组成,丙型流感病毒由7个节段组成。第1~3 节段编码的是RNA 聚合酶,负责病毒遗传物质RNA 转录和复制;第4节段编码血凝素蛋白HA,负责病毒侵入;第5节段编码核蛋白,负责与遗传物质RNA组装;第6节段编码神经氨酸酶NA,负责病毒释放;第7节段编码基质蛋白M1和离子通道蛋白M2,负责组成病毒的基质蛋白层;第8节段编码非结构蛋白,与RNA出核和拮抗宿主抗病毒反应等有关。丙型流感病毒缺乏第4节段,其第6节段编码的血凝素酯酶融合蛋白兼具行使病毒侵入和释放两种功能。负责病毒侵入的HA前体分子HA0裂解为HA1和HA2后,病毒才有感染性,而裂解位点氨基酸的组成,即碱性氨基酸的数量,决定病毒的毒力;如高致病性禽流感病毒裂解位点至少有4个碱性氨基酸,而低致病性禽流感可能只有1~2个碱性氨基酸。
当病毒发生基因突变或者重组,尤其是关键的裂解位点或者受体结合位点发生改变后,会导致病毒的跨种属传播。
4 H7N9的可能来源
根据对分离到的H7N9病毒核苷酸序列及同源性分析,H7N9可能是4种不同的禽流感病毒重组后产生的新病毒[2,14~18],尽管至今为止尚不知这种病毒在何种物种中产生及其主要的宿主、在动物界的地理分布及流行病学特征等。H7N9病毒H7基因序列与中国大陆地区的野鸭流感病毒同源性最高,N9基因序列与中国大陆地区的野鸟流感病毒同源性最高,6条内部基因(多聚酶PB2、PB1、PA基因、核蛋白NP基因、基质蛋白M基因、非结构蛋白NS基因)可能来源于2种不同的中国大陆地区家禽H9N2流感病毒。由于大部分实验室确诊的病例有活禽市场接触史,且在活禽市场的家禽粪便、周围被污染的环境等检测到H7及N9基因片段,人类被H7N9感染的来源可能是禽类市场的活禽及污染物,通过呼吸道或者直接接触传播感染[2,25~31]。人际间直接传播H7N9在已经确诊的病例中有发现,但很罕见,提示H7N9目前在人与人之间的传播能力非常有限[32~37],也是WHO对H7N9风险评估的主要依据[38],但H7N9仍在不断变异中。
5 H7N9可能正在发生的进化变异及带来的威胁
H7N9流感病毒出现后,在动物界及人类中表现为持续的流行,并可能持续变异,变异使病毒更易感染哺乳动物[2~16,18]。
在病毒HA受体结合位点,H7N9在关键氨基酸位点出现了变异,如G186V(即186位氨基酸由甘氨酸G变为缬氨酸V)、T160A及Q226L,使病毒更易与人呼吸道上皮细胞受体SA α-2,6-Gal 结合。既往对H5N1的研究发现,病毒HA蛋白中如果存在158D/224K/226L、110Y/160A/226L/228S和196R/226L/228S这3种突变组合中的一种,就使H5N1能在上呼吸道有效增殖并通过飞沫在流感病毒动物模型雪貂中传播[39~41]。目前分离到的H7N9病毒尚未有上述3个组合中的任何一种,但已经出现关键位点T160A和Q226L的2个氨基酸的突变,如果病毒在进化中获得3个组合中另外2个关键位点的突变,将获得在哺乳动物之间飞沫传播的能力,也可导致在人类中的大流行。实验也证明在雪貂中能复制H7N9导致的上、下呼吸道感染,但病毒通过飞沫在雪貂中传播的能力非常有限[42~45]。
H7N9的NA裂解位点仅有1个碱性氨基酸为低致病性禽流感病毒(对鸟类和禽类而言)。其NA蛋白69~73位氨基酸缺失,可能会增加病毒毒力;部分H7N9分离株出现神经氨酸酶活性位点R292K变异,导致病毒对流感病毒药物神经氨酸酶抑制剂(如奥司他韦、扎纳米韦、帕拉米韦) 耐药[46~49]。
流感病毒的离子通道蛋白M2是离子通道抑制剂金刚烷胺类药物作用靶点,M2蛋白的耐药性突变位点主要在26、27、30、31和34位氨基酸,其中任何一个氨基酸位点发生突变,都可能导致对离子通道抑制剂药物产生耐药性,目前分离到的所有H7N9都有N31S突变[49]。
此外,H7N9的PB2存在E627K突变,使得病毒在人体内更有效地合成蛋白质[4~6,50]。离子通道蛋白M1存在N30D与T215A突变,非结构蛋白NS1有P42S突变,可能使H7N9禽流感病毒增加对人的致病性[46]。
6 人类对H7N9的风险及准备
全球对流感病毒的监测网络,覆盖人类及动物界,包括了地区、国家层面与WHO全球流感监测及反应体系。在WHO官网上实时更新全球H7N9确认病例情况及不定期的专家风险评估报告。在全球,H7N9相应的疫苗研制也在进行中,但风险因素仍然存在。
H7N9禽流感病毒对全人类是一种新的病毒,整个人群对H7N9普遍易感。中国学者对既往库存的人类血清和抗体检测,未发现人类既往大范围感染H7N9的免疫学反应[51~53]。对活禽市场的工作人员行抗体检测发现,部分人体内存在抗体反应,提在这些人群既往可能感染过H7N9[54]。由此推测,H7N9感染后可能表现为轻症或亚临床感染,在目前部分实验室确认的感染病例中确实发现部分病例表现为轻症[55],而这些患者可能成为重要传染源。
由于H7N9是一种低致病性禽流感,鸟类和禽类感染后大部分表现为“沉默性感染”,增加了病毒的传播可能,在合法及非法的禽类交易市场和养殖场,H7N9病毒有大量的机会与其他流感病毒共存甚至共感染,从而增加获得新的重组基因的可能性。
在H7N9检测方法上,病毒的培养及核酸检测一般仅限于实验室及科研机构,临床用于检测流感病毒抗原的最常用的快速检测法(胶体金法)可能无法有效检测到H7N9,由此导致轻症病例及第一批重症病例可能被漏检。除了加强对H7N9流行的监测、尽量减少人群对病毒的暴露机会及加强个人手卫生外,接种流感疫苗或许也是有效的预防措施。WHO 建议北半球2014至2015年流感季(11月至次年4月)和2014年南半球流感季(5月至10月)使用流感疫苗含有以下病毒株:A/California/7/2009(H1N1)类似株、A/Texas/50/2012 (H3N2)类似株、B/Massachusetts/2/2012类似株、B/Brisbane/60/2008类似株,三价疫苗含有2株A型和1株B型,四价疫苗含有2株A型和2株B型[55]。中国的流感疫苗组成遵循WHO建议。由于H7N9与上述疫苗病毒株之间的诱生抗体的交叉免疫保护还有待于研究,在H7N9流感疫苗上市并获得大规模接种前,H7N9对人类的威胁仍可能非常之大。
7 结语
H7N9是一种新出现、能跨物种传播、并在不断进化中的病毒,对人类可能是一种新的挑战。从近百年数次流感大灾难中人类获得的经验和教训,从SARS及埃博拉病毒流行中获得借鉴,人类需保持高度警惕,希望H7N9不会引发大流行,但人类必须为应对以后必然的但又无法预测的大流行做好充分的准备。
[1]http://www.who.int/csr/don/archive/year/2014/en/
[2]Gao R,Cao B,Hu Y,et al. Human infection with a novel avian-origin influenza A (H7N9) virus. N Engl J Med,2013,368(20):1888-1897
[3]Zhu W,Shu Y. Genetic tuning of avian influenza A (H7N9) virus promotes viral fitness within different species. Microbes Infect,2015,17(2):118-122
[4]Zhang H, Li X, Guo J, et al. The PB2 E627K mutation contributes to the high polymerase activity and enhanced replication of H7N9 influenza virus. J Gen Virol,2014,95(Pt 4):779-786
[5]Song W, Wang P, Mok BW, et al. The K526R substitution in viral protein PB2 enhances the effects of E627K on influenza virus replication. Nat Commun,2014,5:5509
[6]Kirui J, Bucci MD, Poole DS, et al. Conserved features of the PB2 627 domain impact influenza virus polymerase function and replication. J Virol,2014,88(11):5977-5986
[7]Mok CK, Lee HH, Lestra M, et al. Amino acid substitutions in polymerase basic protein 2 gene contribute to the pathogenicity of the novel A/H7N9 influenza virus in mammalian hosts. J Virol, 2014, 88(6):3568-3576
[8]Liu Q, Zhou B, Ma W et al. Analysis of recombinant H7N9 wild-type and mutant viruses in pigs shows that the Q226L mutation in HA is important for transmission. J Virol,2014,88(14):8153-8165
[9]Danzy S, Studdard LR, Manicassamy B, et al. Mutations to PB2 and NP proteins of an avian influenza virus combine to confer efficient growth in primary human respiratory cells. J Virol,2014,88(22):13436-13446
[10]Morrison J, Josset L, Tchitchek N, et al. H7N9 and other pathogenic avian influenza viruses elicit a three-pronged transcriptomic signature that is reminiscent of 1918 influenza virus and is associated with lethal outcome in mice. J Virol,2014,88(18):10556-10568
[11]Peng J, Yang H, Jiang H, et al. The origin of novel avian influenza A (H7N9) and mutation dynamics for its human-to-human transmissible capacity. PLoS One,2014,9(3):e93094
[12]Xu L, Bao L, Deng W, et al. Rapid adaptation of avian H7N9 virus in pigs. Virology, 2014, 452-453:231-236
[13]Xiong X, Martin SR, Haire LF et al. Receptor binding by an H7N9 influenza virus from humans. Nature, 2013,12(4):1333-1345
[14]To KK, Song W, Lau SY, et al. Unique reassortant of influenza A(H7N9) virus associated with severe disease emerging in Hong Kong. J Infect,2014,69(1):60-68
[15]Husain M.Avian influenza A (H7N9) virus infection in humans: Epidemiology, evolution, and pathogenesis. Infect Genet Evol, 2014, 28:304-312
[16]Gostin LO, Phelan A, Stoto MA, et al. Virus sharing, genetic sequencing, and global health security. Science, 2014,345(6202):1295-1296
[17]Liu D, Shi W, Shi Y, et al. Origin and diversity of novel avian influenza A H7N9 viruses causing human infection: Phylogenetic,structural,and coalescent analyses. Lancet,2013,381(9881):1926-1932
[18]Lam TT, Wang J, Shen Y, et al. The genesis and source of the H7N9 influenza viruses causing human infections in China. Nature,2013,502(7470):241-244
[19]Shi Y, Wu Y, Zhang W et al. Enabling the ′host jump′: structural determinants of receptor-binding specificity in influenza A viruses.Nat Rev Microbiol,2014,12(12): 822-831
[20]Watanabe T, Watanabe S, Maher EA et al. Pandemic potential of avian influenza A (H7N9) viruses. Trends Microbiol,2014,22(11):623-631
[21]Tong S, Li Y, Rivailler P, Conrardy C, et al. A distinct lineage of influenza A virus from bats. Proc Natl Acad Sci U S A, 2012,109(11):4269-4274
[22]Tong S, Zhu X, Li Y, et al. New world bats harbor diverse influenza A viruses. PLoS Pathog,2013,9(10):e1003657
[23]Ma W, Lager KM, Vincent AL,et al. The role of swine in the generation of novel influenza viruses. Zoonoses Public Health,2009,56(6-7):326-337
[24]de Graaf M, Fouchier RA. Role of receptor binding specificity in influenza A virus transmission and pathogenesis. EMBO J,2014,33(8):823-841
[25]Hsieh YH, Wu J, Fang J, Yang Y, Quantification of Bird-to-Bird and Bird-to-Human Infections during 2013 Novel H7N9 Avian Influenza Outbreak in China. PLoS One, 2014,9(12):e111834
[26]Yu X, Jin T, Cui Y, et al. Influenza H7N9 and H9N2 viruses coexistence in poultry linked to human H7N9 infection and genome characteristics. J Virol,2014,88(6):3423-3431
[27]Ke C, Lu J, Wu J et al. Circulation of Reassortant Influenza A(H7N9) Viruses in Poultry and Humans, Guangdong Province, China, 2013. Emerg Infect Dis,2014,20(12):2034-2040
[28]Liu W, Fan H, Raghwani J, et al. Occurrence and reassortment of avian influenza A (H7N9) viruses derived from coinfected birds in China. J Virol,2014 ,88(22):13344-13351
[29]Fan M, Huang B, Wang A, et al. Human influenza A(H7N9) virus infection associated with poultry farm, Northeastern China. Emerg Infect Dis,2014,20(11): 1902-1905
[30]Ma X, Liao Q, Yuan J, et al. Knowledge, attitudes and practices relating to influenza A(H7N9) risk among live poultry traders in Guangzhou City, China. BMC Infect Dis,2014,14:554
[31]Pantin-Jackwood MJ, Miller PJ, et al. Role of poultry in the spread of novel H7N9 influenza virus in China. J Viro,2014,88(10):5381-5390
[32]Ding H, Chen Y, Yu Z, et al. A family cluster of three confirmed cases infected with avian influenza A (H7N9) virus in Zhejiang Province of China. BMC Infect Dis,2014,14(1):3846
[33]Gao HN, Yao HP, Liang WF, et al. Viral genome and antiviral drug sensitivity analysis of two patients from a family cluster caused by the influenza A(H7N9) virus in Zhejiang, China, 2013. Int J Infect Dis,2014,29:254-258
[34]Hu J, Zhu Y, Zhao B, et al. Limited human-to-human transmission of avian influenza A(H7N9) virus, Shanghai, China, March to April 2013. Euro Surveill, 2014,19(25):20838
[35]Xiao XC, Li KB, Chen ZQ, et al. Transmission of avian influenza A(H7N9) virus from father to child: a report of limited person-to-person transmission, Guangzhou, China,January 2014. Euro Surveill,2014,19(25):20837
[36]Liu T, Bi Z, Wang X, et al. One family cluster of avian influenza A(H7N9) virus infection in Shandong, China. BMC Infect Dis,2014,14:98
[37]Song R, Pang X, Yang P, et al. Surveillance of the first case of human avian influenza A (H7N9) virus in Beijing, China. Infection,2014,42(1):127-133
[38]http://www.who.int/influenza/human_animal_interface/influenza_h7n9/Risk_Assessment/en/
[39]Imai M, Watanabe T, Hatta M, et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature,2012,486(7403):420-428
[40]Russell CA, Fonville JM, Brown AE, et al.The potential for respiratory droplet-transmissible A/H5N1 influenza virus to evolve in a mammalian host. Science,2012,236(6088):1541-1547
[41]Chen LM, Blixt O,Stevens J, et al. In vitro evolution of H5N1 avian influenza virus toward human-type receptor specificity. Virology,2012,422(1):105-113
[42]Richard M, Schrauwen EJ, de Graaf M,,et al. Limited airborne transmission of H7N9 influenza A virus between ferrets. Nature,2013,501(7468):560-563
[43]Zhu H, Wang D, Kelvin DJ, et al. Infectivity, transmission, and pathology of human-isolated H7N9 influenza virus in ferrets and pigs. Science,2013,341(6142):183-186
[44]Belser JA, Gustin KM, Pearce MB, et al. Pathogenesis and transmission of avian influenza A (H7N9) virus in ferrets and mice. Nature,2013,501(7468):556-559
[45]Zhang Q, Shi J, Deng G, et al. H7N9 influenza viruses are transmissible in ferrets by respiratory droplet. Science,2013,341(6144):410-414
[46]Kageyama T, Fujisaki S, Takashita E, et al. Genetic analysis of novel avian A(H7N9) influenza viruses isolated from patients in China, February to April 2013. Euro Surveill,2013,18(15):20453
[47]Hu Y, Lu S, Song Z, et al. Association between adverse clinical outcome in human disease caused by novel influenza A H7N9 virus and sustained viral shedding and emergence of antiviral resistance. Lancet,2013,381(9885):2273-2279
[48]Woods CJ, Malaisree M, Long B, et al. Computational assay of H7N9 influenza neuraminidase reveals R292K mutation reduces drug binding affinity. Sci Rep,2013,3:3561
[49]Yen HL, McKimm-Breschkin JL, Choy KT, , et al. Resistance to neuraminidase inhibitors conferred by an R292K mutation in a human influenza virus H7N9 isolate can be masked by a mixed R/K viral population. MBio,2013,4(4). pii: e00396-13
[50]Danzy S, Studdard LR, Manicassamy B, et al. Mutations to PB2 and NP proteins of an avian influenza virus combine to confer efficient growth in primary human respiratory cells. J Virol,2014,88(22):13436-13446
[51]Ge FF, Ju HB, Yang DQ, et al. Epidemiological situation and genetic analysis of H7N9 influenza viruses in Shanghai in 2013. Arch Virol,2014,159(11):3029-3041
[52]Wang X, Fang S, Lu X, et al. Seroprevalence to avian influenza A(H7N9) virus among poultry workers and the general population in southern China: a longitudinal study. Clin Infect Dis,2014,59(6):76-83
[53]Bai T, Zhou J, Shu Y. Serologic study for influenza A (H7N9) among high-risk groups in China. N Engl J Med,2013,368(24):2339-2340
[54]Chen Z, Li K, Luo L, et al. Detection of avian influenza A(H7N9) virus from live poultry markets in Guangzhou, China: a surveillance report. PLoS One,2014,9(9):e107266
[55]Peng Z,Xie Y,Wang Q, et al. Clinical severity of human infections with avian influenza A(H7N9) virus, China,2013/14. Euro Surveill,2014,19(49). pii: 20984
[56]http://www.who.int/influenza/vaccines/virus/candidates_reagents/home/en/
(本文编辑:张萍)
10.3969/j.issn.1673-5501.2015.01.014
上海市卫生系统重点学科建设项目基金:08GWZX0102
复旦大学附属儿科医院 上海,201102
朱启镕,E-mail:qrzhu@shmu.edu.cn
2014-11-07
2015-01-17)
